Acides du vin

Les acides du vin sont un élément important à la fois dans la vinification et le produit fini du vin. Ils sont présents à la fois dans le raisin et dans le vin, influençant directement la couleur, l'équilibre et le goût du vin, ainsi que la croissance et la vitalité de la levure pendant la fermentation et protégeant le vin des bactéries.
La mesure de la quantité d'acidité dans le vin est appelée « acidité titrable » ou « acidité totale », ce qui correspond au test qui donne le total de tous les acides présents, tandis que la force de l'acidité est mesurée en fonction du pH, avec la plupart des vins ayant un pH compris entre 2,9 et 3,9. En règle générale, plus le pH est bas, plus l'acidité du vin est élevée. Cependant, il n'y a pas de lien direct entre l'acidité totale et le pH (il est possible de trouver des vins ayant un pH élevé pour le vin et une acidité élevée)[1].
En dégustation, le terme « acidité » fait référence aux attributs frais, vif et aigre du vin qui sont évalués par rapport à la façon dont les soldes d'acidité sur les douceurs et composants amers du vin tels que des tanins. Trois acides primaires sont présents dans les raisins de cuve : les acides tartrique, malique et citrique. Au cours de la vinification et dans les vins finis, les acides acétique, butyrique, lactique et succinique peuvent jouer des rôles importants. La plupart des acides impliqués dans le vin sont des acides fixes, à l'exception notable de l'acide acétique, que l'on trouve principalement dans le vinaigre, qui est volatil et peut contribuer au défaut de vin appelée « piqûre acétique ». Parfois, des acides supplémentaires, tels que les acides ascorbiques, sorbiques et sulfureux, sont utilisés dans la vinification[2].
Acide tartrique[modifier | modifier le code]

L'acide tartrique est, du point de vue de la vinification, le plus important en raison du rôle prépondérant qu'il joue dans le maintien de la stabilité chimique du vin, dans le soutien de sa couleur par la teneur élevée en acide, et finalement dans l'influence du goût du vin fini. La forte résistance chimique du vin est en effet influencée par une forte proportion d'acide, qui confère au vin un meilleur potentiel de vieillissement. Dans la plupart des plantes, cet acide organique est rare, mais on le trouve à des concentrations significatives dans les vignes. Avec l'acide malique et, dans une moindre mesure, l'acide citrique, le tartrique est l'un des acides fixes présents dans le raisin de cuve. La concentration varie en fonction du cépage et de la teneur en sol du vignoble. Certains cépages, tels que le palomino, sont naturellement disposées à avoir des niveaux élevés d'acide tartrique, tandis que le malbec et le pinot noir ont généralement des niveaux plus faibles. Pendant la floraison, des niveaux élevés d'acide tartrique sont concentrés dans les fleurs de raisin, puis dans les jeunes baies. Au fur et à mesure de la maturation de la vigne, l'acide tartrique ne se métabolise pas par la respiration comme l'acide malique. Pendant la maturation des baies, la concentration en acide tartrique diminue. En raison de l'augmentation de la taille des baies, la proportion constamment élevée d'acide tartrique est de plus en plus diluée[3].
Bien qu'il existe des différences entre les cépages et les régions viticoles, environ la moitié des gisements sont généralement solubles dans le mélange alcoolique du vin, la majorité de la concentration étant présente sous forme de sel d'acide de potassium. Pendant la fermentation, ces tartrates s'associent en cristallisant à partir des lies, des débris de pulpe, des tanins et des pigments précipités. Les cristaux de tartre affectent la clarté du vin et peuvent ainsi réduire le plaisir de dégustation. La cristallisation de ces tartrates peut se produire à des moments imprévisibles et, dans une bouteille de vin, elle peut ressembler à du verre brisé. Le tartre est observé dans la bouteille en fonction du type de stockage sur le bouchon ou sur le fond. Le tartre est insipide et est perçu comme du sable dans la bouche. Étant donné que ce gisement inoffensif a souvent donné lieu à des plaintes (sans fondement), bon nombre des vins grand public actuels subissent une stabilisation dite «tartrique». Pour cela, les vignerons vont refroidir le vin à 4 °C ou moins pendant deux semaines pour encourager la cristallisation et la précipitation des tartrates du vin[3] ou procéder à une électrodialyse qui les élimine par un processus membranaire.
La teneur en acide tartrique peut être facilement déterminée grâce à un test rapide (Rebelein). L'acide tartrique dans le vin est converti avec un dérivé d'ammonium, le monovanadate d'ammonium, en un complexe de couleur jaune orangé. L'intensité de la coloration est mesurée optiquement à une longueur d'onde de 540 nm par photométrie. La teneur en acide tartrique est lue dans une table de conversion[4].
Acide malique[modifier | modifier le code]

L'acide malique, avec l'acide tartrique, est l'un des principaux acides organiques présents dans les raisins de cuve. On le trouve dans presque tous les fruits et plantes à baies, mais il est le plus souvent associé aux pommes vertes (non mûres), l'arôme qu'il transmet le plus facilement au vin. Son nom vient du latin malum qui signifie « pomme ». Dans la vigne, l'acide malique se forme dans le tissu contenant la chlorophylle de la baie par métabolisme du sucre et intervient dans plusieurs processus essentiels à la santé et à la durabilité de la vigne. Sa structure chimique lui permet de participer aux réactions enzymatiques qui transportent l’énergie dans toute la vigne. Sa concentration varie en fonction du cépage, et certaines variétés, comme barbera, carignan, colombard, riesling et sylvaner, en dispose naturellement à des niveaux élevés. Les niveaux d'acide malique dans les baies de raisin sont à leur apogée juste avant la véraison, et peuvent atteindre jusqu'à 20 g/l. Au fur et à mesure que la vigne progresse au cours de la phase de maturation des baies, l'acide malique est métabolisé lors du processus respiratoire et, à la récolte, sa concentration peut atteindre 1 à 9 g/l. L'acide malique est un bon indicateur permettant de vérifier que la maturité du fruit n'a pas encore été atteinte. La quantité d'acide malique restant à maturité est fonction du millésime, de la zone de culture et du microclimat, et constitue donc une cause importante de différences de qualité liées au millésime ou à la localisation. La vitesse de dégradation dépend fortement de la température et peut être supérieure au taux de maturation physiologique, en particulier aux températures nocturnes élevées. La perte respiratoire de l'acide malique est plus prononcée dans les climats plus chauds. Lorsque tout l'acide malique est utilisé dans le raisin, il est considéré comme « trop mûr » ou sénescent. Les moûts peu acides produisent des vins plats et ne sont pas suffisamment stables sur le plan microbien. Les viticulteurs doivent compenser cette perte en ajoutant à la cave de l'acide étranger dans un processus appelé acidification[5].
L'acide malique peut être réduit davantage pendant le processus de vinification par fermentation malolactique (FML). Dans ce processus, les bactéries convertissent l'acide malique, plus agressif, en acide lactique moins fort. Pour certains vins, en particulier ceux issus de cépages plutôt neutres, cette conversion peut être bénéfique, surtout si le vin présente des teneurs excessives en acide malique. Pour les autres vins, tels que le sauvignon blanc et le gewurztraminer, cela produit des arômes (comme l’odeur de beurre du diacétyle) qui ne seraient pas attrayants pour ces cépages naturellement fruités. Dans les raisins sains, on ne trouve que de petites quantités de bactéries lactiques sur les baies. La bactérie à l'origine de ce processus se trouve naturellement dans la cave, dans les tonnelleries qui fabriquent des fûts de chêne et abriteront une population de bactéries, ou pourront être introduites par le vigneron avec des spécimens de culture. La fermentation malolactique, jadis sporadique et spontanée, est maintenant effectuée de manière ciblée, en particulier dans les vins rouges. Cette fermentation est toujours effectuée dans le fût en bois avec des bactéries lactiques inoculées. En général, les vins rouges sont plus souvent soumis à la FML que les blancs, ce qui augmente la probabilité de trouver de l'acide malique dans les vins blancs (bien que des exceptions notables, telles que le chardonnay, soient souvent soumises à la FML)[5].
Formellement, l'acide malique est polyprotique (apporte plusieurs protons, ici deux), tandis que l'acide lactique est monoprotique (contribue à un proton) et n'a donc que la moitié de l'effet sur l'acidité (pH) ; de même, la première constante d'acidité (pKa) de l'acide malique (3,4 à température ambiante) est inférieure à la constante d'acidité (unique) de l'acide lactique (3,86 à température ambiante), indiquant une acidité plus forte. Ainsi, après la FML, le vin a un pH plus élevé (moins acide) et une sensation en bouche différente.
Acide lactique[modifier | modifier le code]

Beaucoup plus doux que le tartrique et le malique, l'acide lactique est souvent associé aux saveurs « laiteuses » dans le vin et est l'acide primaire du yaourt et de la choucroute. L'acide monocarboxylique ne se produit pas naturellement dans les baies. Il est produit lors de la vinification par des bactéries lactiques (LAB), qui comprennent trois genres : l'œnococcus, le pédiococcus et le lactobacille. Ces bactéries transforment à la fois le sucre et l’acide malique en acide lactique, ces derniers via la fermentation malolactique. Le dioxyde de carbone se forme également en tant que sous-produit. Les mécanismes de la fermentation malolactique ne sont compris que depuis les années 1960 et ont depuis été utilisés spécifiquement dans la production de vin. Ce processus peut être bénéfique pour certains vins, en ajoutant de la complexité et en adoucissant la dureté de l'acidité malique, mais il peut transformer certains arômes et générer de la turbidité chez d'autres, si la dégradation de l'acide n'est pas contrôlée. Les vins blancs, par exemple, perdent leur fruité et ne sont donc pas toujours les bienvenus pour subir une dégradation acide, en particulier les vins issus de cépages aromatiques comme le sauvignon blanc ou le gewurztraminer. Certaines souches de bactéries lactiques peuvent produire des amines biogènes, telles que l'histamine, la tyramine, la putrescine et la phényléthylamine, qui peuvent être à l'origine de maux de tête chez certains buveurs de vin. Les vignerons souhaitant contrôler ou empêcher la fermentation malolactique peuvent utiliser du dioxyde de soufre pour assommer les bactéries. Enlever rapidement le vin de ses lies aidera également à contrôler les bactéries, car les lies sont une source de nourriture vitale pour elles. Les vignerons doivent également faire très attention aux fûts et aux équipements de vinification auxquels le vin est exposé, en raison de la capacité de la bactérie à s’enfoncer profondément dans les fibres de bois. Un développement dans le fût est donc problématique si le vin ne doit pas passer par la fermentation malolactique. Par ailleurs, un tonneau de vin qui a complété une fermentation malolactique réussie va presque toujours induire une fermentation malolactique dans chaque vin stocké[6].
Acide citrique[modifier | modifier le code]
Bien que très répandu dans les agrumes, comme le citron vert, l'acide citrique ne se trouve qu'en très petites quantités dans les raisins de cuve. Il a souvent une concentration d'environ 1/20 de celle de l'acide tartrique, soit dans des proportions de 0,1 à 0,4 g/l. L'acide citrique que l'on trouve le plus souvent dans le vin est constitué de suppléments acides (jusqu'à 0,5 g/l) produits dans le commerce et dérivés de solutions de saccharose en fermentation. Ces suppléments peu coûteux peuvent être utilisés en acidification par les viticulteurs pour stimuler l'acidité totale du vin. Avec ces petites quantités supplémentaires, l'acide ne peut pas être détecté sensoriellement et aide les vins peu acides à avoir plus de structure et de fraîcheur. Il est moins utilisé que le tartrique et le malique en raison des arômes citriques agressifs qu'il peut ajouter au vin. Lorsque de l'acide citrique est ajouté, il est toujours effectué après la fermentation alcoolique, dans du vin microbiologiquement stable, en raison de la tendance de la levure à convertir l'acide citrique en acide acétique. En cas de fermentation malolactique, l'acide citrique est dégradé par les bactéries lactiques. Dans l'Union européenne, l'utilisation de l'acide citrique pour l'acidification est interdite, mais l'utilisation limitée d'acide citrique est autorisée pour éliminer du vin le fer et le cuivre en excès si le ferrocyanure de potassium n'est pas disponible. La limite est de 1 g/l[7].
Autres acides[modifier | modifier le code]
L'acide acétique est un acide organique à deux carbones produit dans le vin pendant ou après la période de fermentation. Il est le plus volatil des acides primaires associés au vin et est responsable du goût acide du vinaigre. Pendant la fermentation, l'activité des cellules de levure produit naturellement une petite quantité d'acide acétique. Si le vin est exposé à l'oxygène, les bactéries Acetobacter vont convertir l'éthanol en acide acétique. Ce processus est connu sous le nom d'acétification du vin et constitue le processus principal de la dégradation du vin en vinaigre. Une quantité excessive d'acide acétique est considérée comme un défaut du vin. La sensibilité d'un dégustateur à l'acide acétique varie, mais les dégustateurs sensibles peuvent détecter une piqûre acétique déjà à une concentration de 0,5 g/l[2]. Les vins blancs sont considérés comme gâtés par la réglementation avec plus de 1,08 g/l et les vins rouges, en raison de tanins plus forts, avec plus de 1,2 g/l. Une véritable piqûre acétique ne se remarque chez ces vins au nez qu'à partir de 1,5 g/l d'acidité volatile. Les vins doux constituent une exception, car les arômes concentrés peuvent dissimuler une légère piqûre. Dans ce cas, la limite supérieure légale est de 1,8 g/l. L'acide acétique peut déjà être présent dans le moût, par exemple, lorsque la grêle ou les morsures d'oiseaux endommagent les raisins et que les bactéries présentes sur la peau des raisins entrent en contact avec le sucre des baies. Dans les cas extrêmes, même dans le vignoble, une légère piqûre est perceptible.
L'acide ascorbique, également connu sous le nom de vitamine C, se trouve dans les jeunes raisins avant la véraison, mais il se perd rapidement au cours du processus de maturation. Sa teneur dans le raisin est inférieure à 20 mg/l soit dix fois inférieure à celle des agrumes. En vinification, il est utilisé avec du dioxyde de soufre comme antioxydant, souvent ajouté lors de la mise en bouteille des vins blancs. Dans l'Union européenne, l'utilisation de l'acide ascorbique en tant qu'additif est limitée à 150 mg/l[8].

L'acide butyrique est un défaut du vin induit par une bactérie qui peut provoquer une odeur de camembert, de parmesan ou de beurre/graisse rance. L'acide butyrique peut être le résultat d'une fermentation malolactique incorrecte[9].
L'acide sorbique est un additif de vinification souvent utilisé dans les vins doux comme agent de conservation contre la croissance des champignons, des bactéries et des levures. Contrairement au dioxyde de soufre, il ne nuit pas à la croissance des bactéries lactiques. Dans l'Union européenne, la quantité d'acide sorbique pouvant être ajoutée est limitée — pas plus de 200 mg/l. Souvent, l'acide est utilisé sous forme de sorbate de potassium (max 275 mg/l). La plupart des humains ont un seuil de détection de 135 mg/l, certains présentant une sensibilité pour détecter sa présence à 50 mg/l. L'acide sorbique peut produire des arômes et des saveurs que l'on peut qualifier de « rance ». Si après l'addition de l'acide, la fermentation malolactique commence involontairement, les bactéries lactiques métabolisent les sorbates dans le vin, et cela crée un défaut du vin qui est reconnaissable par un arôme de feuilles de Geranium écrasée. Le composé responsable est le 2-éthoxyhexa-3,5-diène, dont le seuil de détection est très faible (0,001 mg/l)[10].
L'acide succinique se trouve le plus souvent dans le vin, mais peut également être présent à l'état de traces dans les raisins mûrs. Bien que la concentration varie entre les cépages, elle se trouve généralement à des niveaux plus élevés avec les raisins rouges. L'acide est créé en tant que sous-produit de la métabolisation de l'azote par les cellules de levure pendant la fermentation. Il est autorisé dans l'UE en tant qu'additif alimentaire sous le numéro E363 et sert, par exemple, d'exhausteur de goût. Alors que l'acide succinique a un goût légèrement amer et salé, le monométhylsuccinate estérifié apporte une légère composante fruitée au vin[11].
Le tableau suivant donne un aperçu des acides organiques pouvant être détectés dans le vin.
| Désignation | Nom UICPA | Formule structurelle |
Masse molaire (g/mol) |
Constante d'acidité |
Origine |
|---|---|---|---|---|---|
| Acide tartrique | acide 2,3-dihydroxybutanedioïque | 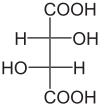
|
150 | 3,01 / 4,37 | Baie saine |
| Acide malique | acide 2-hydroxybutanedioïque | 
|
134,09 | 3,46 / 5,13 | Baie saine |
| Acide citrique | acide 2-hydroxypropane-1,2,3-tricarboxylique | 192,43 | 3,14 / 5,74 | Baie saine | |
| Acide ascorbique | (R)-5-[(S)-1,2-dihydroxyéthyl]-3,4-dihydroxy-5H-furan-2-one | 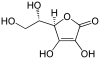
|
176,13 | 4,10 | Baie saine |
| Acide oxalique | acide éthanedioïque | 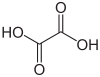
|
90,04 | 1,27 / 4,28 | Baie saine |
| Acide glycolique | acide hydroxyacétique | 
|
76,05 | 3,83 | Baie saine |
| Acide fumarique | acide trans-butènedioïque | 
|
116,07 | 3,03 / 4,44 | Baie saine |
| Acide glucuronique | acide 3,4,5,6-tétrahydroxytétrahydropyranne-2-carboxylique | 
|
194,14 | Baie saine + Botrytis | |
| Acide galacturonique | 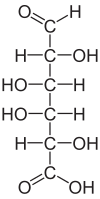
|
194,14 | Baie saine + Botrytis | ||
| Acide gluconique | acide 2,3,4,5,6-pentahydroxyhexanoïque | 
|
196,16 | 3,86 | Baie saine + Botrytis |
| Acide mucique | acide 2,3,4,5-tétrahydroxyadipique | 
|
210,14 | Baie saine + Botrytis |
En vinification[modifier | modifier le code]

L'acidité est la plus élevée dans les raisins de cuve juste avant le début de la véraison, qui inaugure la période de maturité du cycle annuel des vignes. À mesure que les raisins mûrissent, leur taux de sucre augmente et leur acidité diminue. Par le processus de respiration, l'acide malique est métabolisé par la vigne. Les raisins provenant des régions vinicoles de climat plus frais ont généralement des niveaux d'acidité plus élevés en raison du processus de maturation plus lent. Le niveau d'acidité encore présent dans le raisin est un facteur important à prendre en compte par les viticulteurs pour décider quand commencer la récolte. Pour les vins comme le champagne et autres vins mousseux par conséquent, une acidité élevée est encore plus vitale dans le processus de vinification, de sorte que les raisins sont souvent cueillis à maturité et à des niveaux d'acide plus élevés[2].
Dans le processus de vinification, les acides aident à améliorer l'efficacité du dioxyde de soufre pour protéger les vins contre la détérioration et peuvent également protéger le vin contre les bactéries en raison de l'incapacité de la plupart des bactéries à survivre dans des solutions à faible pH. Acetobacter et les bactéries lactiques constituent deux exceptions notables. Dans les vins rouges, l'acidité contribue à préserver et à stabiliser la couleur du vin. L'ionisation des anthocyanes est influencée par le pH, de sorte que les vins à pH plus faible (comme les vins à base de sangiovese) ont des couleurs plus rouges et plus stables. Les vins ayant un pH plus élevé (comme les vins à base de syrah) ont des niveaux plus élevés de pigments bleus moins stables, prenant éventuellement une teinte grisâtre boueuse. Ces vins peuvent également développer une teinte brunâtre. Dans les vins blancs, un pH plus élevé (faible acidité) fait que les composés phénoliques du vin s'assombrissent et finissent par polymériser sous forme de dépôts bruns[2].
Les viticulteurs ajoutent parfois des acides au vin (acidification) pour rendre le vin plus acide, le plus souvent dans les régions à climat chaud où les raisins sont souvent récoltés à un stade avancé de maturité avec des taux élevés de sucres mais très faibles en acide. L'acide tartrique est le plus souvent ajouté, mais les viticulteurs ajoutent parfois de l'acide citrique ou malique. Les acides peuvent être ajoutés avant ou après la fermentation primaire. Ils peuvent être ajoutés pendant le mélange ou le vieillissement, mais l'acidité accrue deviendra plus perceptible pour les dégustateurs si elle est ajoutée à ce stade[2].
Dans la dégustation de vins[modifier | modifier le code]
L'acidité du vin est un élément important de la qualité et du goût du vin. Il ajoute une netteté aux arômes et est détecté plus facilement par une sensation de picotement sur les côtés de la langue et un arrière-goût appétissant. L'équilibre entre l'acidité, la douceur du vin (le sucre résiduel) et les composants les plus amers du vin (notamment les tanins mais également d'autres composés phénoliques) est particulièrement important. Un vin trop acide aura un goût excessivement acide et vif. Un vin trop peu acidulé aura un goût mou et plat, avec des arômes moins définis[2]. Il existe une multitude de descripteurs qualifiant l’impression gustative déterminée par l’acide : mordant, vert, vif, croquant, acidulé, pétillant, nerveux.
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Acids in wine » (voir la liste des auteurs) et en allemand « Säure (Wein) » (voir la liste des auteurs).
- (en) R. B. Bellman et J. F. Gallander, Advances in Food Research, vol. 25, Academic Press ; Chichester, C. O. ; Mrak, Emil Marcel ; Stewart, George Franklin, , 3 p. (ISBN 0-12-016425-6, lire en ligne), « Wine Deacidification »
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 2–3, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 681, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (de) Bestimmung der Weinsäure (nach Rebelein) Universität Hohenheim.
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 421–422, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 387, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 171, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 35–36, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) Two Mountain Retreats, 2 States and both Dedicated to Wine [PDF], Sommelier News, octobre 2003, vol. 3, no 67AJ, p. 10, International Sommelier Guild (consulté le 30 septembre 2018).
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 644, Oxford University Press, 2006 (ISBN 0-19-860990-6)
- (en) J. Robinson (éd.), The Oxford Companion to Wine, 3e éd., p. 665, Oxford University Press, 2006 (ISBN 0-19-860990-6)
Bibliographie[modifier | modifier le code]
- .
- Pascal Ribéreau-Gayon, Yves Glories, Alain Maujean et Denis Dubourdieu, Traité d'oenologie : Chimie du vin - Stabilisation et traitements, t. 2, Dunod, , 6e éd., 624 p. (ISBN 2100588753, lire en ligne).
- Guillaume Girard, Bases scientifiques et technologiques de l'oenologie, Lavoisier, , 2e éd. (ISBN 978-2-7430-6346-7, lire en ligne), p. 17-22.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- « Les acides », sur Wine happened?.
- Carole Feilhes, « Les acides organiques du raisin », sur Institut français de la vigne et du vin.
- « L’acidité dans votre verre de vin », sur Bordeaux Wine Campus, .
- Pascal-Antoine Christin et Olivier Junod, « La chimie du vin - Composition du vin », sur Futura, .

