Carvone
| (S)-(+)-Carvone | |

| |
| Identification | |
|---|---|
| Nom UICPA | (5S)-2-méthyl-5-(prop-1-én-2-yl)cyclohex-2-én-1-one |
| No CAS | (RS) D(+) ou (S) |
| No ECHA | 100.002.508 |
| No CE | 218-827-2 D(+) ou (S) |
| FEMA | 2249 |
| SMILES | |
| InChI | |
| Apparence | huile jaunâtre, odeur de cumin |
| Propriétés chimiques | |
| Formule | C10H14O [Isomères] |
| Masse molaire[1] | 150,217 6 ± 0,009 3 g/mol C 79,96 %, H 9,39 %, O 10,65 %, |
| Propriétés physiques | |
| T° ébullition | 230 à 231 °C |
| Solubilité | Insol. dans l'eau |
| Écotoxicologie | |
| DL50 | 3 562 mg·kg-1 (rat, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| (R)-(–)-Carvone | |

| |
| Identification | |
|---|---|
| No CAS | L(–) ou (R) |
| No ECHA | 100.002.508 |
| No CE | 229-352-5 L(–) ou (R) |
| Apparence | huile incolore, odeur de menthe |
| Propriétés chimiques | |
| Formule | C10H14O [Isomères] |
| Masse molaire[2] | 150,217 6 ± 0,009 3 g/mol C 79,96 %, H 9,39 %, O 10,65 %, |
| Propriétés physiques | |
| T° ébullition | 230 à 231 °C |
| Solubilité | Insol. dans l'eau |
| Précautions | |
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 1 640 mg·kg-1 (rat, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|

La carvone (2-méthyl-5-(1-méthyléthènyl)-2-cyclohexén-1-one) (C10H14O) est un liquide incolore à jaune pâle ayant un point d'ébullition de 230 °C. La molécule de carvone appartient à la famille des terpènes et possède un carbone asymétrique. Elle existe donc sous deux formes (des énantiomères) ayant les mêmes propriétés chimiques et physiques et qui ne diffèrent que par leur pouvoir rotatoire.
La R-carvone (l-carvone) (lévogyre) est présente en grande quantité dans les essences de menthe verte. La S-carvone (d-carvone) (dextrogyre) est le constituant majeur des essences extraites d'aneth et des graines de carvi. On en trouve également dans les essences issues des peaux d'oranges. Beaucoup d'essences naturelles, comme celles extraites de la menthe poivrée, contiennent des carvones en petites quantités.
Fait assez rare parmi les énantiomères volatils, les deux molécules possèdent une odeur différente alors que leur composition chimique est rigoureusement la même. Ceci confirme le fait que les récepteurs olfactifs de l'homme sont sensibles à la chiralité des molécules.
Historique
[modifier | modifier le code]Dans l'Antiquité, les Romains ont utilisé le cumin à des fins thérapeutiques, mais la carvone n'a été isolée qu'en 1881 par Varrentrapp sous le nom de carvol donné par Schweizer. Goldschmidt et Zürrer l'ont identifié comme une cétone apparentée au limonène. Georg Wagner en a précisé sa structure en 1894.
Dangerosité
[modifier | modifier le code]La dose létale 50 par voie orale de carvone pour un rat est de 3 562 mg·kg-1.
La DL50 de la (S)-(+)-carvone = 1,64 g/kg [Rat, voie orale] et de 5,4 g/kg pour l'isomère R (Bruneton Jean, Pharmacognosie, Phytochimie, Plantes médicinales, Ed° Lavoisier Tec & Doc, 5ème éd°, 2016, p.757).
Préparation
[modifier | modifier le code]La forme dextrogyre est obtenue par distillation fractionnée de l'huile de cumin des prés. Pour la forme lévogyre, on part d'huile la contenant pour former un composé d'addition avec le sulfure d'hydrogène. Ce produit est décomposé dans l'alcool par l'hydroxyde de potassium et distillé à la vapeur. L'énantiomère lévogyre peut être également préparé par oxydation du R-limonène en nitrosochlorure de limonène, dont la déshydrohalogénation conduit au carvoxime, qui, après hydrolyse, donne la R-carvone. Cette voie synthétique est bon marché car le limonène est extrait des peaux d'oranges issues de l'industrie du jus de fruit.
Propriétés chimiques
[modifier | modifier le code]Réduction
[modifier | modifier le code]La carvone contenant trois doubles liaisons est susceptible de donner des réactions de réduction. Le résultat de la réduction dépend des réactifs et des conditions sous lesquelles se déroulent les réactions. L'hydrogénation catalytique de la carvone (1) peut donner le carvomenthol (2) ou la carvomenthone (3). Une réduction au zinc dans l'acide acétique donne la dihydrocarvone (4).
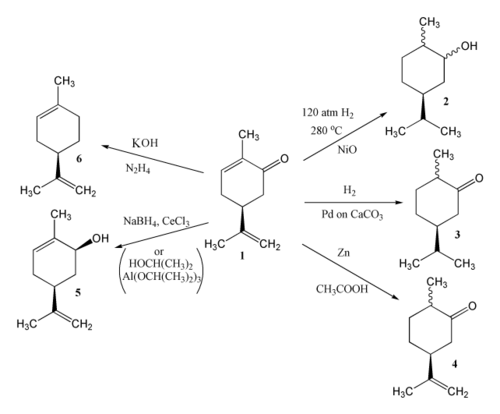
Oxydation
[modifier | modifier le code]L'oxydation de la carvone peut également conduire à différents composés. En présence d'une base comme Ba(OH)2, la carvone est oxydée par l'air ou l'oxygène pour donner la dicétone.

Utilisations
[modifier | modifier le code]- Alimentation : la carvone a été employée depuis des milliers d'années dans l'alimentation, en raison de son arôme de cumin, d'aneth et de menthe verte.
- Agriculture : la carvone L est utilisée aux Pays-Bas pour empêcher la germination précoce des pommes de terre[3]. L'huile essentielle de menthe verte (Mentha spicata), dont le principe actif est la L-Carvone, est employée en agriculture biologique dans le même but[4].
Réglementation
[modifier | modifier le code]Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l'Union européenne : cette substance active est inscrite à l'annexe I de la directive 91/414/CEE par la directive 2008/44/CE ;
- pour la France : cette substance active n'a pas d'autorisation d'emploi à ce jour.
Liens externes
[modifier | modifier le code]- (S)-(+)-Carvone
- (R)-(−)-Carvone
- (de) Acros
- (de) Alfa Aesar
- (de) Carl+Roth
- (de) Merck
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « carvone » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « carvon » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- [1] Antigerminatif de pommes de terre
- « Règlement 889/2008 portant modalités d'application du règlement (CE) no 834/2007 du Conseil relatif à la production biologique et à l'étiquetage des produits biologiques en ce qui concerne la production biologique, l'étiquetage et les contrôles. Annexe II »

