« Macrophage » : différence entre les versions
→Origine des macrophages : Info + sources |
|||
| Ligne 11 : | Ligne 11 : | ||
== Origine des macrophages == |
== Origine des macrophages == |
||
La plupart des macrophages résidents des tissus sont des macrophages embryonnaires. Ils dérivent directement de cellules de la [[vésicule vitelline]] et sont capables d'auto-renouvellement et de maintenance indépendamment des monocytes<ref>{{Article|langue=en|prénom1=Luke C|nom1=Davies|prénom2=Stephen J|nom2=Jenkins|prénom3=Judith E|nom3=Allen|prénom4=Philip R|nom4=Taylor|titre=Tissue-resident macrophages|périodique=Nature Immunology|volume=14|numéro=10|date=2013-10|issn=1529-2908|issn2=1529-2916|pmid=24048120|pmcid=PMC4045180|doi=10.1038/ni.2705|lire en ligne=https://www.nature.com/articles/ni.2705|consulté le=2022-11-02|pages=986–995}}</ref>. Les avancées technologiques récentes ont permis le rejet définitif du système phagocytaire mononucléaire affirmant que les macrophages résidents dérivés des et la reconnaissance des macrophages résidant dans les tissus en tant que populations uniques indépendantes de la différenciation monocytaire <ref>{{Article|langue=en|prénom1=Christian|nom1=Schulz|prénom2=Elisa Gomez|nom2=Perdiguero|prénom3=Laurent|nom3=Chorro|prénom4=Heather|nom4=Szabo-Rogers|titre=A Lineage of Myeloid Cells Independent of Myb and Hematopoietic Stem Cells|périodique=Science|volume=336|numéro=6077|pages=86–90|date=2012-04-06|issn=0036-8075|issn2=1095-9203|doi=10.1126/science.1219179|lire en ligne=https://www.science.org/doi/10.1126/science.1219179|consulté le=2024-02-17}}</ref>{{,}}<ref>{{Article|langue=en|prénom1=Daigo|nom1=Hashimoto|prénom2=Andrew|nom2=Chow|prénom3=Clara|nom3=Noizat|prénom4=Pearline|nom4=Teo|titre=Tissue-Resident Macrophages Self-Maintain Locally throughout Adult Life with Minimal Contribution from Circulating Monocytes|périodique=Immunity|volume=38|numéro=4|pages=792–804|date=2013-04|pmid=23601688|pmcid=PMC3853406|doi=10.1016/j.immuni.2013.04.004|lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S107476131300157X|consulté le=2024-02-17}}</ref>{{,}}<ref>{{Article|langue=en|prénom1=Michael H.|nom1=Sieweke|prénom2=Judith E.|nom2=Allen|titre=Beyond Stem Cells: Self-Renewal of Differentiated Macrophages|périodique=Science|volume=342|numéro=6161|date=2013-11-22|issn=0036-8075|issn2=1095-9203|doi=10.1126/science.1242974|lire en ligne=https://www.science.org/doi/10.1126/science.1242974|consulté le=2024-02-17}}</ref>. |
La plupart des macrophages résidents des tissus sont des macrophages embryonnaires. Ils dérivent directement de cellules de la [[vésicule vitelline]] et sont capables d'auto-renouvellement et de maintenance indépendamment des monocytes<ref>{{Article|langue=en|prénom1=Luke C|nom1=Davies|prénom2=Stephen J|nom2=Jenkins|prénom3=Judith E|nom3=Allen|prénom4=Philip R|nom4=Taylor|titre=Tissue-resident macrophages|périodique=Nature Immunology|volume=14|numéro=10|date=2013-10|issn=1529-2908|issn2=1529-2916|pmid=24048120|pmcid=PMC4045180|doi=10.1038/ni.2705|lire en ligne=https://www.nature.com/articles/ni.2705|consulté le=2022-11-02|pages=986–995}}</ref>. Les avancées technologiques récentes ont permis le rejet définitif du système phagocytaire mononucléaire affirmant que les macrophages résidents dérivés des et la reconnaissance des macrophages résidant dans les tissus en tant que populations uniques indépendantes de la différenciation monocytaire <ref>{{Article|langue=en|prénom1=Christian|nom1=Schulz|prénom2=Elisa Gomez|nom2=Perdiguero|prénom3=Laurent|nom3=Chorro|prénom4=Heather|nom4=Szabo-Rogers|titre=A Lineage of Myeloid Cells Independent of Myb and Hematopoietic Stem Cells|périodique=Science|volume=336|numéro=6077|pages=86–90|date=2012-04-06|issn=0036-8075|issn2=1095-9203|doi=10.1126/science.1219179|lire en ligne=https://www.science.org/doi/10.1126/science.1219179|consulté le=2024-02-17}}</ref>{{,}}<ref>{{Article|langue=en|prénom1=Daigo|nom1=Hashimoto|prénom2=Andrew|nom2=Chow|prénom3=Clara|nom3=Noizat|prénom4=Pearline|nom4=Teo|titre=Tissue-Resident Macrophages Self-Maintain Locally throughout Adult Life with Minimal Contribution from Circulating Monocytes|périodique=Immunity|volume=38|numéro=4|pages=792–804|date=2013-04|pmid=23601688|pmcid=PMC3853406|doi=10.1016/j.immuni.2013.04.004|lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S107476131300157X|consulté le=2024-02-17}}</ref>{{,}}<ref>{{Article|langue=en|prénom1=Michael H.|nom1=Sieweke|prénom2=Judith E.|nom2=Allen|titre=Beyond Stem Cells: Self-Renewal of Differentiated Macrophages|périodique=Science|volume=342|numéro=6161|date=2013-11-22|issn=0036-8075|issn2=1095-9203|doi=10.1126/science.1242974|lire en ligne=https://www.science.org/doi/10.1126/science.1242974|consulté le=2024-02-17}}</ref>. |
||
La première vague, appelée vague primitive, commence au septième jour de la vie embryonnaire 6,5 dans le sac vitellin <ref>{{Article|langue=en|prénom1=Igor M.|nom1=Samokhvalov|titre=Deconvoluting the ontogeny of hematopoietic stem cells|périodique=Cellular and Molecular Life Sciences|volume=71|numéro=6|pages=957–978|date=2014-03|issn=1420-682X|issn2=1420-9071|doi=10.1007/s00018-013-1364-7|lire en ligne=http://link.springer.com/10.1007/s00018-013-1364-7|consulté le=2024-02-17}}</ref>. Cette vague établit une population de progéniteurs exclusifs aux macrophages qui se différencient ensuite en progéniteurs érythroïdes et myéloïdes entre le neuvième et le onzième jour au cours de la vague pro-définitive <ref>{{Article|langue=en|prénom1=Elisa|nom1=Gomez Perdiguero|prénom2=Kay|nom2=Klapproth|prénom3=Christian|nom3=Schulz|prénom4=Katrin|nom4=Busch|titre=Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors|périodique=Nature|volume=518|numéro=7540|pages=547–551|date=2015-02-26|issn=0028-0836|issn2=1476-4687|pmid=25470051|pmcid=PMC5997177|doi=10.1038/nature13989|lire en ligne=https://www.nature.com/articles/nature13989|consulté le=2024-02-17}}</ref>. Une population intermédiaire de pré-macrophages (p-Mac) est dérivée des progéniteurs myéloïdes sans devenir au préalable des monocytes <ref>{{Article|langue=en|prénom1=Elvira|nom1=Mass|prénom2=Ivan|nom2=Ballesteros|prénom3=Matthias|nom3=Farlik|prénom4=Florian|nom4=Halbritter|titre=Specification of tissue-resident macrophages during organogenesis|périodique=Science|volume=353|numéro=6304|date=2016-09-09|issn=0036-8075|issn2=1095-9203|pmid=27492475|pmcid=PMC5066309|doi=10.1126/science.aaf4238|lire en ligne=https://www.science.org/doi/10.1126/science.aaf4238|consulté le=2024-02-17}}</ref>. La population de progéniteurs (érythroïdes et myéloïdes) et de p-Mac se développe pendant plusieurs jours dans le sac vitellin et migre vers le foie fœtal avent le quinzième jour. Entre le treizième et le dix-huitième jour, les p-Mac du foie fœtal migrent et ensemencent d'autres tissus pour établir des populations à vie de macrophages résidant dans les tissus. La troisième vague d'hématopoïèse, la vague définitive, débute vers le dix-huitième jour et implique l'établissement de cellules souches hématopoïétiques dans la moelle osseuse. Bien que tous les macrophages résidant dans les tissus proviennent des p-Mac du foie fœtal, les macrophages dérivés de la moelle osseuse remplacent la population fœtale dans les intestins, la rate, la peau et le cœur <ref>{{Article|prénom1=Yinyu|nom1=Wu|prénom2=Karen K.|nom2=Hirschi|titre=Tissue-Resident Macrophage Development and Function|périodique=Frontiers in Cell and Developmental Biology|volume=8|date=2021-01-08|issn=2296-634X|pmid=33490082|pmcid=PMC7820365|doi=10.3389/fcell.2020.617879|lire en ligne=https://www.frontiersin.org/articles/10.3389/fcell.2020.617879/full|consulté le=2024-02-17}}</ref>. Cependant, il convient de noter que ces populations de macrophages dérivées de cellules souches hématopoïétiques sont maintenues par auto-renouvellement avec une contribution minimale des monocytes en circulation suite à leur colonisation des tissus <ref>{{Article|langue=en|prénom1=Malay|nom1=Haldar|prénom2=Kenneth M.|nom2=Murphy|titre=Origin, development, and homeostasis of tissue‐resident macrophages|périodique=Immunological Reviews|volume=262|numéro=1|pages=25–35|date=2014-11|issn=0105-2896|issn2=1600-065X|pmid=25319325|pmcid=PMC4203404|doi=10.1111/imr.12215|lire en ligne=https://onlinelibrary.wiley.com/doi/10.1111/imr.12215|consulté le=2024-02-17}}</ref>. |
|||
Les macrophages sont attirés vers le lieu d’une [[inflammation]] par [[chimiotactisme]]. Les signaux d’appel sont constitués de différents stimuli, dérivés de cellules endommagées (par [[nécrose]] ou [[apoptose]]), de pathogènes, et de produits libérés par les cellules présentes au site : l’[[histamine]] relarguée par les [[mastocyte]]s et les [[Granulocyte basophile|granulocytes basophiles]], et des [[chimiokine]]s et [[cytokine]]s libérées par des macrophages. |
Les macrophages sont attirés vers le lieu d’une [[inflammation]] par [[chimiotactisme]]. Les signaux d’appel sont constitués de différents stimuli, dérivés de cellules endommagées (par [[nécrose]] ou [[apoptose]]), de pathogènes, et de produits libérés par les cellules présentes au site : l’[[histamine]] relarguée par les [[mastocyte]]s et les [[Granulocyte basophile|granulocytes basophiles]], et des [[chimiokine]]s et [[cytokine]]s libérées par des macrophages. |
||
Version du 17 février 2024 à 18:49
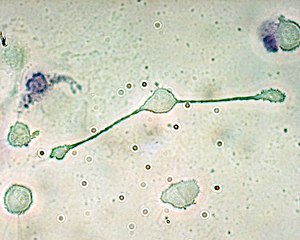
Les macrophages (du grec macro-, gros et -phagein, manger) sont des cellules appartenant aux globules blancs, qui sont définis historiquement par leur capacité de phagocytose. Ce sont des grosses cellules arrondies avec un noyau excentré et des vacuoles dans leur cytoplasme. Ils ont deux origines : certains macrophages ont une origine embryonnaire et résident dans les tissus tout au long de la vie de l'individu, d'autres proviennent de la différenciation de leucocytes sanguins circulants, les monocytes.
Les macrophages sont des phagocytes et sont donc capables de phagocytose. Leur rôle principal est de phagocyter les débris cellulaires et les agents pathogènes. La reconnaissance de motifs microbiens par les récepteurs situés à la surface des macrophages conduit à la phagocytose et à la destruction des agents infectieux, par le processus d'explosion oxydative (oxidative burst en anglais) et la production de radicaux libres de l'oxygène. Les macrophages produisent également des chimiokines, permettant le recrutement d'autres cellules sur le site de l'infection.
Comme les cellules dendritiques, ils sont capables de se comporter comme des cellules présentatrices d'antigène. Ils participent à l’immunité innée en tant que défense non spécifique, mais sont capables de participer à l’immunité adaptative via le phénomène d’opsonisation.
Ils ont été découverts par le biologiste russe Elie Metchnikoff en 1883. Leur nom provient du grec μάκρος / mákros, « grand », et φαγεῖν / phageîn, « manger » = « gros mangeur ».
Origine des macrophages
La plupart des macrophages résidents des tissus sont des macrophages embryonnaires. Ils dérivent directement de cellules de la vésicule vitelline et sont capables d'auto-renouvellement et de maintenance indépendamment des monocytes[1]. Les avancées technologiques récentes ont permis le rejet définitif du système phagocytaire mononucléaire affirmant que les macrophages résidents dérivés des et la reconnaissance des macrophages résidant dans les tissus en tant que populations uniques indépendantes de la différenciation monocytaire [2],[3],[4].
La première vague, appelée vague primitive, commence au septième jour de la vie embryonnaire 6,5 dans le sac vitellin [5]. Cette vague établit une population de progéniteurs exclusifs aux macrophages qui se différencient ensuite en progéniteurs érythroïdes et myéloïdes entre le neuvième et le onzième jour au cours de la vague pro-définitive [6]. Une population intermédiaire de pré-macrophages (p-Mac) est dérivée des progéniteurs myéloïdes sans devenir au préalable des monocytes [7]. La population de progéniteurs (érythroïdes et myéloïdes) et de p-Mac se développe pendant plusieurs jours dans le sac vitellin et migre vers le foie fœtal avent le quinzième jour. Entre le treizième et le dix-huitième jour, les p-Mac du foie fœtal migrent et ensemencent d'autres tissus pour établir des populations à vie de macrophages résidant dans les tissus. La troisième vague d'hématopoïèse, la vague définitive, débute vers le dix-huitième jour et implique l'établissement de cellules souches hématopoïétiques dans la moelle osseuse. Bien que tous les macrophages résidant dans les tissus proviennent des p-Mac du foie fœtal, les macrophages dérivés de la moelle osseuse remplacent la population fœtale dans les intestins, la rate, la peau et le cœur [8]. Cependant, il convient de noter que ces populations de macrophages dérivées de cellules souches hématopoïétiques sont maintenues par auto-renouvellement avec une contribution minimale des monocytes en circulation suite à leur colonisation des tissus [9].
Les macrophages sont attirés vers le lieu d’une inflammation par chimiotactisme. Les signaux d’appel sont constitués de différents stimuli, dérivés de cellules endommagées (par nécrose ou apoptose), de pathogènes, et de produits libérés par les cellules présentes au site : l’histamine relarguée par les mastocytes et les granulocytes basophiles, et des chimiokines et cytokines libérées par des macrophages.
Contrairement aux granulocytes neutrophiles, qui sont les cellules phagocytaires présentes le plus vite au lieu de l’inflammation et qui ne vivent que quelques jours, la durée de vie d’un macrophage va de plusieurs mois à des années. Au cours du temps, on a un remplacement de la plupart des macrophages embryonnaires par des macrophages d'origine monocytaire. Ce remplacement n'est pas observable pour la microglie, une population de macrophage embryonnaire qui peuple le système nerveux central.
Phénotypes
Les macrophages peuvent se définir par les marqueurs membranaires CSF1R et CD64. Ils interagissent grâce à la présence de plusieurs types de récepteurs :
- les récepteurs PAMP et DAMP,
- les récepteurs opsioniques,
- les récepteurs cytokinétiques et chimiokinétique,
- les récepteurs de signalisation,
- les récepteurs d'adhésivité cellulaire et des récepteurs modulant leur activé par un rétrocontrôle négatif.
L'existence de deux catégories de macrophages nommées M1 et M2 a été proposée depuis les années 2000[10]. Les M1 sont impliqués dans la destruction des agents pathogènes. Les M2 sont impliqués dans la réparation et cicatrisation cellulaire. Cette différenciation se fait par une dégradation différente de l'arginine en oxyde nitrique dans le cas de M1 et en ornithine dans le cas de M2[10]. Toutefois, cette distinction ne semble appropriée que dans des modèles in vitro. L'hétérogénéité des populations de macrophages dans les modèles in vivo suggèrent que cette distinction est artificielle et ne traduit pas une réelle dichotomie dans les fonctions des macrophages.
Les macrophages forment une population "plastique" : ils peuvent changer d'un phénotype à l'autre in vivo. On parle de polarisation des macrophages pour désigner le processus par lequel les macrophages exhibent un phénotype spécifique et une réponse fonctionnelle aux stimuli du microenvironnement et aux signaux rencontrés par les macrophages dans des tissus spécifiques[11].
Fonctions

La fonctions des macrophages est spécifiques des tissus considérés : il est délicat de leur attribuer une fonction générale. Si on doit catégoriser les fonctions des macrophages, elles peuvent être considérées comme étant des fonctions immunitaires ou des fonctions homéostatiques.
Fonctions immunitaires
Phagocytose
-
Macrophage phagocytant des conidies.
Un des rôles principaux des macrophages est le nettoyage de corps nécrotiques et de corps apoptotiques, de débris et de poussières dans le cas des poumons. L’élimination des cellules mortes est importante dans le cadre des phases précoces de l’inflammation chronique. Cette élimination est dominée par l’action des granulocytes neutrophiles, qui seront eux-mêmes phagocytés par les macrophages une fois vieillis (voir CD31 pour plus de détails).
L’élimination de la poussière et des tissus nécrotiques est prise en charge à une plus grande échelle (hors inflammation), par des macrophages résidents qui restent à des endroits stratégiques comme les poumons, le foie, les tissus nerveux, les os, la rate et les tissus conjonctifs, et qui digèrent les particules étrangères comme la poussière et les débris, mais aussi les pathogènes, recrutant en cas de besoin des monocytes circulants pour leur différenciation locale en macrophages tissulaires.
Lorsqu’un macrophage ingère un pathogène, la vésicule intracellulaire formée est nommée phagosome. Elle va fusionner avec un lysosome. Les enzymes lysosomiales et les radicaux libres de l’oxygène (notamment l’hypochlorite) vont tuer et digérer l’intrus. Cependant, certains organismes peuvent résister à ce processus et survivre dans le macrophage, comme Mycobacterium tuberculosis ou les Leishmania. Un macrophage peut digérer une centaine de bactéries avant de succomber lui-même à ses propres enzymes de digestion.
Présentation de l'antigène
Après avoir digéré un pathogène, un macrophage peut se comporter en cellule présentatrice d'antigène, c’est-à-dire présenter un antigène de manière à stimuler un lymphocyte T spécifique. La stimulation lymphocytaire par un macrophage est moindre que celle induite par une cellule dendritique, mais les macrophages sont capables de présenter des antigènes associés aux molécules du complexe majeur d'histocompatibilité de classe deux, et donc de stimuler des lymphocytes CD4+.
Une immunisation se traduit également par la production d'anticorps dirigés contre les antigènes immunisants. Ces anticorps vont se lier aux antigènes de surface des pathogènes. Certains isotypes sont opsonisants, c'est-à-dire qu’il existe sur les phagocytes des récepteurs spécifiques des fragments constants des chaînes lourdes des anticorps. (Dans le cas des IgG (immunoglobuline d'isotype G), ce sont les CD16, CD32 et CD64.) Les macrophages possèdent ce type de récepteurs et la liaison d’un complexe immun à ces récepteurs déclenche la phagocytose. Ainsi, un pathogène qui sera invisible aux yeux d’un macrophage deviendra visible une fois opsonisé.
Production et libération de cytokines
Les macrophages sont capables de sécréter un grand nombre de cytokines comme l'interleukine 1 (IL-1), l'interleukine 6 (IL-6), le facteur nécrosant des tumeurs (TNF-α). Ils participent de façon active au recrutement des autres cellules de l'immunité innée.
In vitro, les macrophages M1 activés libèrent des cytokines pro-inflammatoires dont le TNF-α, l'IL-1α, l'IL-1β, l'IL-6, l'IL-12, l'IL-18 et l'IL-23. Ils produisent de l'oxyde nitreux (NO), des espèces réactives de l'oxygènes (ROS) et des espèces réactives de l'azote (RNS). Ils expriment également des récepteurs aux chimiokines (CCR1 et CCR5).
In vitro, les macrophages M2 activés libère plutôt des cytokines de résolution de l'inflammation comme l'IL-10 ou le TGF-β.
Fonctions homéostatiques
Les macrophages jouent un rôle important au niveau de la peau qui est un organe important pour l'immunité[12]. Ils[13] stimulent également les cellules impliquées dans la cicatrisation ou la régénération du derme[14] (et un défaut de cette fonction de réparation peut conduire à des phénomènes inflammatoires et au cancer[15]). Les macrophages peuvent aussi stimuler les cellules souches des follicules pileux qui produisent poils et cheveux[16] via des signaux moléculaires émis par les macrophages et reçus par les cellules souches du follicule pileux au repos (HF-SCs).
Un type particulier de macrophages, les ostéoclastes, sont responsables de l'homéostasie tissulaire dans l'os. Ils jouent un rôle de contrôle de la quantité d'os fabriqué.
Certains macrophages résidents des poumons libèrent le surfactant pulmonaire.
Implication en pathologie humaine
Les macrophages contribuent de façon importante dans la progression de maladies inflammatoires comme le diabète, le cancer, et l'athérosclérose. Parmi leur rôles en pathologie humaine :
- les macrophages associés aux tumeurs qui sont présents dans le micro-environnement tumoral semblent jouer un rôle ambigu dans la progression tumorale et l'immunosuppression ;
- les macrophages sont capables de stocker les lipides anormaux. Ils constituent les plaques d'athérosclérose et portent alors le nom de cellules spumeuses ;
- les macrophages expriment les molécules CD4 et CCR5, ce qui les rend infectables par les souches macrotropes du VIH. En pratique, l'infection au VIH lors d'une contamination sexuelle passe par les macrophages ;
- la formation du granulome inflammatoire dépend des macrophages.
Macrophages résidents
La majorité des macrophages (en situation non inflammatoire) résident à des endroits stratégiques du corps. Ils sont ainsi présents aux endroits les plus susceptibles d’invasion microbienne ou d’accumulation de débris de toutes sortes. Les macrophages résidant dans les tissus de la plupart des organes humains sont établies au cours de l'embryogenèse et maintenues par auto-renouvellement [17]. Les macrophages résidant dans les tissus sont uniques dans leur capacité à réintégrer le cycle cellulaire en tant que cellules entièrement différenciées [18].
Les macrophages sont spécialisés selon leur localisation et portent différents noms :
- Cellule de Langerhans dans la peau
- Histiocytes dans les tissus conjonctifs
- Cellule de Kupffer dans le foie
- Microgliocytes dans le tissu nerveux
- Ostéoclastes dans le tissu osseux
- Macrophage pulpaire dans la rate
- Macrophage pulmonaire dans les poumons qui comprennent plusieurs types.
- LysoMac dans les plaques de Peyer
Notes et références
- (en) Luke C Davies, Stephen J Jenkins, Judith E Allen et Philip R Taylor, « Tissue-resident macrophages », Nature Immunology, vol. 14, no 10, , p. 986–995 (ISSN 1529-2908 et 1529-2916, PMID 24048120, PMCID PMC4045180, DOI 10.1038/ni.2705, lire en ligne, consulté le )
- (en) Christian Schulz, Elisa Gomez Perdiguero, Laurent Chorro et Heather Szabo-Rogers, « A Lineage of Myeloid Cells Independent of Myb and Hematopoietic Stem Cells », Science, vol. 336, no 6077, , p. 86–90 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1219179, lire en ligne, consulté le )
- (en) Daigo Hashimoto, Andrew Chow, Clara Noizat et Pearline Teo, « Tissue-Resident Macrophages Self-Maintain Locally throughout Adult Life with Minimal Contribution from Circulating Monocytes », Immunity, vol. 38, no 4, , p. 792–804 (PMID 23601688, PMCID PMC3853406, DOI 10.1016/j.immuni.2013.04.004, lire en ligne, consulté le )
- (en) Michael H. Sieweke et Judith E. Allen, « Beyond Stem Cells: Self-Renewal of Differentiated Macrophages », Science, vol. 342, no 6161, (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1242974, lire en ligne, consulté le )
- (en) Igor M. Samokhvalov, « Deconvoluting the ontogeny of hematopoietic stem cells », Cellular and Molecular Life Sciences, vol. 71, no 6, , p. 957–978 (ISSN 1420-682X et 1420-9071, DOI 10.1007/s00018-013-1364-7, lire en ligne, consulté le )
- (en) Elisa Gomez Perdiguero, Kay Klapproth, Christian Schulz et Katrin Busch, « Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors », Nature, vol. 518, no 7540, , p. 547–551 (ISSN 0028-0836 et 1476-4687, PMID 25470051, PMCID PMC5997177, DOI 10.1038/nature13989, lire en ligne, consulté le )
- (en) Elvira Mass, Ivan Ballesteros, Matthias Farlik et Florian Halbritter, « Specification of tissue-resident macrophages during organogenesis », Science, vol. 353, no 6304, (ISSN 0036-8075 et 1095-9203, PMID 27492475, PMCID PMC5066309, DOI 10.1126/science.aaf4238, lire en ligne, consulté le )
- Yinyu Wu et Karen K. Hirschi, « Tissue-Resident Macrophage Development and Function », Frontiers in Cell and Developmental Biology, vol. 8, (ISSN 2296-634X, PMID 33490082, PMCID PMC7820365, DOI 10.3389/fcell.2020.617879, lire en ligne, consulté le )
- (en) Malay Haldar et Kenneth M. Murphy, « Origin, development, and homeostasis of tissue‐resident macrophages », Immunological Reviews, vol. 262, no 1, , p. 25–35 (ISSN 0105-2896 et 1600-065X, PMID 25319325, PMCID PMC4203404, DOI 10.1111/imr.12215, lire en ligne, consulté le )
- (en) Charles D. Mills, Kristi Kincaid, Jennifer M. Alt et Michelle J. Heilman, « M-1/M-2 Macrophages and the Th1/Th2 Paradigm », The Journal of Immunology, vol. 164, no 12, , p. 6166–6173 (ISSN 0022-1767 et 1550-6606, PMID 10843666, DOI 10.4049/jimmunol.164.12.6166, lire en ligne, consulté le )
- (en) Abbas Shapouri‐Moghaddam, Saeed Mohammadian, Hossein Vazini et Mahdi Taghadosi, « Macrophage plasticity, polarization, and function in health and disease », Journal of Cellular Physiology, vol. 233, no 9, , p. 6425–6440 (ISSN 0021-9541 et 1097-4652, DOI 10.1002/jcp.26429, lire en ligne, consulté le )
- Di Meglio P, Perera GK, Nestle FO (2011) The multitasking organ: recent insights into skin immune function. Immunity 35: 857–869. doi: 10.1016/j.immuni.2011.12.003.
- Castellana D, Paus R, Perez-Moreno M (2014), Macrophages Contribute to the Cyclic Activation of Adult Hair Follicle Stem Cells ; PLoS Biol 12(12): e1002002. doi:10.1371/journal.pbio.1002002 (article publiée sous licence ouverte CC BY 4.0.
- Gurtner GC, Werner S, Barrandon Y, Longaker MT (2008) Wound repair and regeneration. Nature 453: 314–321. doi: 10.1038/nature07039.
- Coussens LM, Werb Z (2002) Inflammation and cancer. Nature 420: 860–867. doi: 10.1038/nature01322 .
- Gay D, Kwon O, Zhang Z, Spata M, Plikus MV, et al. (2013) Fgf9 from dermal gammadelta T cells induces hair follicle neogenesis after wounding. Nat Med 19: 916–923. doi: 10.1038/nm.3181.
- (en) Athar Aziz, Erinn Soucie, Sandrine Sarrazin et Michael H. Sieweke, « MafB/c-Maf Deficiency Enables Self-Renewal of Differentiated Functional Macrophages », Science, vol. 326, no 5954, , p. 867–871 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1176056, lire en ligne, consulté le )
- (en) Athar Aziz, Erinn Soucie, Sandrine Sarrazin et Michael H. Sieweke, « MafB/c-Maf Deficiency Enables Self-Renewal of Differentiated Functional Macrophages », Science, vol. 326, no 5954, , p. 867–871 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1176056, lire en ligne, consulté le )
