Vanilline
| Vanilline | ||

| ||
 | ||
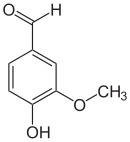  Représentations de la molécule de vanilline. |
||
| Identification | ||
|---|---|---|
| Nom UICPA | 4-hydroxyl-3-méthoxybenzaldéhyde | |
| Synonymes |
• aldéhyde méthylprotocatéchuique |
|
| No CAS | ||
| No ECHA | 100.004.060 | |
| No CE | 204-465-2 | |
| No RTECS | YW5775000 | |
| PubChem | 1183 | |
| FEMA | 3107 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc (généralement en aiguilles) |
|
| Propriétés chimiques | ||
| Formule | C8H8O3 [Isomères] |
|
| Masse molaire[2] | 152,147 3 ± 0,007 9 g/mol C 63,15 %, H 5,3 %, O 31,55 %, |
|
| pKa | 7,40 (25 °C)[1] | |
| Propriétés physiques | ||
| T° fusion | 81,5 °C[3] | |
| T° ébullition | 285 °C[3] | |
| Solubilité | 10 g l−1 dans l'eau (25 °C)[3] Librement sol. dans le chloroforme, l'éther, le CS2, l'acide acétique glacial, la pyridine. |
|
| Masse volumique | 1,056 g cm−3 (solide)[réf. souhaitée] | |
| Point d’éclair | 147 °C[réf. souhaitée] | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| SGH | ||
| H319 et P305+P351+P338 |
||
| Directive 67/548/EEC | ||
| Écotoxicologie | ||
| DL50 | 1 580 mg kg−1 (rat, oral), 3 925 mg kg−1 (souris, oral)[3]. |
|
| Considérations thérapeutiques | ||
| Classe thérapeutique | Antioxydants | |
| Composés apparentés | ||
| Isomère(s) | Salicylate de méthyle, Acide mandélique | |
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
La vanilline est un aldéhyde aromatique naturel qui se développe dans les gousses de vanille lors de la préparation de celles-ci comme épice.
On l'utilise pour faire des arômes naturels.
Origine[modifier | modifier le code]
La vanilline est, parmi les multiples composants de l'arôme naturel de la vanille, le plus important et le plus caractéristique. Elle représente 0,75 % à 2 % de la masse de la gousse[5]. Une gousse pesant autour des trois grammes n'en contient que 22 à 60 mg.
Elle a été extraite pour la première fois à l'état pur par le chimiste Théodore Nicolas Gobley par macération de la vanille dans l'alcool à 85°, suivie d'une extraction à l'éther. La substance brune très odorante qu'il obtient après évaporation est portée à ébullition dans l'eau, puis filtrée à chaud. La vanilline est finalement isolée après plusieurs recristallisations successives sous forme de longues aiguilles incolores[6].
La vanilline a pour la première fois pu être synthétisée en 1874 par Wilhelm Haarmann et Ferdinand Tiemann, à partir de coniférine, un dérivé d'isoeugénol qu'on trouve dans l'écorce de pin[7]. Karl Reimer propose deux ans plus tard, en 1876, une nouvelle voie de synthèse à partir du gaïacol[8].
Propriétés physiques et chimiques[modifier | modifier le code]
La molécule est un aldéhyde aromatique, d'où ses autres appellations de vanillaldéhyde ou aldéhyde vanillique. En solution, en présence de fer et d'un autre composé alcalin, l'aldéhyde développe une couleur rouge et perd son pouvoir odorant[9].
La vanilline a une odeur similaire à la vanille avec un goût sucré[9]. Son intensité aromatique est cependant de deux à quatre fois moins puissante que celle de l'éthylvanilline[10].
Production, synthèse et extraction[modifier | modifier le code]
La vanilline peut être fabriquée à faible coût par divers procédés, alors que la vanille est très chère à produire et à préparer[11]. C'est ainsi que la production industrielle de la vanilline et son utilisation dans l'alimentation et les parfums sont devenues bien plus importantes que la production et l'usage de la vanille naturelle.
À titre indicatif, 1 kg de gousses de vanille entière vaut environ 500 € quand 1 kg de gousses de vanille en poudre vaut environ 40 € et qu'un kilogramme d'arôme artificiel de vanille liquide coûte environ 10 €[12].[réf. nécessaire]
Synthèse à partir du gaïacol[modifier | modifier le code]
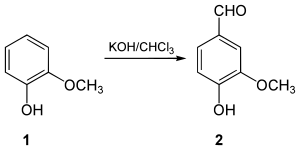
En 1876, Karl Reimer a préparé la vanilline à partir du gaïacol[8]. Après dissolution du gaïacol dans une solution d'hydroxyde de potassium, on fait réagir le tout avec du chloroforme. Cette réaction donne lieu à la formation de vanilline ainsi que d'un isomère, la méthoxyaldéhyde salicylique. Les deux composés ainsi formés sont séparés par distillation à la vapeur d'eau sous pression de 2 atmosphères[réf. nécessaire].
Synthèse à partir du 4-hydroxybenzaldéhyde[modifier | modifier le code]
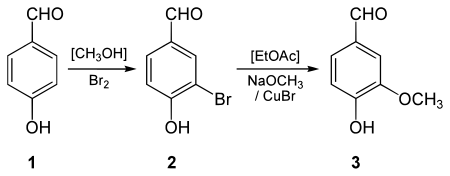
La vanilline peut être synthétisée à partir de la 4-hydroxybenzaldéhyde. Cette préparation s'effectue en deux étapes impliquant une substitution électrophile aromatique pour incorporer un atome brome sur le cycle aromatique suivi d'une méthoxylation organométallique à l'aide d'un catalyseur de cuivre[13].
Synthèse à partir de l'eugénol[modifier | modifier le code]
L'eugénol est extrait du clou de girofle.
L'eugénol (1) est transformé en isoeugénol (2), puis en acétate d'isoeugénol, puis en acétate de vanilline, puis en vanilline[réf. nécessaire][14],[15].
Synthèse à partir de la lignine[modifier | modifier le code]
On utilise la lignine récupérée des eaux résiduaires de l'industrie de la pâte à papier. Cette voie de synthèse oxyde les acides lignosulfoniques à l'aide de l'oxydation par voie humide[16].
Synthèse à partir de la curcumine[modifier | modifier le code]
La curcumine est extraite du curcuma.
Biogénèse à partir des résidus sucriers de la betterave, de l'industrie du maïs ou du riz[modifier | modifier le code]
Un processus de décomposition de l'acide férulique[17] de résidus industriels de maïs[18] ou de betterave sucrière (par un champignon) permet d'aboutir à un arôme riche en vanilline[19],[20]. Le procédé étant biochimique, l'arôme peut être considéré comme arôme naturel et étiqueté comme tel dans la composition de préparations alimentaires. Solvay a développé un procédé de conversion de bioconversion de l'acide férulique, provenant de son de riz, en vanilline, commercialisé sous le nom de « Rhovanil Natural CW »[21].
Extraction à partir de matières fécales de bétail[modifier | modifier le code]
En 2006, une scientifique japonaise, Mayu Yamamoto, isole de la vanilline à partir de bouse de vache[22] ; l'année suivante elle reçoit le prix Ig Nobel pour cette découverte[23].
Recherche et développement[modifier | modifier le code]
Une méthode nouvelle[24], présentée en 2017 par des universitaires indiens comme étant plus respectueuse de l'environnement, utilise — à pression atmosphérique — un catalyseur composé d'éléments non rares (silice et cuivre) pour efficacement isoler la vanilline en la séparant des autres composés dans de l'eau bouillante[24].
Ce catalyseur peut être recyclé quatre fois sans perdre de son efficacité alors que les catalyseurs traditionnels devaient être remplacés après une utilisation[24].
De plus cette méthode ne produit plus d'eaux résiduelles à pH extrêmement élevé (qui nécessitaient une neutralisation à l'acide chlorhydrique avant rejet dans l'environnement[25]).
Différences avec la vanille[modifier | modifier le code]
La vanilline extraite de la gousse de vanille est exactement la même que celle fabriquée industriellement.
La différence de qualité provient de la complexité et de la richesse de l'arôme naturel de vanille qui contient de nombreux autres composants, alors que la vanilline obtenue par synthèse est chimiquement pure. Les procédés de biogénèse aboutissent en revanche à la formation d'un arôme complexe, et non à un produit chimiquement pur[réf. nécessaire].
Production mondiale[modifier | modifier le code]
La vanilline est l'arôme le plus fabriqué dans le monde, devançant de loin les arômes chocolat et café ; la production d'arômes de vanille est estimée à 25 000 t/an[26].
Utilisation[modifier | modifier le code]
- La vanilline est utilisée pour ses propriétés aromatisantes, soit seule soit en tant que constituant d'un arôme. Il ne faut pas en abuser dans l'arôme car elle possède un goût amer à haute dose. La vanilline (numéro Fema GRAS 3107[9]) est utilisée dans la création d'arôme vanille, chocolat et banane.
- C'est un produit intermédiaire pour la production de plusieurs dérivés à usage pharmaceutique.
- Ses propriétés chimiques la font parfois utiliser dans certaines réactions en chimie analytique, notamment sous la forme de sulfovanilline.
- On lui attribue également des vertus aphrodisiaques.[réf. nécessaire]
- La vanilline sulfurique (mélange dans l'acide sulfurique concentré) est utilisée pour doser les terpènes par colorimétrie
- La vanilline est aussi utilisée en tant qu'additif dans des liquides de cigarettes électroniques.
Notes et références[modifier | modifier le code]
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Vanillin USAN - RN: 121-33-5 », sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub., , 396 p. (ISBN 0-88415-859-4).
- (en) W. G. Ungerer, Drug and Chemical Markets, vol. 9, Drug & Chemical Markets, (lire en ligne), p. 1127-1128.
- Théodore N. Gobley, Journal de pharmacie et de chimie : contenant les travaux de la Société de Pharmacie de Paris : une revue médicale, vol. 34, Doin, (lire en ligne), p. 401-405.
- (de) F. Tiemann et W. Haarmann, « Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille », Berichte der deutschen chemischen Gesellschaft, vol. 7, no 1, , p. 608-623 (DOI 10.1002/cber.187400701193).
- (de) K. Reimer, « Ueber eine neue Bildungsweise aromatischer Aldehyde », Berichte der deutschen chemischen Gesellschaft, vol. 9, no 1, , p. 423-424 (DOI 10.1002/cber.187600901134).
- (en) G.A. Burdock (2005), Fenaroli's Handbook Of Flavor Ingredients, 5e éd., CRC Press (ISBN 0849330343) p. 1880-1881.
- (en) G.A. Burdock (2005), Fenaroli's Handbook Of Flavor Ingredients, 5e éd., CRC Press (ISBN 0849330343) p. 639-640.
- Eric Jennings, « La vanille à la conquête du monde », L'Histoire, no 494, .
- Catherine Nivez, « Pourquoi le prix de la vanille a flambé », sur bilan.ch, 8 juillet 2018.
- Douglass F. Taber, Shweta Patel, Travis M. Hambleton et Emma E. Winkel, Vanillin Synthesis from 4-Hydroxybenzaldehyde, J. Chem. Ed., 2007, 84 (7), p. 1158, DOI 10.1021/ed084p1158.
- Memmou Faiza, « Synthèse, études cinétiques et évaluation de l'activité de dérivés de l'eugénol. Composition de l'huile essentielle extraite du clou de girofle », sur Dépôt institutionnel de l'Université Abou Bekr Belkaid Tlemcen UABT, (consulté le ).
- Gary M. Lampman, Jennifer Andrews, Wayne Bratz et Otto Hanssen, « Preparation of vanillin from eugenol and sawdust », Journal of Chemical Education, vol. 54, no 12, , p. 776 (ISSN 0021-9584 et 1938-1328, DOI 10.1021/ed054p776, lire en ligne, consulté le ).
- (en) C. Maugans et C. Ellis, « Wet Air Oxidation: A Review of Commercial Sub-Critical Hydrothermal Treatment », Twenty First Annual International Conference on Incineration and Thermal Treatment Technologies, (lire en ligne).
- Asther, M., Lesage-Meessen, L., Stentelaire, C. et Thibault, J. F. (1998), Des champignons à la vanille, Biofutur, 1998(178), 32-34.
- Oddou J. (2000), Conception et extrapolation d'un procédé microbien de production de vanilline naturelle à partir de sous-produits de l'industrie agro-alimentaire (Doctoral dissertation).
- Stentelaire, C. (1999), Contrôle des voies métaboliques fongiques impliquées dans la biotransformation de la fraction féruloylée de coproduits agricoles en vanilline naturelle (Doctoral dissertation).
- Micard, V., Renard, C. M. G. C., Thibault, J. F. et Lesage-Meesen, L. (1995), Est-il possible d'obtenir de la vanilline naturelle à partir de pulpes de betterave ?, Colloque Inra, 149-149.
- Françoise de Vaugelas, « Vanilline : Solvay double sa production », sur Formule Verte, (consulté le ).
- « De la bouse de vache cuite qui sent la vanille », sur dhnet.be, (consulté le ).
- « Arme chimique aphrodisiaque et bol de soupe sans fond récompensés », sur sciencesetavenir.fr, (consulté le ).
- Shivaji L. Bhanawase et Ganapati D. Yadav (2017), Novel Silica-Encapsulated Cu–Al Hydrotalcite Catalyst: Oxidative Decarboxylation of Vanillyl Mandelic Acid to Vanillin in Water at Atmospheric Pressure, Ind. Eng. Chem. Res., article ASAP, DOI 10.1021/acs.iecr.6b04982 (résumé).
- Katherine Kornei, A greener way of making vanilla, 17 mars 2017 (News de la revue Science).
- « Vanille et Vanilline », sur societechimiquedefrance.fr.
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Electronic Plant Information Centre at Royal Botanic Gardens, Kew 2003-11-8
- (en) La cristallisation de la vanilline
- (en) Compound Display 1183, NCBI database
- (en) COMPOUND: C00755, sur genome.jp