Menthol
| Menthol | |
  |
|
| Structure du menthol | |
| Identification | |
|---|---|
| Nom UICPA | (1R,2S,5R)-5-méthyl-2-(propan-2-yl)cyclohexanol |
| Synonymes |
5-méthyl-2-(1-méthyléthyl)-cyclohexan-1-ol |
| No CAS | , racémique , (−)-isomère , (+)-isomère |
| No ECHA | 100.016.992 |
| No CE | 201-939-0, racémique 218-690-9, (−)-isomère |
| PubChem | |
| FEMA | 2665 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin blanc ou incolore |
| Propriétés chimiques | |
| Formule | C10H20O [Isomères] |
| Masse molaire[1] | 156,265 2 ± 0,009 7 g/mol C 76,86 %, H 12,9 %, O 10,24 %, |
| Propriétés physiques | |
| T° fusion | 36 à 38 °C, racémique 42 à 45 °C, (−)-forme (α) 31 à 35 °C, (−)-isomère[réf. souhaitée] |
| T° ébullition | 212 °C[réf. souhaitée] |
| Solubilité | légèrement soluble dans l'eau |
| Masse volumique | 0,903 g cm−3 (L, 15 °C)[2] |
| Point d’éclair | 93 °C[réf. souhaitée] |
| Point critique | 694,0 K[3] |
| Précautions | |
| SGH[4] | |
| H315, P264, P280, P302, P313, P352 et P362 |
|
| SIMDUT[5] | |
 D2B, |
|
| Écotoxicologie | |
| DL50 | 3 300 mg.kg-1 (rat, oral)
15 800 mg.kg-1 (lapin, peau)[réf. souhaitée] |
| Composés apparentés | |
| Isomère(s) | Citronellol, Dihydrolinalol |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le menthol est un composé organique covalent obtenu soit par synthèse, soit par extraction à partir de l'huile essentielle de menthe poivrée ou d'autres huiles essentielles de menthe. Le stéréoisomère le plus courant du menthol est le (–)-menthol, de configuration (1R,2S,5R). Il appartient à la famille des monoterpénols. À température ambiante (20 à 25 °C), il se trouve sous forme de cristaux, d'une couleur blanc cireux. Il fond si l'on augmente légèrement la température. Le menthol a des propriétés anti-inflammatoires[6],[7] et antivirales[8]. Il est d'ailleurs utilisé pour soulager les irritations mineures de la gorge. C'est également un anesthésique local.
Histoire[modifier | modifier le code]
Le menthol a été isolé pour la première fois en 1771 par Gaubius. Le (–)-menthol (aussi appelé L-menthol ou (1R,2S,5R)-menthol) se trouve naturellement dans l'huile essentielle de menthe poivrée (Mentha × piperita)[9]. Le menthol japonais contient également un léger pourcentage de (+)-néomenthol[10].
Structure[modifier | modifier le code]
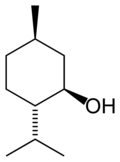
Le menthol existe à l'état natif sous la forme d'un seul énantiomère : (1R,2S,5R), en bas à gauche du schéma.
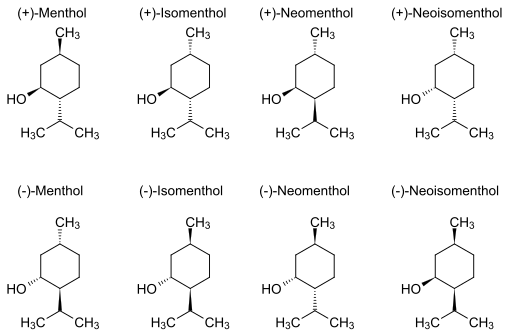
Dans les composés naturels, le groupe isopropyle est orienté trans par rapport aux deux groupes, méthyle et alcool, en position cis. Ainsi il peut être dessiné de l'une ou l'autre des façons ci-dessous :
Dans l'état fondamental, chacun des trois substituants est en position équatoriale, faisant du (–)-menthol et de son énantiomère (1S,2R,5S) les isomères les plus stables. Il existe deux formes cristallines pour le menthol racémique. L'une a des points de fusion de 28 °C et l'autre de 38 °C. Pur, le menthol a quatre formes solides, dont la plus stable est la forme α.
Applications[modifier | modifier le code]


Le menthol est inclus dans nombre de produits différents pour plusieurs raisons comme :
- soulagement à court terme de la gorge endolorie et de l'irritation mineure de la bouche ou de la gorge (bains de bouche par exemple) ;
- antipruritique, pour réduire les démangeaisons ;
- anesthésique local pour soulager des maux et douleurs mineures telles que des crampes musculaires, entorses, migraines. Il peut être utilisé seul ou combiné à du piment ou du camphre. En Europe, il est plutôt utilisé en gel ou en crème ;
- décongestionnant pour les voies respiratoires et les sinus ;
- pesticide contre les acariens (acaricide) ;
- dans certains médicaments traitant les brûlures mineures, il produit une sensation de froid (souvent utilisés en application locale, en association avec l'aloès) ;
- additif dans certaines cigarettes, comme saveur, pour réduire l'âcreté, favoriser l'inhalation profonde de la fumée et augmenter l'addiction[11] ;
- additif dans certaines saveurs de liquides pour cigarettes électroniques ;
- comme désinfectant pour l'hygiène orale, ou remède contre la mauvaise haleine, comme collutoire, dans les pâtes dentifrices, et plus généralement comme agent de saveur pour les chewing-gums et les sucreries ;
- dans les sodas ou mélangé avec de l'eau pour obtenir une boisson à très faible teneur en alcool
- en versant quelques gouttes d'alcool de menthe sur un morceau de sucre pour soulager la nausée ;
- pour préparer des esters mentholés afin d'agrémenter des notes florales en parfumerie ;
- en patchs pour faire tomber la fièvre ou obtenir une sensation de froid (très développé au Japon) ;
- additif à certains produits de beauté (produits coiffants par exemple).
Le menthol a une toxicité relativement basse : DL50 de 3 300 mg·kg-1 pour le rat, oral ; DL50 de 15 800 mg kg−1 pour le lapin, peau.
En chimie organique, le menthol est utilisé comme auxiliaire chiral dans la synthèse de centres asymétriques.
Synthèse[modifier | modifier le code]
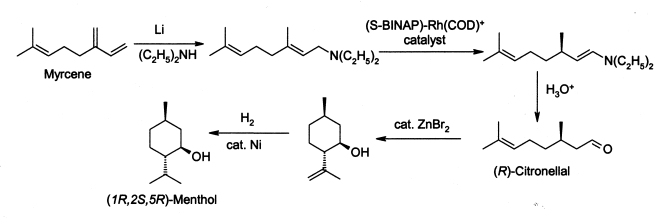
Comme beaucoup de produits naturels employés couramment, la demande de menthol excède considérablement l'approvisionnement des sources naturelles. Le menthol est fabriqué comme énantiomère simple par Takasago International Cie sur une échelle de 400 tonnes par an. Le processus implique une synthèse énantiosélective développée par une équipe menée par Ryōji Noyori, prix Nobel de chimie en 2001 :
Le processus commence en formant une amine allylique du myrcène, qui subit l'isomérisation asymétrique en présence d'un complexe de rhodium de BINAP pour donner (après hydrolyse) le R-citronellal énantiomériquement pur. Le résultat est traité au bromure de zinc pour obtenir l'isopulégol qui est alors hydrogéné pour donner du (1R, 2S, 5R)-menthol pur. Le menthol racémique peut être préparé simplement par l'hydrogénation du thymol, et le menthol est également constitué par l'hydrogénation de la pulégone.
Propriétés chimiques[modifier | modifier le code]
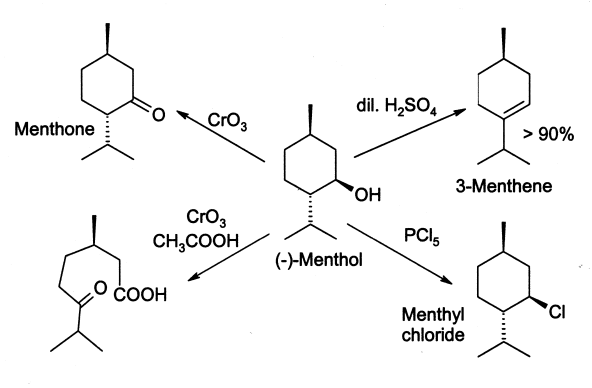
Le menthol réagit souvent de la même façon qu'un alcool secondaire normal. Il est oxydé en menthone en réduisant des agents tels que l'acide chromique, bien que dans certaines conditions, l'oxydation puisse aller plus loin et casser le cycle. Le menthol est facilement déshydraté pour donner principalement le 3-menthène, par l'action de 2 % d'acide sulfurique. Le traitement au pentachlorure de phosphore (PCl5) donne du chlorure de menthyle.
Propriétés biologiques[modifier | modifier le code]
La capacité du menthol de déclencher chimiquement les récepteurs sensibles au froid dans la peau est responsable de la sensation de refroidissement bien connue qu'elle provoque une fois absorbée. Dans ce sens, elle est semblable à la capsaïcine, l'espèce chimique responsable de la sensation épicée des piments.
Des chercheurs du Centre médical de l'université de Georgetown aux États-Unis ont montré que le menthol, utilisé dans certaines cigarettes comme additif, désensibilise les récepteurs nicotiniques, permettant aux fumeurs de ne pas être irrités par la fumée et donc d'inhaler plus en profondeur[12].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. G. Speight et Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.289
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- http://www.dcfinechemicals.com/files2/Hojas%20de%20seguridad%20(FR)/108260-SDS-FR.pdf (24 avril 2019)
- « Menthol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Songqi Liu, Wenjin Guo, Yuxi Jia et Bojian Ye, « Menthol Targeting AMPK Alleviates the Inflammatory Response of Bovine Mammary Epithelial Cells and Restores the Synthesis of Milk Fat and Milk Protein », Frontiers in Immunology, vol. 12, , p. 782989 (ISSN 1664-3224, PMID 35003099, PMCID 8727745, DOI 10.3389/fimmu.2021.782989, lire en ligne, consulté le )
- Ariane Leite Rozza, Fernando Pereira Beserra, Ana Júlia Vieira et Eduardo Oliveira de Souza, « The Use of Menthol in Skin Wound Healing-Anti-Inflammatory Potential, Antioxidant Defense System Stimulation and Increased Epithelialization », Pharmaceutics, vol. 13, no 11, , p. 1902 (ISSN 1999-4923, PMID 34834317, PMCID 8620938, DOI 10.3390/pharmaceutics13111902, lire en ligne, consulté le )
- David J. R. Taylor, Syed M. Hamid, Allen M. Andres et Hannaneh Saadaeijahromi, « Antiviral Effects of Menthol on Coxsackievirus B », Viruses, vol. 12, no 4, , p. 373 (ISSN 1999-4915, PMID 32231022, PMCID 7232514, DOI 10.3390/v12040373, lire en ligne, consulté le )
- Hui Zhao, Shan Ren, Han Yang et Shun Tang, « Peppermint essential oil: its phytochemistry, biological activity, pharmacological effect and application », Biomedicine & Pharmacotherapy = Biomedecine & Pharmacotherapie, vol. 154, , p. 113559 (ISSN 1950-6007, PMID 35994817, DOI 10.1016/j.biopha.2022.113559, lire en ligne, consulté le )
- « (+)-Neomenthol | C10H20O | ChemSpider », sur www.chemspider.com (consulté le )
- « Tabac : pourquoi l'Europe bannit le menthol », sur Sciences et Avenir (consulté le ).
- Les cigarettes au menthol, plus néfastes pour la santé
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) Colacot T. J., 2001 Nobel Prize in Chemistry, Platinum Metals Review, 2002, 46(2), 82-83.
- (en) Ryoji Noyori Nobel lecture, 2001.
- (en) Menthol Information.
- (en) Cooler than Menthol.
Bibliographie[modifier | modifier le code]
- E. E. Turner et M. M. Harris, Organic Chemistry, Longmans, Green & Co., Londres, 1952.
- Handbook of Chemistry and Physics, 71e éd., CRC Press, Ann Arbor, Michigan, 1990.
- (en) Maryadele J. O'Neil, Patricia E. Heckelman, Cherie B. Koch et al., The Merck index : an encyclopedia of chemicals, drugs, and biologicals, Whitehouse Station, N.J., Merck Research Laboratories, , 14e éd., 10973 p. (ISBN 978-0-911910-00-1, OCLC 708295355).