Iodure de cuivre(I)
| Iodure de cuivre(I) | ||

| ||
 | ||
| Structure du γ-CuI __ Cu+ __ I− |
||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.028.795 | |
| PubChem | 24350 | |
| SMILES | ||
| InChI | ||
| Apparence | solide gris inodore[1] | |
| Propriétés chimiques | ||
| Formule | CuI | |
| Masse molaire[2] | 190,45 ± 0,003 g/mol Cu 33,37 %, I 66,63 %, |
|
| Propriétés physiques | ||
| T° fusion | 588 °C[1] | |
| T° ébullition | 1 290 °C[1] | |
| Solubilité | pratiquement insoluble dans l'eau[1] | |
| Masse volumique | 5,62 g·cm-3 (20 °C)[1] | |
| Pression de vapeur saturante | 13 hPa (656 °C)[3] | |
| Précautions | ||
| SGH[1] | ||
| H302, H315, H317, H318, H335, H410, P280, P301+P312+P330 et P305+P351+P338 |
||
| Transport[1] | ||
| Composés apparentés | ||
| Autres anions | Fluorure de cuivre(I) Chlorure de cuivre(I) Bromure de cuivre(I) |
|
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'iodure de cuivre(I), aussi appelé iodure cuivreux, est un composé inorganique, le plus bas iodure du cuivre, de formule CuI.
Il est utile dans une large gamme d'applications allant de la synthèse organique à l'ensemencement des nuages.
Propriétés[modifier | modifier le code]
À l'état pur, il se présente sous la forme d'un poudre incolore[4], mais il est plus couramment d'une couleur grisâtre. Il existe aussi sous la forme d'un minerai naturel rare, la marshite, et présente dans ce cas une teinte brun rougeâtre qui est due à la présence d'impuretés. Il est courant que de échantillons contenant de l'iode se décolorent en raison de l'oxydation aérobie facile de l'anion iodure en diiode[4].
Avec une solubilité de (0,000 42 g/L à 25 °C)[4], l'iodure de cuivre est pratiquement insoluble dans l'eau, mais il se dissout en présence de NaI ou KI pour donner l'anion linéaire [CuI2]−. La dilution de telles solutions avec de l'eau reprécipite CuI. Ce procédé de dissolution–précipitation est utilisé pour purifier CuI, et permet d'obtenir des échantillons incolores[4].
Dissout dans l'acétonitrile, il produit une solution de divers complexes. Lors de la cristallisation, des composés moléculaires[5] ou polymériques[6],[7] peuvent être isolés. Il est également possible de dissoudre CuI dans l'acétone ou le chloroforme en utilisant le bon agent complexant, par exemple du thiocarbamide ou ses dérivés. Les composés qui cristallisent à partir de ce genre de solutions sont des chaînes inorganiques hybrides[8].
En raison de la configuration des électrons d10, les composés de cuivre(I) sont diamagnétiques. L'iodure de cuivre est beaucoup moins sensible à la lumière que le bromure ou le chlorure de cuivre(I), mais il libère néanmoins de petites quantités d'iode lorsqu'il est exposé à la lumière dans l'air ambiant avec une légère décomposition.
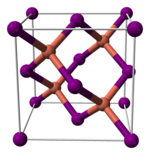
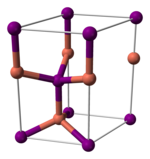
Structure[modifier | modifier le code]
L'iodure de cuivre(I), comme la plupart des halogénures de métal binaires, est un polymère inorganique. Il a un diagramme de phase riche, et existe sous la forme de plusieurs formes cristallins. Il adopte la structure de la blende en dessous de 390 °C (γ-CuI), celle de la wurtzite entre 390 et 440 °C (β-CuI), et celle du sel (chlorure de sodium) au dessus de 440 °C (α-CuI). Les ions adoptent une configuration tétraédrique dans les structures blende ou wurtzite, avec une distance Cu-I de 2,338 Å.
La même transition blende-wurtzite se produit pour le bromure de cuivre(I) et le chlorure de cuivre(I), respectivement à 405 °C et 435 °C. Sachant que les distances interatomiques cuivre-brome et cuivre-chlore sont respectivement de 2,173 Å et 2,051 Å Å[9], on peut noter une relation inverse entre la longueur de liaison cuivre-halogène et la hauteur de la température de transition entre les deux structures.
 |
 |

|
| γ-CuI | β-CuI | α-CuI |
Synthèse[modifier | modifier le code]
L'iodure de cuivre(I) peut être préparé en laboratoire en dissolvant du cuivre dans de l'acide iodhydrique concentré, en faisant réagir du cyanure de cuivre(I) avec de l'iodure d'hydrogène. Une autre méthode commune est de mélanger un sel de cuivre(II), généralement une solution de sulfate de cuivre) et une solution d'iodure de sodium ou d'iodure de potassium.
Une dernière variante est le titrage d'une solution de sulfate de cuivre(II) avec une solution stœchiométrique d'iodure de potassium et de thiosulfate de sodium, afin d'obtenir un produit aussi propre que possible[4] :
L'iodure de cuivre(II) formé de façon intermédiaire est instable et se décompose presque instantanément en iodure de cuivre(I) et en diiode.
- 2 CuI2 ⟶ 2 CuI + I2.
Cette dégradation constitue la base du dosage des composés de cuivre(II) par iodométrie, l'iode ainsi formé étant quantifié par un titrage rédox. Cependant, dans le cadre de la synthèse de CuI, cet excès d'iode a tendance à contaminer le produit obtenu et à former des complexes d'iodure de cuivre solubles ; on l'élimine donc de la réaction par le thiosulfate, qui donne le tétrathionate :
- 2 Na2S2O3 + I2 ⟶ Na2S4O6 + 2 NaI.
L'équation globale de la réaction est donc :
Dans l'industrie, l'iodure de cuivre(I) est obtenu en faisant passer des vapeur de diiode sur du cuivre métallique :
Utilisations[modifier | modifier le code]
L'iodure de cuivre(I) est utilisé dans de nombreux domaines pour des applications variées, et plus particulièrement en synthèse organique
En combinaison avec des ligands 1,2- ou 1,3-diamine, CuI catalyse la conversion de bromures d'aryle, d'hétéroaryle ou de vinyle en iodures correspondants, l'iodure de sodium servant de source en iodure et le dioxane de solvant (voir la réaction de Finkelstein)[10]. Les halogénures d'aryle sont utilisés pour former des liaisons carbone-carbone et carbone-hétéroatome via des procédés tels que la réaction de Heck, la réaction de Stille, la réaction de Suzuki, le couplage de Sonogashira ou la réaction d'Ullmann. Les iodures d'aryle sont à ce propos bien plus réactifs que leurs homologues bromures ou chlorures. L'ioure de cuivre(I) peut aussi être utilisé pour catalyser des réactions de couplage des alcynes vec de halogénoalcane. On peut citer comme exemple la réaction entre le 2-bromo-1-octèn-3-ol avec le non-1-yne catalysé par le dichlorobis(triphénylphosphine)palladium(II), la diéthylamine et CuI et pour former le 7-méthylène-8-hexadécyn-6-ol[11].
Le CuI est utilisé dans la production d'agrégats de Cu(I)[12]. Il est également utilisé dans la détection du mercure. Au contact de vapeurs de mercure, le composé initialement blanc prend une teinte brune du fait de la formation de tétraiodomercurate de cuivre.
Le CuI peut servir de source d'iode alimentaire dans le sel de table et la nourriture animale[13]. Enfin, CuI est utilisé dans l'ensemencement des nuages[13], c'est-à-dire modifier la quantité ou le type de précipitation d'un nuage, voire leur structure en dispersant des substances dans l'atmosphère qui augmentent la capacité de l'eau à former des gouttelettes ou des cristaux. Le CuI fournit une sphère autour de laquelle l'humidité contenue dans le nuage se condense, ce qui entraîne une augmentation des précipitations et une diminution de la densité du nuage.
Notes et références[modifier | modifier le code]
- Entrée « Copper(I) iodide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 septembre 2020 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Copper(I) iodide, consultée le 7 septembre 2020.
- Kauffman GB, Fang LY, Purification of Copper(I) Iodide, vol. 22, coll. « Inorganic Syntheses », , 101–103 p. (ISBN 978-0-470-13253-1, DOI 10.1002/9780470132531.ch20)
- Barth ER, Golz C, Knorr M, Strohmann C, « Crystal structure of di-μ-iodido-bis-[bis(aceto-nitrile-κN)copper(I)] », Acta Crystallographica Section E, vol. 71, no Pt 11, , m189-90 (PMID 26594527, PMCID 4645014, DOI 10.1107/S2056989015018149)
- (en) Healy PC, Kildea JD, Skelton BW, White AH, « Lewis-Base Adducts of Group 11 Metal(I) Compounds. XL. Conformational Systematics of [(N-base)1(CuX)1]∞ Orthogonal' Stair' Polymers (N-base = 'One-Dimensional Aceto-nitrile, Benzo-nitrile Ligand) », Australian Journal of Chemistry, vol. 42, no 1, , p. 79 (ISSN 0004-9425, DOI 10.1071/CH9890079)
- (en) Arkhireeva TM, Bulychev BM, Sizov AI, Sokolova TA, Belsky VK, Soloveichik GL, « Copper(I) complexes with metal-metal (d10–d10) bond. Crystal and molecular structures of adducts of tantalocene trihydride with copper(I) iodide of composition: (η5-C5H5)2TaH[(μ2-H)Cu(μ2-I)2Cu(μ2-H)]2HTa(η5-C5H5)2, (η5-C5H4But)2TaH(μ2-H)2Cu(μ2-I)2Cu(μ2-H)2HTa(η5-C5H4But)2·CH3CN and {Cu(μ3-I)·P[N(CH3)2]3}4 », Inorganica Chimica Acta, vol. 169, no 1, , p. 109–118 (DOI 10.1016/S0020-1693(00)82043-5)
- Rosiak D, Okuniewski A, Chojnacki J, « Copper(I) iodide ribbons coordinated with thiourea derivatives », Acta Crystallographica Section C, vol. 74, no Pt 12, , p. 1650–1655 (PMID 30516149, DOI 10.1107/S2053229618015620)
- Wells AF, Structural Inorganic Chemistry, Oxford, Oxford University Press, , 5th éd., 410 and 444
- Klapars A, Buchwald SL, « Copper-catalyzed halogen exchange in aryl halides: an aromatic Finkelstein reaction », Journal of the American Chemical Society, vol. 124, no 50, , p. 14844–5 (PMID 12475315, DOI 10.1021/ja028865v)
- Marshall JA, Sehon CA, Isomerization of Β-Alkynyl Allylic Alcohols to Furans Catalyzed by Silver Nitrate on Silica Gel: 2-Pentyl-3-methyl-5-heptylfuran, Org. Synth. 76, coll. « vol. », 263 p.
- Muxin Yu, Lian Chen, Feilong Jiang, Kang Zhou, Caiping Liu, Cai Sun, Xingjun Li, Yan Yang et Maochun Hong, « Cation-Induced Strategy toward an Hourglass-Shaped Cu6I7– Cluster and its Color-Tunable Luminescence », Chemistry of Materials, vol. 29, no 19, , p. 8093–8099 (DOI 10.1021/acs.chemmater.7b01790)
- Zhang J, Richardson HW, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, , 1–31 p. (DOI 10.1002/14356007.a07_567), « Copper compounds »
- (en) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Copper(I) iodide » (voir la liste des auteurs) et « Kupfer(I)-iodid » (voir la liste des auteurs).




