Structure blende

La structure blende (en anglais zincblende (ou zinc-blende) structure) est une structure cristalline dérivée de la structure cubique à faces centrées (CFC), composée de deux espèces atomiques différentes. La structure est similaire à la structure diamant et à la structure fluorine. La structure blende est la structure cristalline de la majorité des semi-conducteurs III-V, fondamentalement importants à l'industrie de l'opto-électronique. Ces semi-conducteurs cristallisent aussi souvent dans la structure wurtzite.
Description[modifier | modifier le code]
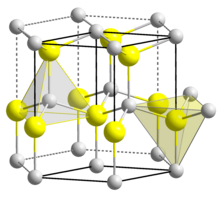
Le groupe d'espace de cette structure est appelée F43m (dans la notation Hermann–Mauguin), ou 216[1]. La designation Strukturbericht est B3[2]. Cette structure peut être décrite de différentes façons, similairement à la structure diamant, notamment :
- soit comme deux sous-réseaux de type CFC enchevêtrés, l'un formé uniquement un atome A et l'autre uniquement avec l'atome X, décalés d'un vecteur (1/4 ; 1/4 ; 1/4)·a, où a est le paramètre de maille. En d'autres termes, un cristal dont le système cristallin est CFC, mais dont le motif est composé de deux atomes différents séparés par un vecteur (1/4 ; 1/4 ; 1/4)·a.
- soit comme un cristal CFC formé de l'atome A dont quatre des huit sites interstitiels tétraédriques sont occupés par des atomes X, deux dans la moitié basse du cube, suivant une petite diagonale, et deux dans la moitié haute, suivant l'autre petite diagonale. Un site tétraédrique d'une maille CFC est le centre du plus petit tétraèdre formé par quatre atomes de la même espèce, par exemple par un atome au coin du cube et les trois atomes au centre de chacune des faces se rejoignant dans ce même coin.
Nombre d'atomes par maille[modifier | modifier le code]

La structure cristalline blende comporte 4 atomes de chaque type dans la maille, soit le double d'une structure CFC compacte. Ceci peut être visualisé de plusieurs manières.
- En considérant que la structure est formée de deux structures monoatomiques CFC et qu'il y a 4 nœuds dans chaque maille.
- En considérant que la structure est cubique faces centrées avec 2 atomes par motif cristallin à chacun des quatre noeuds.
- En considérant que la structure est cubique faces centrées avec des atomes placés à quatre des huit sites interstitiels tétraédriques.
Liaisons[modifier | modifier le code]
Tous les atomes de chaque espèce sont sur des sites équivalents, coordinés de façon tétraédrique. Chaque atome est au centre d'un tétraèdre régulier imaginaire formé par quatre atomes de l'espèce opposée et forme une liaison avec ceux-ci.
Matériaux cristallisant dans cette structure[modifier | modifier le code]
Le nom de cette structure provient du minéral sphalérite, aussi appelé blende (ZnS), qui cristallise dans cette structure. La plupart des composés de type I-VII, II-VI (CdS, ZnSe, CdSe, CdTe, ZnTe, BeTe...) et III-V (GaAs, AlAs, InP...) cristallisent dans cette structure. La majorité d'entre-eux sont des semiconducteurs. La similarité des structures de ces composés binaires permet de former des composés ternaires et multinaires avec une solution solide sur toute la gamme de composition, comme l'InxGa1−xAs et l'AlxGa1−xAs.
Différences avec des structures cristallines similaires[modifier | modifier le code]
Structure diamant[modifier | modifier le code]

Les structures « diamant » et blende ont des atomes aux mêmes positions, mais dans la structure diamant, une seule espèce atomique est présente. Cette différence change la symétrie cristalline et par conséquent de nombreuses propriétés liées telles que les modes de vibrations et la variétés d'états de surface. La structure diamant est centrosymétrique tandis que la structure blende ne l'est pas. La symétrie est plus basse dans la structure bi-atomique : le groupe d'espace de la structure diamant est Fd3m tandis que celui de la blende est F43m.
Certains phénomènes absents dans la structure diamant apparaissent dans la structure blende :
- Certains plans cristallins de la blende sont polaires, c'est-à-dire que la composante dipolaire perpendiculaire au plan est non-nulle. Cela a pour effet de changer la composition et l'énergie de certaines surfaces.
- Les phonons optiques, triplement dégénérés dans la structure diamant, peuvent perdre leur dégénérescence et se séparer en un phonon longitudinal et en deux phonons dégénérés transverses d'énergie différente. Cette perte de dégénérescence due à l'interaction entre le phonon et le plasmon[3] n'est cependant pas fondamentale à la symétrie du cristal et peut être récupérée en masquant le champ électrique[4].
Structure fluorine[modifier | modifier le code]

La structure fluorine, ou fluorite, appartient au groupe d'espace Fm3m. Cette structure est aussi une structure composée de deux types d'atomes différents basée sur la structure CFC. Dans la structure fluorine, les huit sites tétraédriques sont remplis au lieu de seulement quatre dans la structure blende. Ceci change la stœchiométrie. Il y a deux atomes d'une espèce pour chaque atome de l'autre espèce dans cette structure.
Structure wurtzite[modifier | modifier le code]

La structure cristalline wurtzite est décrite par la désignation Strukturbericht B4 et le symbole de Pearson hP4. Le numéro du groupe d'espace correspondant est 186 (selon la classification de l'union internationale de cristallographie) ou P63mc (selon la notation d'Hermann-Mauguin). Si la structure blende est l'équivalente bi-atomique de la structure diamant, alors la structure wurtzite est l'équivalente bi-atomique du diamant hexagonal (la lonsdaléite). Dans cette structure, le sous-réseau cristallin de chacun des deux éléments n'est pas CFC mais hexagonal compact. De nombreux matériaux cristallisant dans la structure blende ont aussi une forme polymorphique cristallisant dans la structure wurtzite. La structure wurtzite est obtenue depuis la structure blende en déplaçant certains plans atomiques (111), comme illustré dans l'image à droite. La structure blende est formée d'un empilement de trois couches non-équivalentes dans la direction [111], tandis que la structure wurtzite n'a que deux couches non-équivalentes. Sur l'image, chaque sphère correspond à un motif d'un atome de chaque espèce.
Notes et références[modifier | modifier le code]
- (en) L. Kantorovich, Quantum Theory of the Solid State, Springer, (ISBN 1-4020-2153-4, lire en ligne), p. 32
- (en) « The Zincblende (B3) Structure », sur atomic-scale-physics.de, (consulté le ).
- (en) C. H. Henry et J. J. Hopefield, « Raman scattering by polaritons », Physical Review Letters, vol. 15, no 25, , p. 964-966
- (en) A. Mooradian et G. B. Wright, « Observation of the interaction of plasmons with longitudinal optical phonons in GaAs », Physical Review Letters, vol. 16, no 22, , p. 999-1001
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- « La structure ZnS Blende », sur ressources.univ-lemans.fr (consulté le )
- (en) « The Zincblende (ZnS) Structure », sur ilpi.com (consulté le )
