Acétonitrile
| Acétonitrile | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acétonitrile[1] | |
| Nom systématique | éthanenitrile[1] | |
| Synonymes |
cyanure de méthyle |
|
| No CAS | ||
| No ECHA | 100.000.760 | |
| No CE | 200-835-2 | |
| No RTECS | AL7700000 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[2] | |
| Propriétés chimiques | ||
| Formule | C2H3N [Isomères] |
|
| Masse molaire[5] | 41,051 9 ± 0,002 g/mol C 58,51 %, H 7,37 %, N 34,12 %, |
|
| Moment dipolaire | 3,925 19 D[3] | |
| Diamètre moléculaire | 0,436 nm[4] | |
| Propriétés physiques | ||
| T° fusion | −46 °C[2] | |
| T° ébullition | 82 °C[2] ; 81,6 °C (760 mmHg)[6] | |
| Solubilité | Miscible avec l'acétone, l'acétate d'éthyle, l'acétate de méthyle, le benzène, le chloroforme, le chlorure d'éthylène, l'eau, l'éthanol, l'éther diéthylique, le méthanol, les solutions d'acétamide, le tétrachlorure de carbone, de nombreux hydrocarbures insaturés ; immiscible avec les hydrocarbures saturés[6] | |
| Paramètre de solubilité δ | 24,3 MPa1/2 (25 °C)[7] | |
| Masse volumique | 0,8 g cm−3[2]
|
|
| T° d'auto-inflammation | 524 °C[2] | |
| Point d’éclair | 12,8 °C (coupelle fermée)[2] | |
| Limites d’explosivité dans l’air | 3,0–16 %vol[2] | |
| Pression de vapeur saturante | à 20 °C : 9,7 kPa[2]
|
|
| Viscosité dynamique | 0.345 cP à 25 °C | |
| Point critique | 48,3 bar, 274,75 °C[9] | |
| Thermochimie | ||
| S0liquide, 1 bar | 149,62 J K−1 mol−1[10] | |
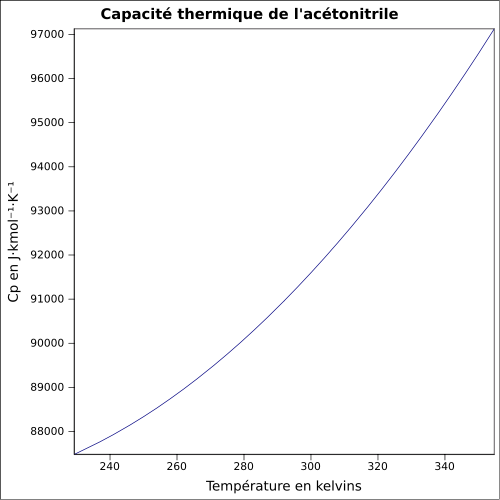
| Cp | ||
| PCS | 1 247,2 kJ mol−1 (25 °C, liquide)[12] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,20 ± 0,01 eV (gaz)[13] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,341[4] | |
| Précautions | ||
| SGH[14] | ||
| H225, H312, H319, H332, P210, P280, P301+P312+P330, P302+P352+P312, P304+P340+P312 et P305+P351+P338 |
||
| SIMDUT[15] | ||
  B2, D1A, D2B, |
||
| NFPA 704 | ||
| Transport[16] | ||
| Écotoxicologie | ||
| LogP | −0,3[2] | |
| Seuil de l’odorat | bas : 40 ppm haut : 1 161 ppm[17] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'acétonitrile, ou cyanure de méthyle, est un composé organique de formule CH3CN. Ce liquide incolore, d'odeur sucrée, est le nitrile organique le plus simple, et très souvent utilisé en tant que solvant.
Production, applications industrielles, économie et histoire[modifier | modifier le code]
L'acétonitrile est obtenu comme sous-produit de la production de l'acrylonitrile, c'est pourquoi la tendance à la production d'acétonitrile suit généralement celle de l'acrylonitrile. Les plus grands producteurs de cette molécule aux États-Unis sont Ineos, DuPont, J.T. Baker Chemical, et Sterling Chemicals. En 1992, 14 700 tonnes d'acétonitrile ont été produites aux États-Unis. En 2008, la crise économique ayant entrainé une baisse soudaine de la demande en fibres et résines acryliques, la production d'acrylonitrile et d'acétonitrile a chuté et le prix de l'acétonitrile a été multiplié par quinze en quelques mois[18]. L'acétonitrile est utilisé comme solvant, notamment dans l'industrie pharmaceutique, mais également comme intermédiaire réactionnel dans la production de bon nombre de substances chimiques des pesticides aux parfums[19].
Usages en laboratoire[modifier | modifier le code]
C'est un solvant de choix pour tester une réaction chimique inconnue. Il est polaire, et son domaine liquide est assez étendu ce qui le rend commode. Il dissout une large gamme de composés sans encombre, conséquemment à la présence de protons non acides. L'acétone présente les mêmes propriétés mais elle est plus acide et plus réactive envers les bases et les nucléophiles. En chimie inorganique, l'acétonitrile est très employé comme ligand, abrégé MeCN. On l'utilise par exemple sous la forme PdCl2(MeCN)2 préparé en chauffant à reflux du dichlorure de palladium dans l'acétonitrile. C'est un solvant commun en voltampérométrie cyclique en raison de sa constante diélectrique relativement élevée. L'acétonitrile est aussi souvent utilisée en chromatographie en phase liquide, où il sert de phase mobile pour la séparation de molécules.
Précautions[modifier | modifier le code]
Il est nocif et inflammable. Il peut pénétrer par voie orale, cutanée ou par inhalation. Il est métabolisé en acide cyanhydrique et thiocyanate.
Détection dans des disques circumstellaires[modifier | modifier le code]
En , des astronomes utilisant ALMA annoncent la détection de grandes quantités d'acétonitrile dans le disque protoplanétaire entourant la jeune étoile MWC 480[20].
Liens externes[modifier | modifier le code]
- WebBook page for C2H3N
- International Chemical Safety Card 0088
- National Pollutant Inventory - Acetonitrile fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Fiche MSDS, sur acros.be
Notes et références[modifier | modifier le code]
- Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book), Cambridge, The Royal Society of Chemistry, (ISBN 978-0-85404-182-4, DOI 10.1039/9781849733069-FP001), p. 902.
- ACETONITRILE, Fiches internationales de sécurité chimique
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Acetonitrile » dans la base de données Hazardous Substances Data Bank (consulté le 16 juillet 2012).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) « Acetonitrile »
 , sur NIST.
, sur NIST.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- Fiche Sigma-Aldrich du composé Acetonitrile, consultée le 10 août 2020.
- « Acétonitrile » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- Entrée « Acetonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 août 2020 (JavaScript nécessaire).
- « Acetonitrile », sur hazmap.nlm.nih.gov (consulté le ).
- Chemistry World, vol. 6, no 1, janvier 2009, p. 18.
- « Fiche complète pour Acétonitrile - CNESST », sur reptox.cnesst.gouv.qc.ca (consulté le ).
- « Des molécules organiques complexes découvertes dans un jeune système stellaire - Et si les briques élémentaires de la chimie de la vie étaient universelles ? », sur eso.org (consulté le ).