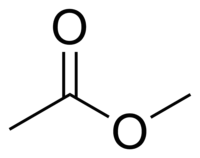
Acétate de méthyle
| Acétate de méthyle | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | éthanoate de méthyle | ||
| No CAS | |||
| No ECHA | 100.001.078 | ||
| No CE | 201-185-2 | ||
| No RTECS | AI9100000 | ||
| PubChem | 6584 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C3H6O2 [Isomères] |
||
| Masse molaire[3] | 74,078 5 ± 0,003 4 g/mol C 48,64 %, H 8,16 %, O 43,2 %, |
||
| Moment dipolaire | 1,72 ± 0,09 D [1] | ||
| Diamètre moléculaire | 0,497 nm [2] | ||
| Propriétés physiques | |||
| T° fusion | −98 °C[4] | ||
| T° ébullition | 57-58 °C[4] | ||
| Paramètre de solubilité δ | 19,6 MPa1/2 (25 °C)[5]; 19,3 J1/2·cm-3/2 (25 °C)[2] |
||
| Masse volumique | 0,932 g·cm-3 à 25 °C[4] | ||
| T° d'auto-inflammation | 502,2 °C[4] | ||
| Point d’éclair | −13 °C[4] | ||
| Pression de vapeur saturante | 165 mmHg à 20 °C[4] | ||
| Point critique | 233,45 °C, 4,75 MPa, 0,331 l·mol-1[6] | ||
| Thermochimie | |||
| Cp | |||
| PCS | 1 592,2 kJ·mol-1[8] (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,25 ± 0,02 eV (gaz)[9] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,359 3 [10] | ||
| Précautions | |||
| NFPA 704 | |||
| Directive 67/548/EEC | |||
| [4] | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 0,05[12] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
L'acétate de méthyle ou éthanoate de méthyle en nomenclature systématique, également connu comme l'ester méthylique de l'acide acétique parfois confondu avec l'acétone, est un liquide clair, très inflammable, à l'odeur agréable caractéristique de certaines colles et dissolvants pour vernis à ongles. L'acétate de méthyle a des caractéristiques très similaires à celles de l'acétate d'éthyle. L'acétate de méthyle est utilisé comme solvant dans des colles, peintures et nettoyants de vernis à ongles, en synthèse organique et pour des extractions. Il est très faiblement polaire (lipophile) et aprotique, il est assez soluble dans l'eau à température élevée. Il s'hydrolyse, spécialement à température élevée, en méthanol et en acide acétique en présence d'acides forts aqueux ou en acétate en présence d'une base forte aqueuse. Sa présence dans le milieu interstellaire a été détectée par spectroscopie en 2013[13].
Synthèse[modifier | modifier le code]
L'acétate de méthyle est synthétisé à partir d'acide acétique et de méthanol en présence d'un acide fort comme l'acide sulfurique dans une réaction d'estérification. La conversion de l'acétate de méthyle en ses composants, par hydrolyse acide, est une réaction du premier ordre vis-à-vis de l'ester tandis que la même hydrolyse en milieu basique est une réaction du second ordre vis-à-vis de l'ester et de la base.
Usage[modifier | modifier le code]
L'anhydride acétique est produit par carbonylation d'acétate de méthyle avec un protocole inspiré du procédé Monsanto[14].
Métabolisme et toxicité[modifier | modifier le code]
Après absorption orale, l'acétate de méthyle est décomposé partiellement dans l'estomac en méthanol et acide acétique par des estérases de la muqueuse gastrique. Une exposition élevée aboutit à retrouver l'acétate de méthyle dans le sang[15]. La demi-vie dans le sang est de 4 heures[16].
Sources "naturelles"[modifier | modifier le code]
L'acétate de méthyle est aussi un composé volatile rencontré dans les plantes :
- Jus de raisin frais : 0,026 ppm(1)[17]
- Graines ensilées : 0.29 à 6.15 nL/L[18]
- Amandes avec coque : 0.10 nL/L[18]
- Fleurs de Kiwi (Actinidia chinensis) : 0.57%[19]
- Et aussi : Menthe (Water Mint, Crested Latesummer Mint), Ananas, Artemisia (Annual Mugwort), Papaye, Fleur de tournesol, Pommier, Pêche, Huile essentielle de gingembre[20].
Notes et références[modifier | modifier le code]
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Acétate de méthyle sur sigmaaldrich.com
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- « Avantor is setting science in motion for a better world », sur VWR (consulté le ).
- (en) Hideji Tanii, Jian Huang, Takao Ohyashiki et Kazuo Hashimoto, « Physical-Chemical-Activity Relationship of Organic Solvents: Effects on Na+-K+-ATPase Activity and Membrane Fluidity in Mouse Synaptosomes », Neurotoxicology and Teratology, vol. 16, no 6, , p. 575-582 (DOI 10.1016/0892-0362(94)90035-3)
- (en) B. Tercero, I. Kleiner, J. Cernicharo, H. V. L. Nguyen, A. López et G. M. Muñoz Caro, « Discovery of Methyl Acetate and Gauche Ethyl Formate in Orion », The Astrophysical Journal Letters, vol. 770, no 1, , article no L13 (DOI 10.1088/2041-8205/770/1/L13, Bibcode 2013ApJ...770L..13T, arXiv 1305.1135, lire en ligne)
- (en) Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M., « Eastman Chemical Company Acetic Anhydride Process », Catalysis Today, vol. 13, , p. 73-91 (DOI 10.1016/0920-5861(92)80188-S)
- ECHA; European Commission - Joint Research Centre Institute for Health and Consumer Protection European Chemicals Bureau (ECB); European Union Risk Assessment Report on Methyl Acetate (CAS No: 79-20-9) (EINECS No: 201-185-2) Volume 34 p.55 (2003). Available from, as of November 21, 2014: http://echa.europa.eu/en/support/documents-library
- ECHA; European Commission - Joint Research Centre Institute for Health and Consumer Protection European Chemicals Bureau (ECB); European Union Risk Assessment Report on Methyl Acetate (CAS No: 79-20-9) (EINECS No: 201-185-2) Volume 34 p.54 (2003). Available from, as of November 21, 2014: http://echa.europa.eu/en/support/documents-library
- Cadwallader KR, Xu Y; J Agric Food Chem 42: 782-84 (1994)
- Malkina IL et al; J Environ Qual 40: 28-36 (2011)
- Tatsuka K et al; J Agric Food Chem 38: 2176-80 (1990)
- USDA; Dr. Duke's Phytochemical and Ethnobotanical Databases. Plants with a chosen chemical. Methyl acetate. Washington, DC: US Dept Agric, Agric Res Service. Available from, as of Sept 29, 2014: http://www.ars-grin.gov/duke/
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methyl acetate » (voir la liste des auteurs).








