Voie de signalisation Wnt

Les voies de signalisation Wnt sont un groupe de voies de transduction de signaux qui commencent par des protéines qui transmettent des signaux dans une cellule via des Récepteurs transmembranaires. Le nom Wnt est un mot-valise créé à partir des noms Wingless (en français « sans aile ») et Int-1 (en français « site d'intégration »)[1]. Les voies de signalisation Wnt utilisent soit la communication intercellulaire à proximité (paracrine), soit la communication au sein de la même cellule (autocrine). Ils sont hautement conservés au cours de l'évolution chez les animaux, ce qui signifie qu'ils sont similaires dans toutes les espèces animales, depuis les drosophiles jusqu'aux humains[2],[3].
Trois voies de signalisation Wnt ont été caractérisées : la voie canonique Wnt, la voie Wnt non canonique qui contrôle la polarité cellulaire planaire et la voie non canonique Wnt/calcium. Les trois voies sont activées par la liaison d'un ligand de la protéine Wnt à un récepteur de la famille Frizzled, qui transmet le signal biologique à la protéine Dishevelled à l'intérieur de la cellule. La voie canonique Wnt conduit à la régulation de la transcription des gènes et serait régulée négativement en partie par le gène SPATS1[4]. La voie de polarité cellulaire planaire non canonique régule le cytosquelette responsable de la forme de la cellule. La voie non canonique Wnt/calcium régule le calcium à l’intérieur de la cellule.
La signalisation Wnt a d’abord été identifiée pour son rôle dans la carcinogenèse, puis pour sa fonction dans l'embryogenèse. Les processus embryonnaires qu'il contrôle comprennent la configuration des axes corporels, la différenciation cellulaire, la Prolifération cellulaire et la migration cellulaire. Ces processus sont nécessaires à la formation adéquate de tissus importants, notamment les os, le cœur et les muscles. Son rôle dans le développement embryonnaire a été découvert lorsque des mutations génétiques dans les protéines de la voie Wnt ont produit des embryons anormaux de drosophiles. Des recherches ultérieures ont révélé que les gènes responsables de ces anomalies influençaient également le développement du cancer du sein chez la souris. La signalisation Wnt contrôle également la régénération des tissus dans la moelle osseuse, la peau et l'intestin des adultes[5].
L'importance clinique de cette voie a été démontrée par des mutations qui conduisent à diverses maladies, notamment le cancer du sein et de la prostate, le glioblastome, le diabète de type 2 et d'autres[6],[7]. Ces dernières années, les chercheurs ont signalé pour la première fois l’utilisation réussie d’inhibiteurs de la voie Wnt dans des modèles murins de maladies[8].
Histoire et étymologie[modifier | modifier le code]
La découverte de la signalisation Wnt a été influencée par la recherche sur les rétrovirus oncogènes (causant le cancer). En 1982, Roel Nusse et Harold Varmus ont infecté des souris avec le virus de la tumeur mammaire de la souris (MMTV) afin de faire muter les gènes de la souris afin de déterminer quels gènes mutés pourraient provoquer des tumeurs du sein. Ils ont identifié un nouveau proto-oncogène de souris qu'ils ont nommé int1 (« site d'intégration 1»)[9],[3].
Int1 est hautement conservé dans plusieurs espèces, notamment les humains et la drosophile. Sa présence chez la drosophile a conduit les chercheurs à découvrir en 1987 que le gène int1 chez la drosophile était en fait le gène déjà connu et caractérisé de la drosophile connu sous le nom de Wingless (Wg)[3] Puisque des recherches antérieures de Christiane Nüsslein-Volhard et Eric F. Wieschaus (qui leur ont valu le prix Nobel de physiologie ou médecine en 1995) avaient déjà établi la fonction de Wg en tant que gène de polarité segmentaire impliqué dans la formation de l'axe corporel au cours du développement embryonnaire, les chercheurs ont déterminé que l'int1 des mammifères découvert chez la souris est également impliqué dans le développement embryonnaire[10].
La poursuite des recherches a conduit à la découverte d'autres gènes liés à int1 ; cependant, comme ces gènes n’ont pas été identifiés de la même manière que int1, la nomenclature des gènes int était inadéquate. Ainsi, la famille int/Wingless est devenue la famille Wnt et int1 est devenue Wnt1[3].
Protéines[modifier | modifier le code]
Wnt comprend une famille diversifiée de glycoprotéines de signalisation sécrétées modifiées par des lipides et d'une longueur de 350 à 400 acides aminés. La modification lipidique de tous les Wnts est la palmitoléoylation d'un seul résidu cystéine totalement conservé. La palmitoléoylation est nécessaire pour la liaison de Wnt à sa protéine porteuse Wntless (WLS) afin qu'elle puisse être transportée vers la membrane plasmique pour la sécrétion[11] et permet à la protéine Wnt de se lier à son récepteur Frizzled[12],[13] Les protéines Wnt subissent également une glycosylation, qui fixe un glucide afin d'assurer une bonne sécrétion[14]. Dans la signalisation Wnt, ces protéines agissent comme des ligands pour activer les différentes voies Wnt via les voies paracrine et autocrine[7],[2].
Ces protéines sont hautement conservées d’une espèce à l’autre[3]. On les retrouve chez la souris, l'humain, le Xenopus, le zebrafish, la drosophile et bien d'autres[15].
Mécanisme[modifier | modifier le code]
Origine[modifier | modifier le code]
La signalisation Wnt commence lorsqu'une protéine Wnt se lie au domaine extracellulaire N-terminal riche en cystéine d'un récepteur de la famille Frizzled (Fz)[16]. Ces récepteurs constituent une famille distincte de récepteurs couplés aux protéines G (GPCR)[17]. Cependant, pour faciliter la signalisation Wnt, des co-récepteurs peuvent être nécessaires parallèlement à l'interaction entre la protéine Wnt et le récepteur Frizzled. Les exemples incluent la protéine liée au récepteur des lipoprotéines (LRP5 et LRP6), le récepteur à activité tyrosine kinase (RTK) et ROR2[7]. Lors de l'activation du récepteur, un signal est envoyé à la phosphoprotéine Disheveled (Dsh), située dans le cytoplasme. Ce signal est transmis via une interaction directe entre Frizzled et Disheveled. Les protéines Disheveled sont présentes dans tous les organismes et partagent toutes les domaines protéiques hautement conservés suivants : un domaine DIX amino-terminal, un domaine PDZ central et un domaine DEP carboxy-terminal. Ces différents domaines sont importants car après Disheveled, le signal Wnt peut se diviser en plusieurs voies et chaque voie interagit avec une combinaison différente des trois domaines[18].
Voies canoniques et non canoniques[modifier | modifier le code]
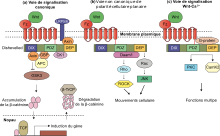
Les trois voies de signalisation Wnt les mieux caractérisées sont la voie canonique Wnt, la voie non canonique de polarité cellulaire planaire et la voie non canonique Wnt/calcium. Comme leurs noms l’indiquent, ces voies appartiennent à l’une des deux catégories suivantes : canoniques ou non canoniques. La différence entre les catégories est qu'une voie canonique implique la protéine bêta-caténine tandis qu'une voie non canonique fonctionne indépendamment de cette protéine[16].
Voie canonique[modifier | modifier le code]
La voie canonique Wnt (ou voie Wnt/β-caténine) est la voie Wnt qui provoque une accumulation de β-caténine dans le cytoplasme et son éventuelle translocation dans le noyau pour agir comme coactivateur transcriptionnel des facteurs de transcription appartenant à la famille TCF/LEF. Sans Wnt, la β-caténine ne s’accumulerait pas dans le cytoplasme puisqu’un complexe de destruction la dégraderait normalement. Ce complexe de destruction comprend les protéines suivantes : Axine, adénomatose polypose coli (APC), protéine phosphatase 2A (PP2A), glycogène synthase kinase 3 (GSK3) et Caséine kinase 1 alpha (CK1α)[19],[20]. Il dégrade la β-caténine en la ciblant pour l'ubiquitination, qui l'envoie ensuite au protéasome pour y être digérée[16],[21]. Cependant, dès que Wnt lie Frizzled et LRP5/6, la fonction du complexe de destruction est perturbée. Cela est dû au fait que Wnt provoque la translocation du régulateur Wnt négatif, Axine, et du complexe de destruction vers la membrane plasmique. La phosphorylation par d'autres protéines du complexe de destruction lie ensuite l'Axine à la queue cytoplasmique de LRP5/6. L'axine devient déphosphorylée et sa stabilité et ses niveaux diminuent. Dishevelled est alors activé par phosphorylation et ses domaines DIX et PDZ inhibent l'activité GSK3 du complexe de destruction. Cela permet à la β-caténine de s'accumuler et de se localiser dans le noyau et d'induire ensuite une réponse cellulaire via l'activation de géne aux côtés des facteurs de transcription TCF/LEF[22],[21]. La β-caténine recrute d'autres coactivateurs transcriptionnels, tels que BCL9, Pygopus[23] et Parafibromin/Hyrax[24].
Cependant, il manque encore une théorie unifiée sur la façon dont la β-caténine pilote l'expression des gènes cibles, et des acteurs spécifiques aux tissus pourraient aider la β-caténine à définir ses gènes cibles[25]. La diversité des protéines interagissant avec la β-caténine complique notre compréhension : la β-caténine peut être directement phosphorylée au niveau de Ser552 par Akt, ce qui provoque sa dissociation des contacts inter-cellulaire et son accumulation dans le cytosol, par la suite 14-3-3ζ interagit avec la β-caténine (pSer552) et améliore sa translocation nucléaire[26]. Il a été rapporté que BCL9 et Pygopus possèdent en fait plusieurs fonctions indépendantes de la β-caténine (donc probablement indépendantes de la signalisation Wnt)[27],[28],[29].
Voie non canonique[modifier | modifier le code]
La voie non canonique de polarité cellulaire planaire n’implique pas la β-caténine. Elle n’utilise pas LRP-5/6 comme co-récepteur et utiliserait NRH1, Ryk, PTK7 ou ROR2. La voie PCP est activée via la liaison de Wnt à Frizzled et à son co-récepteur. Le récepteur recrute ensuite Disheveled, qui utilise ses domaines PDZ et DIX pour former un complexe avec l'activateur de morphogenèse 1 associé à Dishevelled (DAAM1). Daam1 active ensuite la petite protéine G Rho via un facteur d'échange de guanine. Rho active la protéine kinase associée à Rho (ROCK), qui est l'un des principaux régulateurs du cytosquelette. Dishevelled forme également un complexe avec RAC1 et assure la médiation de la liaison de la profiline à l'actine. Rac1 active JNK et peut également conduire à la polymérisation de l'actine. La liaison de la profiline à l'actine peut entraîner une restructuration du cytosquelette et à la gastrulation[7],[30].
La voie non canonique Wnt/calcium n’implique pas non plus la β-caténine. Son rôle est d'aider à réguler la libération de calcium par le réticulum endoplasmique afin de contrôler les niveaux de calcium intracellulaire. Comme les autres voies Wnt, lors de la liaison du ligand, le récepteur Frizzled activé interagit directement avec Dishevelled et active des domaines spécifiques de la protéine Dishevelled. Les domaines impliqués dans la signalisation Wnt/calcium sont les domaines PDZ et DEP[7]. Cependant, contrairement aux autres voies Wnt, le récepteur Frizzled s’interface directement avec une protéine G trimérique. Cette co-stimulation de Dishevelled et de la protéine G peut conduire à l'activation de la phospholipase C ou de la phosphodiestérase spécifique du GMPc. Si la phospholipase C est activé, le composant de la membrane plasmique PIP2 est scindé en DAG et IP3. Lorsque IP3 se lie à son récepteur sur le réticulum endoplasmique, du calcium est libéré. Des concentrations accrues de calcium et de DAG peuvent activer Cdc42 via la protéine kinase C. Cdc42 est un régulateur important de la structuration ventrale. L'augmentation du calcium active également la calcineurine et CaMKII. CaMKII induit l'activation du facteur de transcription NFAT, qui régule l'adhésion cellulaire, la migration et la séparation des tissus[7]. La calcineurine active les kinases TAK1 et NLK, qui peuvent interférer avec la signalisation TCF/β-Caténine dans la voie canonique Wnt[31]. Cependant, si la PDE est activée, la libération de calcium du réticulum endoplasmique est inhibée. La phosphodiestérase y intervient via l'inhibition de la protéine kinase G, qui provoque ensuite l'inhibition de la libération de calcium[7].
Voie Wnt intégrée[modifier | modifier le code]
La distinction binaire des voies de signalisation Wnt canoniques et non canoniques a fait l'objet d'un examen minutieux et une voie Wnt intégrée et convergente a été proposée. Certaines preuves ont été trouvées pour le ligand Wnt (WNT5A)[32]. Des preuves d'une voie de signalisation convergente Wnt qui montre l'activation intégrée de la signalisation Wnt/Ca2+ et Wnt/β-caténine, pour plusieurs ligands Wnt, ont été décrites dans des lignées cellulaires de mammifères[33].
Autres voies de signalisation[modifier | modifier le code]
La signalisation Wnt régule également un certain nombre d’autres voies de signalisation qui n’ont pas été aussi bien élucidées. L'une de ces voies inclut l'interaction entre Wnt et GSK3. Au cours de la croissance cellulaire, Wnt peut inhiber GSK3 afin d'activer mTOR en l'absence de β-caténine. Cependant, Wnt peut également servir de régulateur négatif de mTOR via l'activation du suppresseur de tumeur TSC2, qui est régulé positivement via l'interaction Disheveled et GSK3[34]. Au cours de la myogenèse, Wnt utilise la protéine kinase A et CREB pour activer les gènes MyoD et Myf5[35]. Wnt agit également en collaboration avec Ryk et Src pour permettre la régulation de la répulsion neuronale pendant le guidage axonal. Wnt régule la gastrulation lorsque Kératine 1 sert d'inhibiteur de Rap1-ATPase afin de moduler le cytosquelette pendant la gastrulation. Une régulation plus poussée de la gastrulation est obtenue lorsque Wnt utilise ROR2 ainsi que les voies CDC42 et JNK pour réguler l'expression de la protocadhérine. Dishevelled peut également interagir avec aPKC, Pa3, Par6 et LGl afin de contrôler la polarité cellulaire et le développement des microtubules du cytosquelette. Bien que ces voies chevauchent les composants associés à la signalisation PCP et Wnt/Calcium, elles sont considérées comme des voies distinctes car elles produisent des réponses différentes[7].
Régulation[modifier | modifier le code]
Afin d'assurer un bon fonctionnement, la signalisation Wnt est constamment régulée en plusieurs points aux cours de son mécanisme[36]. Par exemple, les protéines Wnt sont palmitoylées. La protéine PORCN intervient dans ce processus, ce qui signifie qu’elle aide à réguler le moment où le ligand Wnt est sécrété en déterminant le moment où il est complètement formé. La sécrétion est en outre contrôlée par des protéines telles que GPR177 et des complexes tels que le complexe rétromère[7],[21].
Lors de la sécrétion, le ligand peut être empêché d'atteindre son récepteur grâce à la liaison de protéines telles que les stabilisants Dally et glypican 3, qui inhibent la diffusion. Dans les cellules cancéreuses, les chaînes d'héparane sulfate[37],[38] et la protéine centrale de GPC3[39],[40] sont impliquées dans la régulation de la liaison Wnt et de l'activation de la prolifération cellulaire[41],[42]. Wnt reconnaît une structure héparane sulfate sur GPC3, qui contient IdoA2S et GlcNS6S, et la 3-O-sulfation dans GlcNS6S3S améliore la liaison de Wnt au glypican héparane sulfate. Un domaine riche en cystéine au niveau du lobe N de GPC3 a été identifié pour former un sillon hydrophobe se liant à Wnt, comprenant la phénylalanine-41 qui interagit avec Wnt[40],[43]. Le blocage du domaine de liaison Wnt à l'aide d'un nanocorps appelé HN3 peut inhiber l'activation de Wnt[39].
Au récepteur Frizzled, la liaison de protéines autres que Wnt peut contrarier la signalisation. Les antagonistes spécifiques comprennent Dickkopf, le facteur inhibiteur Wnt 1, les protéines sécrétées Frizzled-rated, Cerberus, Frzb, Wise, Sclérostine et Nkd. Ceux-ci constituent des inhibiteurs de la signalisation Wnt. Mais d’autres molécules agissent également comme activateurs. Norrin et R-Spondin2 activent la signalisation Wnt en l'absence de ligand Wnt.
Les interactions entre les voies de signalisation Wnt régulent également la signalisation Wnt. Comme mentionné précédemment, la voie Wnt/calcium peut inhiber la voie TCF/β-caténine, empêchant ainsi la signalisation canonique de la voie Wnt[7],[21]. La prostaglandine E2 est un activateur essentiel de la voie de signalisation canonique Wnt. L'interaction de la prostaglandine E2 avec ses récepteurs E2/E4 stabilise la β-caténine par phosphorylation médiée par l'AMPc/PKA. La synthèse de prostaglandine E2 est nécessaire pour les processus médiés par la signalisation Wnt tels que la régénération tissulaire et le contrôle de la population de cellules souches chez le zebrafish et la souris[5]. Curieusement, les régions non structurées de plusieurs protéines intrinsèquement désordonnées jouent un rôle crucial dans la régulation de la signalisation Wnt[44].
Réponses cellulaires induites[modifier | modifier le code]
Développement embryonnaire[modifier | modifier le code]
La signalisation Wnt joue un rôle essentiel dans le développement embryonnaire. Il fonctionne à la fois chez les vertébrés et les invertébrés, notamment les humains, les grenouilles, le zebrafish, C. elegans, la drosophile et autres. Il a été trouvé pour la première fois dans le segment de polarité de la drosophile, où il aide à établir les polarités antérieure et postérieure. Il est impliqué dans d'autres processus de développement. Comme sa fonction chez la drosophile le suggère, il joue un rôle clé dans la formation des axes corporels, en particulier dans la formation des axes antéropostérieur et dorsoventral. Il est impliqué dans l’induction de la différenciation cellulaire pour favoriser la formation d’organes importants tels que les poumons et les ovaires. Wnt assure en outre le développement de ces tissus grâce à une régulation appropriée de la prolifération et de la migration cellulaire. Les fonctions de signalisation Wnt peuvent être divisées en structuration des axes, spécification du destin cellulaire, prolifération cellulaire et migration cellulaire[45].
Formation des axes[modifier | modifier le code]
Au début du développement embryonnaire, la formation des axes primaires du corps est une étape cruciale dans l’établissement du plan corporel global de l’organisme. Les axes comprennent l'axe antéropostérieur, l'axe dorsoventral et l'axe droite-gauche. La signalisation Wnt est impliquée dans la formation des axes antéropostérieur et dorsoventral. L'activité de signalisation Wnt dans le développement antéro-postérieur peut être observée chez les mammifères, les poissons et les grenouilles. Chez les mammifères, la ligne primitive et d'autres tissus environnants produisent les composés morphogéniques Wnts, BMP, FGF, Nodal et l'acide rétinoïque pour établir la région postérieure au cours de la gastrula tardive. Ces protéines forment des gradients de concentration. La zone de concentration la plus élevée établissent la région postérieure tandis que la zone de concentration la plus faible indiquent la région antérieure. Chez les poissons et les grenouilles, la β-caténine produite par la signalisation canonique Wnt provoque la formation de centres organisateurs qui, aux côtés des BMP, provoquent une formation postérieure. L'implication de Wnt dans la formation de l'axe dorsoventral peut être observée dans l'activité de formation de l'organisateur Spemann, qui établit la région dorsale. La voie de signalisation Wnt/β-caténine induit la formation de cet organisateur via l'activation des gènes twin et siamois[32],[45]. De même, dans la gastrulation aviaire, les cellules de la faucille de Koller expriment différents gènes marqueurs mésodermiques qui permettent le mouvement différentiel des cellules lors de la formation de la strie primitive. La signalisation Wnt activée par les FGF est responsable de ce mouvement.
La signalisation Wnt est également impliquée dans la formation d’axes de parties spécifiques du corps et de systèmes organiques plus tard dans le développement. Chez les vertébrés, les gradients de signalisation morphogénétique Sonic hedgehog et Wnt établissent l'axe dorsoventral du système nerveux central au cours de la structuration axiale du tube neural. La signalisation Wnt élevée établit la région dorsale tandis que la signalisation Shh élevée indique la région ventrale. Wnt est impliqué dans la formation de l'axe dorsoventral du système nerveux central grâce à son implication dans le guidage des axones. Les protéines Wnt guident les axones de la moelle épinière dans une direction antéro-postérieure. Wnt est également impliqué dans la formation de l’axe dorsoventral des membres. Plus précisément, WNT7A aide à produire la configuration dorsale du membre en développement[32],[45].
Dans le modèle de développement des ondes de différenciation embryonnaire, Wnt joue un rôle essentiel en tant que complexe de signalisation dans les cellules compétentes prêtes à se différencier. Wnt réagit à l'activité du cytosquelette, stabilisant le changement initial créé par une onde passagère de contraction ou d'expansion et signale simultanément au noyau par l'utilisation de ses différentes voies de signalisation la vague à laquelle la cellule individuelle a participé. L'activité de Wnt amplifie ainsi signalisation mécanique qui se produit au cours du développement[46],[47].
Spécification de la différentiation cellulaire[modifier | modifier le code]
La différenciation cellulaire est un processus par lequel des cellules indifférenciées peuvent devenir un type cellulaire plus spécialisé. La signalisation Wnt induit la différenciation des cellules souches pluripotentes en cellules progénitrices du mésoderme et de l'endoderme[48]. Ces cellules progénitrices se différencient ensuite en types de cellules tels que les lignées de muscles lisses endothéliaux, cardiaques et vasculaires[49]. La signalisation Wnt induit la formation de sang à partir des cellules souches. Plus précisément, Wnt3 conduit à des cellules engagées dans le mésoderme avec un potentiel hématopoïétique[50]. Wnt1 s'oppose à la différenciation neuronale et constitue un facteur majeur dans l'auto-renouvellement des cellules souches neurales. Cela permet la régénération des cellules du système nerveux, ce qui constitue une preuve supplémentaire de leur rôle dans la promotion de la prolifération des cellules souches neurales[48]. La signalisation Wnt est impliquée dans la détermination des cellules germinales, la spécification des tissus intestinaux, le développement des follicules pileux, le développement du tissu pulmonaire, la différenciation des cellules de la crête neurale du tronc, le développement du néphron, le développement des ovaires et la détermination du sexe[45]. La signalisation Wnt s'oppose également à la formation du cœur, et l'inhibition de Wnt s'est avérée être un inducteur essentiel du tissu cardiaque au cours du développement[51],[52],[53], et les inhibiteurs de Wnt sont couramment utilisés pour produire des cardiomyocytes à partir de cellules souches pluripotentes[54],[55].
Prolifération cellulaire[modifier | modifier le code]
Afin d'obtenir la différenciation massive des cellules nécessaire pour former les tissus cellulaires spécifiés de différents organismes, la prolifération et la croissance des cellules souches embryonnaires doivent avoir lieu. Ce processus est médié par la signalisation canonique Wnt, qui augmente la β-caténine nucléaire et cytoplasmique. Une augmentation de la β-caténine peut initier l'activation transcriptionnelle de protéines telles que la cycline D1 et c-myc, qui contrôlent la transition de phase G1 à S dans le cycle cellulaire. L'entrée dans la phase S provoque la réplication de l'ADN et finalement la mitose, qui sont responsables de la prolifération cellulaire[56]. Cette augmentation de la prolifération est directement associée à la différenciation cellulaire, car à mesure que les cellules souches prolifèrent, elles se différencient également. Cela permet la croissance globale et le développement de systèmes tissulaires spécifiques au cours du développement embryonnaire. Cela est évident dans des systèmes tels que le système circulatoire, où Wnt3a conduit à la prolifération et à l'expansion des cellules souches hématopoïétiques nécessaires à la formation des globules rouges[57].
La biochimie des cellules souches cancéreuses est subtilement différente de celle des autres cellules tumorales. Ces cellules dites dépendantes de Wnt détournent et dépendent d’une stimulation constante de la voie Wnt pour favoriser leur croissance, leur survie et leur migration incontrôlées. Dans le cancer, la signalisation Wnt peut devenir indépendante des stimuli réguliers, grâce à des mutations dans les oncogènes en aval et les gènes suppresseurs de tumeurs qui sont activés de manière permanente même si le récepteur normal n'a pas reçu de signal. La β-caténine se lie à des facteurs de transcription tels que la protéine TCF4 et, en combinaison, les molécules activent les gènes nécessaires. LF3 inhibe fortement cette liaison in vitro, dans les lignées cellulaires et réduit la croissance tumorale dans les modèles murins. Cela empêchait la réplication et réduisait leur capacité à migrer, le tout sans affecter les cellules saines. Aucune cellule souche cancéreuse n’est restée après le traitement. La découverte était le produit d'une « conception rationnelle de médicaments », impliquant les technologies AlphaScreens et ELISA[58].
Migration cellulaire[modifier | modifier le code]
La migration cellulaire au cours du développement embryonnaire permet l’établissement des axes corporels, la formation des tissus, l’induction des membres et plusieurs autres processus. La signalisation Wnt aide à arbitrer ce processus, en particulier lors de l'extension convergente. La signalisation de la voie non canonique de polarité cellulaire planaire et de la voie canonique Wnt est requise pour une extension convergente appropriée pendant la gastrulation. L'extension convergente est en outre régulée par la voie Wnt/calcium, qui bloque l'extension convergente lorsqu'elle est activée. La signalisation Wnt induit également une migration cellulaire aux stades ultérieurs du développement grâce au contrôle du comportement de migration des neuroblastes, des cellules de la crête neurale, des myocytes et des cellules trachéales[59].
La signalisation Wnt est impliquée dans un autre processus de migration clé connu sous le nom de transition épithélio-mésenchymateuse. Ce processus permet aux cellules épithéliales de se transformer en cellules mésenchymateuses afin qu'elles ne soient plus maintenues en place au niveau de la laminine. Cela implique une régulation négative de la cadhérine afin que les cellules puissent se détacher de la laminine et migrer. La signalisation Wnt est un inducteur de la transition épithélio-mésenchymateuse, en particulier dans le développement mammaire[60].
Sensibilité à l'insuline[modifier | modifier le code]

L'insuline est une hormone peptidique impliquée dans l'homéostasie du glucose au sein de certains organismes. Plus précisément, cela conduit à une régulation positive des transporteurs de glucose dans la membrane cellulaire afin d’augmenter l’absorption du glucose dans le sang. Ce processus est partiellement médié par l'activation de la signalisation Wnt/β-caténine, qui peut augmenter la sensibilité à l'insuline d'une cellule. En particulier, WNT10B est une protéine Wnt qui augmente cette sensibilité dans les cellules musculaires squelettiques[61].
Implications cliniques[modifier | modifier le code]
Cancer[modifier | modifier le code]
Depuis sa découverte initiale, la signalisation Wnt est associée au cancer. Lorsque WNT1 a été découvert, il a été identifié pour la première fois comme proto-oncogène dans un modèle murin de cancer du sein. Le fait que Wnt1 soit un homologue de Wg montre qu'il est impliqué dans le développement embryonnaire, qui nécessite souvent une division et une migration cellulaires rapides. Une mauvaise régulation de ces processus peut conduire au développement de tumeurs via une prolifération cellulaire excessive[1].
L'activité canonique de la voie Wnt est impliquée dans le développement des tumeurs bénignes et malignes du sein. Le rôle de la voie Wnt dans la chimiorésistance tumorale a également été bien documenté, ainsi que son rôle dans le maintien d'une sous-population distincte de cellules initiatrices du cancer[62]. Sa présence est révélée par des taux élevés de β-caténine dans le noyau et/ou le cytoplasme, qui peuvent être détectés par coloration immunohistochimique et Western blot. L’expression accrue de la β-caténine est corrélée à un mauvais pronostic chez les patientes atteintes d’un cancer du sein. Cette accumulation peut être due à des facteurs tels que des mutations de la β-caténine, des déficiences dans le complexe de destruction de la β-caténine, le plus souvent par des mutations dans des régions structurellement désordonnées de l'APC, une surexpression des ligands Wnt, une perte d'inhibiteurs et/ou une diminution de l'activité des voies de régulation (telles que la voie Wnt/calcium)[20],[63],[64]. Les tumeurs du sein peuvent métastaser en raison de l'implication de Wnt dans la transition épithélio-mésenchymateuse. Des recherches portant sur les métastases du cancer du sein de type basal dans les poumons ont montré que la répression de la signalisation Wnt/β-caténine peut empêcher la transition épithélio-mésenchymateuse, ce qui peut inhiber les métastases[65].
La signalisation Wnt a été impliquée dans le développement d'autres cancers ainsi que dans la tumeur desmoïde[66]. Les modifications de l’expression de CTNNB1, qui code pour la β-caténine, peuvent être mesurées dans les cancers du sein, colorectal, du mélanome, de la prostate, du poumon et autres. Une expression accrue des protéines ligands Wnt telles que WNT1, WNT2 et WNT7A a été observée respectivement dans le développement du glioblastome, du cancer de l'œsophage et du cancer de l'ovaire. D'autres protéines qui provoquent plusieurs types de cancer en l'absence de bon fonctionnement comprennent ROR1, ROR2, SFRP4, WNT5A, WIF1 et celles de la famille TCF/LEF[67]. La signalisation Wnt est en outre impliquée dans la pathogenèse des métastases osseuses du cancer du sein et de la prostate, des études suggérant des états activés et désactivés discrets. Wnt est régulé négativement pendant la phase de dormance par le DKK1 autocrine pour éviter la surveillance immunitaire[68], ainsi que pendant les étapes de dissémination par le Dact1 intracellulaire[69]. Pendant ce temps, Wnt est activé au début de la phase de croissance par la E-sélectine[70].
Le lien entre la prostaglandin E2 et Wnt suggère qu'une augmentation chronique de la prostaglandin E2 liée à une inflammation pourrait conduire à l'activation de la voie Wnt dans différents tissus, entraînant une carcinogenèse[5].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Wnt signaling pathway » (voir la liste des auteurs).
- R Nusse, A Brown, J Papkoff et P Scambler, « A new nomenclature for int-1 and related genes: The Wnt gene family », Cell, vol. 64, no 2, , p. 231 (ISSN 0092-8674, DOI 10.1016/0092-8674(91)90633-a, lire en ligne, consulté le )
- Roel Nusse et Harold E. Varmus, « Wnt genes », Cell, vol. 69, no 7, , p. 1073–1087 (ISSN 0092-8674, DOI 10.1016/0092-8674(92)90630-u, lire en ligne, consulté le )
- (en) Roel Nusse, « Wnt signaling in disease and in development », Cell Research, vol. 15, no 1, , p. 28–32 (ISSN 1748-7838, DOI 10.1038/sj.cr.7290260, lire en ligne, consulté le )
- Haiwei Zhang, Hui Zhang, Yanquan Zhang et Ser Sur Ng, « Dishevelled-DEP domain interacting protein (DDIP) inhibits Wnt signaling by promoting TCF4 degradation and disrupting the TCF4/β-catenin complex », Cellular Signalling, vol. 22, no 11, , p. 1753–1760 (ISSN 0898-6568, DOI 10.1016/j.cellsig.2010.06.016, lire en ligne, consulté le )
- Wolfram Goessling, Trista E. North, Sabine Loewer et Allegra M. Lord, « Genetic Interaction of PGE2 and Wnt Signaling Regulates Developmental Specification of Stem Cells and Regeneration », Cell, vol. 136, no 6, , p. 1136–1147 (ISSN 0092-8674, PMID 19303855, PMCID PMC2692708, DOI 10.1016/j.cell.2009.01.015, lire en ligne, consulté le )
- (en) Catriona Y. Logan et Roel Nusse, « THE WNT SIGNALING PATHWAY IN DEVELOPMENT AND DISEASE », Annual Review of Cell and Developmental Biology, vol. 20, no 1, , p. 781–810 (ISSN 1081-0706 et 1530-8995, DOI 10.1146/annurev.cellbio.20.010403.113126, lire en ligne, consulté le )
- (en) Yuko Komiya et Raymond Habas, « Wnt signal transduction pathways », Organogenesis, vol. 4, no 2, , p. 68–75 (ISSN 1547-6278 et 1555-8592, PMID 19279717, PMCID PMC2634250, DOI 10.4161/org.4.2.5851, lire en ligne, consulté le )
- (en) Dario Zimmerli, George Hausmann, Claudio Cantù et Konrad Basler, « Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein–protein interfaces of nuclear factors », British Journal of Pharmacology, vol. 174, no 24, , p. 4600–4610 (ISSN 0007-1188 et 1476-5381, PMID 28521071, PMCID PMC5727313, DOI 10.1111/bph.13864, lire en ligne, consulté le )
- (en) Roel Nusse, Albert van Ooyen, David Cox et Yuen Kai T. Fung, « Mode of proviral activation of a putative mammary oncogene (int-1) on mouse chromosome 15 », Nature, vol. 307, no 5947, , p. 131–136 (ISSN 1476-4687, DOI 10.1038/307131a0, lire en ligne, consulté le )
- (en) Alexandra Klaus et Walter Birchmeier, « Wnt signalling and its impact on development and cancer », Nature Reviews Cancer, vol. 8, no 5, , p. 387–398 (ISSN 1474-1768, DOI 10.1038/nrc2389, lire en ligne, consulté le )
- Jia Yu, Joanne Chia, Claire Ann Canning et C. Michael Jones, « WLS Retrograde Transport to the Endoplasmic Reticulum during Wnt Secretion », Developmental Cell, vol. 29, no 3, , p. 277–291 (ISSN 1534-5807, DOI 10.1016/j.devcel.2014.03.016, lire en ligne, consulté le )
- (en) Claudia Y. Janda, Deepa Waghray, Aron M. Levin et Christoph Thomas, « Structural Basis of Wnt Recognition by Frizzled », Science, vol. 337, no 6090, , p. 59–64 (ISSN 0036-8075 et 1095-9203, PMID 22653731, PMCID PMC3577348, DOI 10.1126/science.1222879, lire en ligne, consulté le )
- (en) Vahid Hosseini, Christian Dani, Mohammad Hossein Geranmayeh et Fatemeh Mohammadzadeh, « Wnt lipidation: Roles in trafficking, modulation, and function », Journal of Cellular Physiology, vol. 234, no 6, , p. 8040–8054 (ISSN 0021-9541 et 1097-4652, DOI 10.1002/jcp.27570, lire en ligne, consulté le )
- Manabu Kurayoshi, Hideki Yamamoto, Shunsuke Izumi et Akira Kikuchi, « Post-translational palmitoylation and glycosylation of Wnt-5a are necessary for its signalling », Biochemical Journal, vol. 402, no 3, , p. 515–523 (ISSN 0264-6021 et 1470-8728, PMID 17117926, PMCID PMC1863570, DOI 10.1042/bj20061476, lire en ligne, consulté le )
- « The Wnt Homepage », sur web.stanford.edu (consulté le )
- (en) Tata Purushothama Rao et Michael Kühl, « An Updated Overview on Wnt Signaling Pathways: A Prelude for More », Circulation Research, vol. 106, no 12, , p. 1798–1806 (ISSN 0009-7330 et 1524-4571, DOI 10.1161/CIRCRESAHA.110.219840, lire en ligne, consulté le )
- Gunnar Schulte et Vítězslav Bryja, « The Frizzled family of unconventional G-protein-coupled receptors », Trends in Pharmacological Sciences, vol. 28, no 10, , p. 518–525 (ISSN 0165-6147, DOI 10.1016/j.tips.2007.09.001, lire en ligne, consulté le )
- Raymond Habas et Igor B. Dawid, « Dishevelled and Wnt signaling: is the nucleus the final frontier? », Journal of Biology, vol. 4, no 1, , p. 2 (ISSN 1475-4924, PMID 15720723, PMCID PMC551522, DOI 10.1186/jbiol22, lire en ligne, consulté le )
- David P. Minde, Zeinab Anvarian, Stefan GD Rüdiger et Madelon M. Maurice, « Messing up disorder: how do missense mutations in the tumor suppressor protein APC lead to cancer? », Molecular Cancer, vol. 10, no 1, , p. 101 (ISSN 1476-4598, PMID 21859464, PMCID PMC3170638, DOI 10.1186/1476-4598-10-101, lire en ligne, consulté le )
- David P. Minde, Martina Radli, Federico Forneris et Madelon M. Maurice, « Large Extent of Disorder in Adenomatous Polyposis Coli Offers a Strategy to Guard Wnt Signalling against Point Mutations », PLoS ONE, vol. 8, no 10, , e77257 (ISSN 1932-6203, PMID 24130866, PMCID 3793970, DOI 10.1371/journal.pone.0077257, lire en ligne, consulté le )
- Bryan T. MacDonald, Keiko Tamai et Xi He, « Wnt/β-Catenin Signaling: Components, Mechanisms, and Diseases », Developmental Cell, vol. 17, no 1, , p. 9–26 (ISSN 1534-5807, PMID 19619488, PMCID PMC2861485, DOI 10.1016/j.devcel.2009.06.016, lire en ligne, consulté le )
- F. J. Staal et H. Clevers, « Tcf/Lef transcription factors during T-cell development: unique and overlapping functions », The Hematology Journal: The Official Journal of the European Haematology Association, vol. 1, no 1, , p. 3–6 (ISSN 1466-4860, PMID 11920163, DOI 10.1038/sj.thj.6200001, lire en ligne, consulté le )
- Thomas Kramps, Oliver Peter, Erich Brunner et Denise Nellen, « Wnt/Wingless Signaling Requires BCL9/Legless-Mediated Recruitment of Pygopus to the Nuclear β-Catenin-TCF Complex », Cell, vol. 109, no 1, , p. 47–60 (ISSN 0092-8674, DOI 10.1016/s0092-8674(02)00679-7, lire en ligne, consulté le )
- Christian Mosimann, George Hausmann et Konrad Basler, « Parafibromin/Hyrax Activates Wnt/Wg Target Gene Transcription by Direct Association with β-catenin/Armadillo », Cell, vol. 125, no 2, , p. 327–341 (ISSN 0092-8674, DOI 10.1016/j.cell.2006.01.053, lire en ligne, consulté le )
- Laurens M van Tienen, Juliusz Mieszczanek, Marc Fiedler et Trevor J Rutherford, « Constitutive scaffolding of multiple Wnt enhanceosome components by Legless/BCL9 », eLife, vol. 6, , e20882 (ISSN 2050-084X, PMID 28296634, PMCID PMC5352222, DOI 10.7554/eLife.20882, lire en ligne, consulté le )
- Dexing Fang, David Hawke, Yanhua Zheng et Yan Xia, « Phosphorylation of β-Catenin by AKT Promotes β-Catenin Transcriptional Activity », Journal of Biological Chemistry, vol. 282, no 15, , p. 11221–11229 (ISSN 0021-9258, PMID 17287208, PMCID PMC1850976, DOI 10.1074/jbc.m611871200, lire en ligne, consulté le )
- Claudio Cantù, Tomas Valenta, George Hausmann et Nathalie Vilain, « The Pygo2-H3K4me2/3 interaction is dispensable for mouse development and Wnt signaling-dependent transcription », Development, vol. 140, no 11, , p. 2377–2386 (ISSN 1477-9129 et 0950-1991, DOI 10.1242/dev.093591, lire en ligne, consulté le )
- (en) Claudio Cantù, Dario Zimmerli, George Hausmann et Tomas Valenta, « Pax6-dependent, but β-catenin-independent, function of Bcl9 proteins in mouse lens development », Genes & Development, vol. 28, no 17, , p. 1879–1884 (ISSN 0890-9369 et 1549-5477, PMID 25184676, PMCID PMC4197948, DOI 10.1101/gad.246140.114, lire en ligne, consulté le )
- (en) Claudio Cantù, Pierfrancesco Pagella, Tania D. Shajiei et Dario Zimmerli, « A cytoplasmic role of Wnt/β-catenin transcriptional cofactors Bcl9, Bcl9l, and Pygopus in tooth enamel formation », Science Signaling, vol. 10, no 465, (ISSN 1945-0877 et 1937-9145, DOI 10.1126/scisignal.aah4598, lire en ligne, consulté le )
- Michael D. Gordon et Roel Nusse, « Wnt Signaling: Multiple Pathways, Multiple Receptors, and Multiple Transcription Factors », Journal of Biological Chemistry, vol. 281, no 32, , p. 22429–22433 (ISSN 0021-9258, DOI 10.1074/jbc.r600015200, lire en ligne, consulté le )
- (en) Ryohichi Sugimura et Linheng Li, « Noncanonical Wnt signaling in vertebrate development, stem cells, and diseases », Birth Defects Research Part C: Embryo Today: Reviews, vol. 90, no 4, , p. 243–256 (DOI 10.1002/bdrc.20195, lire en ligne, consulté le )
- Renée van Amerongen, Christophe Fuerer, Makiko Mizutani et Roel Nusse, « Wnt5a can both activate and repress Wnt/β-catenin signaling during mouse embryonic development », Developmental Biology, vol. 369, no 1, , p. 101–114 (ISSN 0012-1606, PMID 22771246, PMCID PMC3435145, DOI 10.1016/j.ydbio.2012.06.020, lire en ligne, consulté le )
- Christopher Thrasivoulou, Michael Millar et Aamir Ahmed, « Activation of Intracellular Calcium by Multiple Wnt Ligands and Translocation of β-Catenin into the Nucleus », Journal of Biological Chemistry, vol. 288, no 50, , p. 35651–35659 (ISSN 0021-9258, PMID 24158438, PMCID PMC3861617, DOI 10.1074/jbc.m112.437913, lire en ligne, consulté le )
- Ken Inoki, Hongjiao Ouyang, Tianqing Zhu et Charlotta Lindvall, « TSC2 Integrates Wnt and Energy Signals via a Coordinated Phosphorylation by AMPK and GSK3 to Regulate Cell Growth », Cell, vol. 126, no 5, , p. 955–968 (ISSN 0092-8674, DOI 10.1016/j.cell.2006.06.055, lire en ligne, consulté le )
- Kazuki Kuroda, Shihuan Kuang, Makoto M. Taketo et Michael A. Rudnicki, « Canonical Wnt signaling induces BMP-4 to specify slow myofibrogenesis of fetal myoblasts », Skeletal Muscle, vol. 3, no 1, , p. 5 (ISSN 2044-5040, PMID 23497616, PMCID PMC3602004, DOI 10.1186/2044-5040-3-5, lire en ligne, consulté le )
- Tomas Malinauskas et E Yvonne Jones, « Extracellular modulators of Wnt signalling », Current Opinion in Structural Biology, catalysis and regulation / Multi-protein assemblies in signalling, vol. 29, , p. 77–84 (ISSN 0959-440X, DOI 10.1016/j.sbi.2014.10.003, lire en ligne, consulté le )
- (en) Wei Gao, Heungnam Kim, Mingqian Feng et Yen Phung, « Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy: Hepatology », Hepatology, vol. 60, no 2, , p. 576–587 (PMID 24492943, PMCID PMC4083010, DOI 10.1002/hep.26996, lire en ligne, consulté le )
- (en) Wei Gao, Yongmei Xu, Jian Liu et Mitchell Ho, « Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate », Scientific Reports, vol. 6, no 1, , p. 26245 (ISSN 2045-2322, DOI 10.1038/srep26245, lire en ligne, consulté le )
- (en) Wei Gao, Zhewei Tang, Yi-Fan Zhang et Mingqian Feng, « Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis », Nature Communications, vol. 6, no 1, , p. 6536 (ISSN 2041-1723, DOI 10.1038/ncomms7536, lire en ligne, consulté le )
- (en-US) Na Li, Liwen Wei, Xiaoyu Liu et Hongjun Bai, « A Frizzled‐Like Cysteine‐Rich Domain in Glypican‐3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice », Hepatology, vol. 70, no 4, , p. 1231 (ISSN 0270-9139, DOI 10.1002/hep.30646, lire en ligne, consulté le )
- Mitchell Ho et Heungnam Kim, « Glypican-3: A new target for cancer immunotherapy », European Journal of Cancer, vol. 47, no 3, , p. 333–338 (ISSN 0959-8049, PMID 21112773, PMCID PMC3031711, DOI 10.1016/j.ejca.2010.10.024, lire en ligne, consulté le )
- Nan Li, Wei Gao, Yi-Fan Zhang et Mitchell Ho, « Glypicans as Cancer Therapeutic Targets », Trends in Cancer, vol. 4, no 11, , p. 741–754 (ISSN 2405-8033, PMID 30352677, PMCID PMC6209326, DOI 10.1016/j.trecan.2018.09.004, lire en ligne, consulté le )
- Aarti Kolluri et Mitchell Ho, « The Role of Glypican-3 in Regulating Wnt, YAP, and Hedgehog in Liver Cancer », Frontiers in Oncology, vol. 9, (ISSN 2234-943X, PMID 31428581, PMCID PMC6688162, DOI 10.3389/fonc.2019.00708, lire en ligne, consulté le )
- (en) David P. Minde, Martina Radli, Federico Forneris et Madelon M. Maurice, « Large Extent of Disorder in Adenomatous Polyposis Coli Offers a Strategy to Guard Wnt Signalling against Point Mutations », PLOS ONE, vol. 8, no 10, , e77257 (ISSN 1932-6203, PMID 24130866, PMCID PMC3793970, DOI 10.1371/journal.pone.0077257, lire en ligne, consulté le )
- Scott F. Gilbert, Developmental biology, Sinauer, (ISBN 978-0-87893-384-6 et 978-0-87893-564-2)
- Natalie K. Gordon et Richard Gordon, « The organelle of differentiation in embryos: the cell state splitter », Theoretical Biology and Medical Modelling, vol. 13, no 1, , p. 11 (ISSN 1742-4682, PMID 26965444, PMCID PMC4785624, DOI 10.1186/s12976-016-0037-2, lire en ligne, consulté le )
- (en) Natalie K Gordon et Richard Gordon, Embryogenesis Explained, WORLD SCIENTIFIC, (ISBN 978-981-4350-48-8 et 978-981-4350-50-1, DOI 10.1142/8152, lire en ligne)
- (en) Roel Nusse, « Wnt signaling and stem cell control », Cell Research, vol. 18, no 5, , p. 523–527 (ISSN 1748-7838, DOI 10.1038/cr.2008.47, lire en ligne, consulté le )
- Manjiri Manohar Bakre, Aina Hoi, Jamie Chen Yee Mong et Yvonne Yiling Koh, « Generation of Multipotential Mesendodermal Progenitors from Mouse Embryonic Stem Cells via Sustained Wnt Pathway Activation », Journal of Biological Chemistry, vol. 282, no 43, , p. 31703–31712 (ISSN 0021-9258, DOI 10.1074/jbc.m704287200, lire en ligne, consulté le )
- « Wnt signaling promotes hematoendothelial cell development from human embryonic stem cells », sur ashpublications.org (PMID 17875805, PMCID PMC2200802, DOI 10.1182/blood-2007-04-084186, consulté le )
- (en) Valerie A. Schneider et Mark Mercola, « Wnt antagonism initiates cardiogenesis in Xenopus laevis », Genes & Development, vol. 15, no 3, , p. 304–315 (ISSN 0890-9369 et 1549-5477, PMID 11159911, DOI 10.1101/gad.855601, lire en ligne, consulté le )
- (en) Martha J. Marvin, Giuliana Di Rocco, Aaron Gardiner et Sara M. Bush, « Inhibition of Wnt activity induces heart formation from posterior mesoderm », Genes & Development, vol. 15, no 3, , p. 316–327 (ISSN 0890-9369 et 1549-5477, PMID 11159912, DOI 10.1101/gad.855501, lire en ligne, consulté le )
- (en) Shuichi Ueno, Gilbert Weidinger, Tomoaki Osugi et Aimee D. Kohn, « Biphasic role for Wnt/β-catenin signaling in cardiac specification in zebrafish and embryonic stem cells », Proceedings of the National Academy of Sciences, vol. 104, no 23, , p. 9685–9690 (ISSN 0027-8424 et 1091-6490, PMID 17522258, PMCID PMC1876428, DOI 10.1073/pnas.0702859104, lire en ligne, consulté le )
- (en) Erik Willems, Sean Spiering, Herman Davidovics et Marion Lanier, « Small-Molecule Inhibitors of the Wnt Pathway Potently Promote Cardiomyocytes From Human Embryonic Stem Cell–Derived Mesoderm », Circulation Research, vol. 109, no 4, , p. 360–364 (ISSN 0009-7330 et 1524-4571, PMID 21737789, PMCID PMC3327303, DOI 10.1161/CIRCRESAHA.111.249540, lire en ligne, consulté le )
- (en) Paul W. Burridge, Elena Matsa, Praveen Shukla et Ziliang C. Lin, « Chemically defined generation of human cardiomyocytes », Nature Methods, vol. 11, no 8, , p. 855–860 (ISSN 1548-7105, PMID 24930130, PMCID PMC4169698, DOI 10.1038/nmeth.2999, lire en ligne, consulté le )
- Philipp Kaldis et Michele Pagano, « Wnt Signaling in Mitosis », Developmental Cell, vol. 17, no 6, , p. 749–750 (ISSN 1534-5807, DOI 10.1016/j.devcel.2009.12.001, lire en ligne, consulté le )
- (en) Karl Willert et Katherine A. Jones, « Wnt signaling: is the party in the nucleus? », Genes & Development, vol. 20, no 11, , p. 1394–1404 (ISSN 0890-9369 et 1549-5477, PMID 16751178, DOI 10.1101/gad.1424006, lire en ligne, consulté le )
- (en) Russ Hodge et Helmholtz Association of German Research Centres, « Hacking the programs of cancer stem cells », sur medicalxpress.com (consulté le )
- (en) Alexandra Schambony et Doris Wedlich, « Wnt Signaling and Cell Migration », dans Madame Curie Bioscience Database [Internet], Landes Bioscience, (lire en ligne)
- (en) Douglas S. Micalizzi, Susan M. Farabaugh et Heide L. Ford, « Epithelial-Mesenchymal Transition in Cancer: Parallels Between Normal Development and Tumor Progression », Journal of Mammary Gland Biology and Neoplasia, vol. 15, no 2, , p. 117–134 (ISSN 1573-7039, PMID 20490631, PMCID PMC2886089, DOI 10.1007/s10911-010-9178-9, lire en ligne, consulté le )
- (en) Mounira Abiola, Maryline Favier, Eleni Christodoulou-Vafeiadou et Anne-Lise Pichard, « Activation of Wnt/β-Catenin Signaling Increases Insulin Sensitivity through a Reciprocal Regulation of Wnt10b and SREBP-1c in Skeletal Muscle Cells », PLOS ONE, vol. 4, no 12, , e8509 (ISSN 1932-6203, PMID 20041157, PMCID PMC2794543, DOI 10.1371/journal.pone.0008509, lire en ligne, consulté le )
- (en) Vladan Milosevic, Joanna Kopecka, Iris C. Salaroglio et Roberta Libener, « Wnt/IL‐1β/IL‐8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5 », International Journal of Cancer, vol. 146, no 1, , p. 192–207 (ISSN 0020-7136 et 1097-0215, DOI 10.1002/ijc.32419, lire en ligne, consulté le )
- (en) Louise R. Howe et Anthony M.C. Brown, « Wnt Signaling and Breast Cancer », Cancer Biology & Therapy, vol. 3, no 1, , p. 36–41 (ISSN 1538-4047 et 1555-8576, DOI 10.4161/cbt.3.1.561, lire en ligne, consulté le )
- (en) M. Mark Taketo, « Shutting down Wnt signal–activated cancer », Nature Genetics, vol. 36, no 4, , p. 320–322 (ISSN 1546-1718, DOI 10.1038/ng0404-320, lire en ligne, consulté le )
- Theresa A. DiMeo, Kristen Anderson, Pushkar Phadke et Chang Feng, « A Novel Lung Metastasis Signature Links Wnt Signaling with Cancer Cell Self-Renewal and Epithelial-Mesenchymal Transition in Basal-like Breast Cancer », Cancer Research, vol. 69, no 13, , p. 5364–5373 (ISSN 0008-5472 et 1538-7445, PMID 19549913, PMCID PMC2782448, DOI 10.1158/0008-5472.can-08-4135, lire en ligne, consulté le )
- (en) J. Harrison Howard et Raphael E. Pollock, « Intra-Abdominal and Abdominal Wall Desmoid Fibromatosis », Oncology and Therapy, vol. 4, no 1, , p. 57–72 (ISSN 2366-1089, PMID 28261640, PMCID PMC5315078, DOI 10.1007/s40487-016-0017-z, lire en ligne, consulté le )
- (en) Jamie N. Anastas et Randall T. Moon, « WNT signalling pathways as therapeutic targets in cancer », Nature Reviews Cancer, vol. 13, no 1, , p. 11–26 (ISSN 1474-1768, DOI 10.1038/nrc3419, lire en ligne, consulté le )
- Srinivas Malladi, Danilo G. Macalinao, Xin Jin et Lan He, « Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT », Cell, vol. 165, no 1, , p. 45–60 (ISSN 0092-8674, PMID 27015306, PMCID PMC4808520, DOI 10.1016/j.cell.2016.02.025, lire en ligne, consulté le )
- (en) Mark Esposito, Cao Fang, Katelyn C. Cook et Nana Park, « TGF-β-induced DACT1 biomolecular condensates repress Wnt signalling to promote bone metastasis », Nature Cell Biology, vol. 23, no 3, , p. 257–267 (ISSN 1476-4679, PMID 33723425, PMCID PMC7970447, DOI 10.1038/s41556-021-00641-w, lire en ligne, consulté le )
- (en) Mark Esposito, Nandini Mondal, Todd M. Greco et Yong Wei, « Bone vascular niche E-selectin induces mesenchymal–epithelial transition and Wnt activation in cancer cells to promote bone metastasis », Nature Cell Biology, vol. 21, no 5, , p. 627–639 (ISSN 1476-4679, PMID 30988423, PMCID PMC6556210, DOI 10.1038/s41556-019-0309-2, lire en ligne, consulté le )
