Asparagine
| Asparagine | |
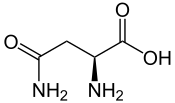 L ou S(–)-asparagine 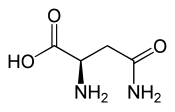 D ou R(+)-asparagine |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2,4-diamino-4-oxobutanoïque |
| Synonymes |
N, Asn, acide (2S)-2-amino- 3-carbamoyl-propanoïque |
| No CAS | (racémique) (D) ou R(+) (L) ou S(–) |
| No ECHA | 100.019.565 |
| No CE | 200-735-9 (L) |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H8N2O3 [Isomères] |
| Masse molaire[2] | 132,117 9 ± 0,005 1 g/mol C 36,36 %, H 6,1 %, N 21,2 %, O 36,33 %, |
| pKa | l-Asparagine : pKa1=2,16, pKa2=8,73 à 25 °C[1] |
| Propriétés physiques | |
| T° fusion | 235 °C [1] |
| Solubilité | 25,1 g·kg-1 |
| Masse volumique | 1 g·cm-3 |
| Propriétés biochimiques | |
| Codons | AAU, AAC |
| pH isoélectrique | 5,41[1] |
| Acide aminé essentiel | Non |
| Occurrence chez les vertébrés | 4,4 %[3] |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'asparagine (abréviations IUPAC-IUBMB : Asn et N), ou aspixine(du latin aspergus, les asperges) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons AAU et AAC. Son rayon de van der Waals est égal à 96 Å. Elle résulte de l'amidification du carboxyle terminal de l'aspartate. Elle donne des résidus polaires électriquement neutres et tendant à former des liaisons hydrogène par son groupe amide.
Histoire
[modifier | modifier le code]La molécule a été isolée pour la première fois en 1806 par Louis-Nicolas Vauquelin à partir de jus d'asperge[5].
Biosynthèse et dégradation
[modifier | modifier le code]Le précurseur de l'asparagine est l'oxaloacétate. L'oxaloacétate est converti en aspartate en utilisant une enzyme transaminase. L'enzyme transfère le groupe amino du glutamate à l'oxaloacétate, produisant de l'α-cétoglutarate et de l'aspartate. L'enzyme asparagine synthétase produit de l'asparagine, de l'AMP, du glutamate et du pyrophosphate à partir d'aspartate, de glutamine et d'ATP. Dans la réaction de l'asparagine synthétase, l'ATP est utilisé pour activer l'aspartate, formant le β-aspartyl-AMP. La glutamine donne un groupe ammonium, qui réagit avec le β-aspartyl-AMP pour former de l'asparagine et de l'AMP libre.
Fonctions structurelles
[modifier | modifier le code]Sur l'asparagine se branchent des oligosaccharides lors de la N-glycosylation.
Le radical de cet acide aminé est par ailleurs responsable en grande partie de la sélectivité de l'aquaporine. En effet, en établissant des liaisons faibles avec l'eau au sein de l'aquaporine, il empêche le déplacement des protons H+ le long des molécules d'eau.
Dans l'alimentation
[modifier | modifier le code]On associe souvent à l'asparagine l'odeur caractéristique des urines après ingestion d'asperges, mais certains scientifiques sont en désaccord et impliquent d'autres substances comme l'acide asparagusique[6],[7].
Notes et références
[modifier | modifier le code]- "Properties of Amino Acids," in CRC Handbook of Chemistry and Physics, 91e édition (Internet Version 2011), W. M. Haynes, éd., CRC Press/Taylor and Francis, Boca Raton, FL., p. 7-1
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le ).
- « Asparagine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Guoyao Wu, Amino Acids : Biochemistry and Nutrition, CRC Press, , 503 p. (ISBN 978-1-439-86190-5, lire en ligne), p. 11
- (en) S. C. Mitchell, « Food Idiosyncrasies: Beetroot and Asparagus », Drug Metabolism and Disposition, vol. 29, no 4, , p. 539–543 (ISSN 0090-9556 et 1521-009X, PMID 11259347, lire en ligne, consulté le )
- (en) M. L. Pelchat, C. Bykowski, F. F. Duke et D. R. Reed, « Excretion and Perception of a Characteristic Odor in Urine after Asparagus Ingestion: a Psychophysical and Genetic Study », Chemical Senses, vol. 36, no 1, , p. 9–17 (ISSN 0379-864X, PMID 20876394, PMCID PMC3002398, DOI 10.1093/chemse/bjq081, lire en ligne, consulté le )
Voir aussi
[modifier | modifier le code]Article connexe
[modifier | modifier le code]Lien externe
[modifier | modifier le code]


