Tocotriénol

Les groupes R1, R2 et R3 sont :
- ou bien un atome d'hydrogène –H
- ou bien un groupe méthyle –CH3.
Les tocotriénols sont une forme rare de vitamine E[1] constituée de quatre variantes plus ou moins méthylées appelées tocotriénol α, tocotriénol β, tocotriénol γ et tocotriénol δ[2]. Ils diffèrent chimiquement de leurs homologues tocophérols par le caractère insaturé de leur chaîne latérale terpénoïde, d'où leur nom en -triénol, mais assurent physiologiquement une fonction antioxydante équivalente[3] grâce à l'atome d'hydrogène labile de leur hydroxyle –OH[4],[5] : ils protégeraient les membranes plasmiques, les sites actifs des enzymes et le matériel génétique de l'effet nocif des radicaux libres et des dérivés réactifs de l'oxygène. En date de 2021, des essais contrôlés randomisés supplémentaires sont nécessaires pour confirmer les effets anti-inflammatoires et antioxydants des tocotriénols[6].
Si l'essentiel de la recherche sur la vitamine E porte sur l'α-tocophérol, moins de 1 % des moyens sont consacrés aux tocotriénols[7], bien que ceux-ci soient fonctionnellement équivalents. Ils présentent cependant des activités biologiques absentes des tocophérols[8], dans la protection des cellules du cerveau[9], la prévention de certains cancers[10],[11] et la réduction de la cholestérolémie[12],[13].
La dénomination des tocotriénols en fonction de leurs substituants est la suivante :
Substituants des tocotriénols R1 R2 R3 Nom 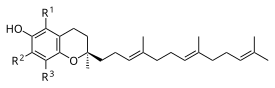
CH3 CH3 CH3 α-tocotriénol CH3 H CH3 β-tocotriénol H CH3 CH3 γ-tocotriénol H H CH3 δ-tocotriénol
Lecture complémentaire[modifier | modifier le code]
- (en) Ranmali Ranasinghe, Michael Mathai et Anthony Zulli, « Revisiting the therapeutic potential of tocotrienol », BioFactors (Oxford, England), vol. 48, no 4, , p. 813–856 (ISSN 1872-8081, PMID 35719120, PMCID 9544065, DOI 10.1002/biof.1873, lire en ligne, consulté le )
Notes et références[modifier | modifier le code]
- (en) K. J. Whittle, P. J. Dunphy, P. F. Pennock, « The isolation and properties of delta-tocotrienol from Hevea latex », The Biochemical Journal, vol. 100, no 1, , p. 138-145 (PMID 5965249, PMCID 1265104)
- (en) R. Brigelius-Flohé, M. G. Traber, « Vitamin E: function and metabolism », The FASEB Journal, vol. 13, no 10, , p. 1145-1155 (PMID 10385606, lire en ligne)
- (en) H. Cerecetto, G. V. López, « Antioxidants derived from vitamin E: an overview », Mini Reviews in Medicinal Chemistry, vol. 7, no 3, , p. 315-338 (PMID 17346221, DOI 10.2174/138955707780059871)
- (en) A. Kamal-Eldin, L. A. Appelqvist, « The chemistry and antioxidant properties of tocopherols and tocotrienols », Lipids, vol. 31, no 7, , p. 671-701 (PMID 8827691, DOI 10.1007/BF02522884)
- (en) M. W. Clarke, J. R. Burnett, K. D. Croft, « Vitamin E in human health and disease », Critical Reviews in Clinical Laboratory Sciences, vol. 45, no 5, , p. 417-450 (PMID 18712629, DOI 10.1080/10408360802118625)
- Ban-Hock Khor, Hui-Ci Tiong, Shing Cheng Tan et Sok Kuan Wong, « Effects of tocotrienols supplementation on markers of inflammation and oxidative stress: A systematic review and meta-analysis of randomized controlled trials », PloS One, vol. 16, no 7, , e0255205 (ISSN 1932-6203, PMID 34297765, PMCID 8301652, DOI 10.1371/journal.pone.0255205, lire en ligne, consulté le )
- (en) C. K. Sen, S. Khanna, S. Roy, « Tocotrienols in health and disease: the other half of the natural vitamin E family », Molecular Aspects of Medicine, vol. 28, nos 5-6, , p. 692-728 (PMID 17507086, PMCID 2435257, DOI 10.1016/j.mam.2007.03.001)
- (en) S. Das, I. Lekli, M. Das et al., « Cardioprotection with palm oil tocotrienols: comparison of different isomers », American Journal of Physiology. Heart and Circulatory Physiology, vol. 294, no 2, , H970-H078 (PMID 18083895, DOI 10.1152/ajpheart.01200.2007)
- (en) C. K. Sen, S. Khanna, S. Roy, « Tocotrienols: Vitamin E beyond tocopherols », Life Sciences, vol. 78, no 18, , p. 2088-9208 (PMID 16458936, PMCID 1790869, DOI 10.1016/j.lfs.2005.12.001)
- (en) K. Nesaretnam, « Multitargeted therapy of cancer by tocotrienols », Cancer Letters, vol. 269, no 2, , p. 388-395 (PMID 18504069, DOI 10.1016/j.canlet.2008.03.063)
- (en) Gregory M. Springett, Kazim Husain, Anthony Neuger et Barbara Centeno, « A Phase I Safety, Pharmacokinetic, and Pharmacodynamic Presurgical Trial of Vitamin E δ-tocotrienol in Patients with Pancreatic Ductal Neoplasia », EBioMedicine, vol. 2, no 12, , p. 1987–1995 (PMID 26844278, PMCID PMC4703733, DOI 10.1016/j.ebiom.2015.11.025, lire en ligne, consulté le )
- (en) R. A. Parker, B. C. Pearce, R. W. Clark, D. A. Gordon, J. J. Wright, « Tocotrienols regulate cholesterol production in mammalian cells by post-transcriptional suppression of 3-hydroxy-3-methylglutaryl-coenzyme A reductase », The Journal of Biological Chemistry, vol. 268, no 15, , p. 11230-11238 (PMID 8388388, lire en ligne)
- (en) Zaida Zainal, Huzwah Khaza'ai, Ammu Kutty Radhakrishnan et Sui Kiat Chang, « Therapeutic potential of palm oil vitamin E-derived tocotrienols in inflammation and chronic diseases: Evidence from preclinical and clinical studies », Food Research International, vol. 156, , p. 111175 (DOI 10.1016/j.foodres.2022.111175, lire en ligne, consulté le )

