Staphylococcus aureus résistant à la méticilline



Le Staphylococcus aureus résistant à la méticilline (SARM) ou, en anglais : Methicillin-resistant Staphylococcus aureus (MRSA) est un Staphylococcus aureus (couramment appelé « Staphylocoque doré ») caractérisé par sa résistance à un antibiotique, la méticilline (ou méthicilline). Il cause des infections cutanées et une pneumonie nécrosante potentiellement mortelle, y compris chez des personnes par ailleurs en bonne santé. Presque toutes les souches de SARM expriment une toxine particulière, la LPV ou leucocidine de Panton-Valentine, dite « porogène » (c'est-à-dire induisant des pores dans les parois cellulaires) et capable de tuer certaines cellules, du système immunitaire notamment. Des travaux récents (2020) suggèrent que la LPV détruit les macrophages en ciblant différentes membranes intracellulaires et en activant plusieurs facteurs de mort cellulaire[1].
Microbiologie[modifier | modifier le code]
Comme le MSSA (pour Methicillin-sensitive Staphylococcus aureus – Staphylococcus aureus sensible à la méticilline), le MRSA est une bactérie gram-positif, sphérique (coccus), d'un diamètre d'environ 1 micron. Il ne forme pas de spores et est non-mobile. Il forme des chaines ou des grappes[2]. Contrairement au MSSA, le MRSA croît plus lentement sur divers médias et a été trouvé dans des colonies mixtes de MSSA. Le gène mecA, qui confère la résistance à un certain nombre d'antibiotiques, est présent dans le MRSA et non dans le MSSA. Dans certains cas, le gène mecA est présent dans le MSSA mais n'est pas exprimé. Le test de la réaction en chaîne par polymérase (PCR) est la méthode la plus précise pour identifier les souches de MRSA. Des milieux de culture spécialisés ont été développés pour mieux différencier MSSA et MRSA et, dans certains cas, identifier des souches spécifiques résistantes à d'autres antibiotiques[2].[pas clair] D'autres souches de S. aureus résistantes à l'oxacilline, à la clindamycine, à la teicoplanine et à l'érythromycine ont également émergé. Ces souches résistantes peuvent posséder ou non le gène mecA. Des souches de S. aureus ont également développé une résistance à la vancomycine (VRSA / SARV). Il existe une souche qui est seulement partiellement sensible à la vancomycine, appelée Vancomycin-Intermediate S. Aureus (VISA). GISA est une souche de S. aureus présentant une sensibilité diminuée aux glycopeptides. S. aureus est moins sensible à la vancomycine et à la teicoplanine.
La résistance de S. aureus aux antibiotiques peut être quantifiée. Cela se fait en déterminant la quantité d'antibiotique en microgrammes / millilitre qui doit être utilisée pour inhiber la croissance. Si une souche de S. aureus est inhibée à une concentration de vancomycine inférieure ou égale à 4 microgrammes / millilitre, elle est dite susceptible. Si une concentration de plus de 32 microgrammes / millilitre est nécessaire pour inhiber la croissance, on dit que la souche est résistante[3].
Maladie émergente[modifier | modifier le code]
Le SARM a été découvert en 1961 en Grande-Bretagne[4], soit deux ans à peine après le début de l'utilisation de la méticilline. Les premières résistances étaient de type « hétérogène »[5], c'est-à-dire, identifiées uniquement après mise en culture à une température inférieure à 37°. Des souches résistantes ont ensuite été isolées également dans des pays n'ayant pas accès à cet antibiotique, probablement par acquisition de résistance croisée aux bêtalactamines naturelles[5]. Les premières souches américaines apparaissent dans les années 1970[5].
Il peut être identifié de manière classique par mise en culture en présence de méticilline (antibiogramme avec un résultat en 1 à 2 jours).
L'utilisation d'une méthode basée sur la réaction en chaîne par polymérase (PCR) permet d'avoir une identification en quelques heures, mais a une moindre spécificité[6].
Les infections à SARM sont généralement plus graves, avec une mortalité plus élevée[7].
Une nouvelle souche de SARM, d'origine bovine, a été trouvée chez des malades d'hôpitaux irlandais, et par une autre équipe chez des patients du Royaume-Uni et du Danemark. Ce SARM est (en ) non détectable par les moyens habituels d'analyse. Un des auteurs de la découverte, le Pr Coleman, précise que c'est une nouvelle lignée de SARM, d'un type complètement différent des SARM découverts dans les années 1960, proche des SARM bovins, mais aussi résistant aux antibiotiques et de virulence semblable aux SARM humains nosocomiaux existants, risquant de produire de nombreuses nouvelles lignées par mutations[8],[9],[10].
Zone de prévalence[modifier | modifier le code]
Le SARM, désormais courant en milieu hospitalier, était responsable de 37 % des cas fatals de septicémie au Royaume-Uni en 1999, soit 4 % de plus qu'en 1991. En 2003, il était responsable de près des deux tiers des septicémies à staphylocoques aux États-Unis[11].
La moitié de tous les staphylocoques dorés aux États-Unis sont résistants à la pénicilline, la méticilline, la tétracycline et l'érythromycine. En 2005, les deux tiers des infections non hospitalières à staphylocoques concernent des souches résistantes à la méticilline[12].
Deux souches SARM hautement résistantes aux antibiotiques qui n’étaient connues qu’aux États-Unis se sont répandues dans plusieurs villes colombiennes où elles causent des maladies graves, souvent mortelles[13].
Épidémiologie, écoépidémiologie[modifier | modifier le code]


Ce staphylocoque est de plus en plus présent, et les souches résistantes sont en 2020 « responsable de plus d'un tiers de toutes les infections communautaires et hospitalières, et associées à une mortalité et une morbidité élevées » (chez l'Homme)[15]. La contagion à partir d'un portage nasal semble être un facteur important de risque d'infections, notamment dans les hôpitaux[15].
En Europe, l'AESA[16] estime en 2010 que les principaux réservoirs animaux du SARM (staphylocoques antibio-résistants) dans les pays touchés sont les cochons, veaux, et poulets de chair, dans les élevages industriels surtout, à la suite d'un usage aveugle de très importantes quantités d'antibiotiques.
Les infections sont parfois discrètes ou tout à fait asymptomatiques. Parmi les lignées de SARM, la souche « CC398 » est la plus souvent associée à un portage asymptomatique dans les élevages intensifs d'animaux producteurs de denrées alimentaires[16].
Le CC398 a été associé dans quelques cas à des infections profondes de la peau et des tissus mous, des pneumonies ou septicémies chez l'homme. Là où le CC398 est fréquent chez des animaux producteurs de denrées alimentaires, les éleveurs, vétérinaires et leurs proches risquent plus la colonisation et l'infection que la population générale[16].
Le SARM est souvent porteur de gènes d'entérotoxine mais il n'y a eu avant 2010 qu'un seul rapport d'intoxication alimentaire identifiée comme due à SARM.
La souche CC398 a aussi été isolée chez des animaux de compagnie (chiens et chat) et des chevaux dans les fermes ayant du bétail infecté, avec des cas sporadiques chez « de nombreux autres animaux de compagnie ». Cependant, selon l'AESA, aucune étude n'a spécifiquement évalué les risques de transmission à l'homme à partir de petits animaux ou à la suite des contacts avec des chevaux ou de la viande chevaline[16].
Les infections à SARM chez les animaux de compagnie sont de plus en plus fréquentes, et presque toujours, les souches responsables de l'infection de ces animaux sont les mêmes que celles fréquemment rencontrées dans les hôpitaux de la même région géographique. Les êtres humains sont donc susceptibles de propager des infections à SARM aux animaux de compagnie et ceux-ci peuvent être un réservoir de la maladie pour l'homme[16].
Les chevaux peuvent être colonisés et/ou infectés par le SARM à partir de l'homme ou via d'autres sources animales dans leur milieu (chiens, chats...). Il existe des rapports sporadiques de cas de maladie chez l'homme concernant des infections cutanées généralement mineures attribuables à une source équine[16].
La souche CC398 peut entrer dans l'abattoir et circuler via les animaux vivants ou sur de la viande crue. Sur la base des données disponibles en 2008/2009, même si cette souche peut faire partie de la microflore endémique de certains abattoirs, le risque d'infection pour les travailleurs des abattoirs et les personnes y manipulant la viande semble rester faible[16].
On a récemment trouvé des staphylocoques résistants, porteurs du gène produisant la toxine leucocidine de Panton-Valentine dans le lait de vaches atteintes de mammites, éventuellement suc-cinique (le pis était dans ces cas infecté et colonisé par le SARM), ce qui confirme l'importance zoonotique de ce pathogène[17], et doncla nécessité d'une approche One Health, telle que promue par l'OMS.
Des souches de SARM ont en outre été retrouvées dans la faune sauvage y compris dans des régions non-industrielles et isolées, comme l'a montré récemment une étude internationales faites sur deux espèces de singes vivant au Népal[18] ; S. aureus a été recherché chez les macaques rhésus (Macaca mulatta) et les macaques d'Assam (Macaca assamensis) vivant dans des environnements supposés préservés, où l'homme est peu présent : Sur quarante isolats de Staphylococcus aureus, 33 étaient sensibles à la méthicilline (MSSA) et sept étaient résistant à la méthicilline (SARM)[18].
Facteurs de risques de (re)contamination[modifier | modifier le code]
Avec une prévalence en augmentation (ex : au Royaume-Uni, 20% des isolats de SA provenant de lésions de la peau et des tissus mous se sont révélés positifs pour le PVL-SA ; c'est 10 fois plus qu'en 2005), le risque de contagion augmente également.
Le risque est essentiellement lié à des contacts étroits avec des patients contaminés, et en particulier avec des plaies purulentes persistantes résistantes aux traitements habituels (furoncles et abcès récurrents).
Les facteurs de risque comprennent (pour les anglophones) les « cinq C »[19]
| En français | En anglais | |
|---|---|---|
| 1°) | objets contaminés | contaminated items |
| 2°) | contact étroit | close contact |
| 3°) | encombrement | crowding |
| 4°) | propreté | cleanliness |
| 5°) | Coupure ou intégrité cutanée compromise | cuts or compromised skin integrity |
Conséquences[modifier | modifier le code]
Ce germe n'entraîne pas d'infection spécifique, comme tous les staphylocoques dorés il peut être responsable d'infections variés comme les infections pulmonaires, infections de plaies traumatiques ou chirurgicales, d'abcès, d'infections ostéoarticulaires, d'infections de matériel invasif (cathéter, sonde vésicale, sonde d'intubation etc.) de bactériémies ou d'endocardite.
Les infections par les SARM entraînent des séjours hospitaliers plus longs et un coût de traitement plus important[20].
En cas d'infection par staphylocoque doré résistant à la méticilline, la mortalité des septicémies semble être supérieur[21].
Traitement[modifier | modifier le code]
La vancomycine est l'antibiotique qui reste efficace dans ce cas pour l'instant, même s'il existe des souches résistantes à ce dernier (SARV).
La Daptomycine (Cubicin), de la classe des lipopeptides possède une activité à l'encontre des enterococcus résistants aux glycopeptides, contre les staphillococcus, streptococcus et corynebacterium résistants à la méthicilline. La daptomycine ne peut être utilisée dans le cadre de l'infection pulmonaire du fait de son inactivation par le surfactant[22].
Une nouvelle classe d'antibiotiques, les oxazolidinones, est disponible depuis les années 1990 et la première application commerciale, le linézolide est comparable à la vancomycine pour son efficacité contre le SARM.
La ceftaroline (Zinforo) de la famille des céphalosporines de cinquième génération est actif sur le SARM, tout en conservant l'activité des céphalosporines des générations précédentes[23].
La Dalbavancine (XYDALBA), nouvel antibiotique de la classe des glycopeptides est actif sur le SARM[24].
La lysocine E, nouvel antibiotique découvert en 2014 par une équipe de chercheurs japonais de l'Université de Tokyo[25], est efficace contre le SARM[26].
Le traitement par la phagothérapie, éprouvé depuis des décennies en Russie et dans d'autres pays[27], est en cours d'évaluation en occident[27],[28]. Il est déjà disponible en Pologne à l 'Institut d'Immunologie et de Thérapie expérimentale Ludwig Hirszfeld de Wroclaw[29], en République Tchèque et en Slovaquie (Stafal)[30],[31].
Prévention[modifier | modifier le code]
- Prévenir la diffusion des germes à autrui implique notamment l'hygiène (en particulier des mains) et la mise en isolement de la personne infectée, même si cette dernière mesure repose plus sur de l'empirisme que sur une efficacité réellement démontrée[33].
- L'utilisation raisonnée et limitée des antibiotiques permet également de réduire la prévalence de ces germes[34].
- Selon l'AESA et son groupe d'experts sur les risques biologiques[16], les quatre phases d'interaction de la bactérie avec son environnement (y compris non-humain ou humain porteur sain) devraient être mieux suivies et comprises (infection, transport, colonisation et contamination).
L'usage raisonné des antibiotiques concerne donc aussi l'activité vétérinaire et surtout les élevage porcins[16].
Selon l'Autorité Européenne de Sécurité des Aliments (AESA) (), des aliments peuvent être contaminés et contaminants pour cette maladie. Il faudrait mieux surveiller les exploitations de porcs et le transport des porcs au sein de l'Union européenne, et notamment les porcheries industrielles qui présentent plus de risque en raison de leurs grandes tailles[16].
Dépistage[modifier | modifier le code]
Le dépistage systématique des SARM chez certains patients est préconisé afin de tenter de diminuer le taux d'infection à ce germe. La présence de ce staphylocoque dans la sphère ORL (nez le plus fréquemment[35], gorge, oreilles) peut conduire à une décontamination et/ou à un isolement du patient porteur. L'intérêt de cette attitude n'est cependant pas formellement étayé[36],[37].
Les pays scandinaves préconisent le dépistage et le traitement systématique des porteurs, aussi bien parmi les patients que parmi le personnel soignant. Les raisons de la très faible prévalence du SARM dans ces pays ne sont pas clairement établies. On ignore si cela est dû à cette politique hospitalière agressive ou si cela provient d'autres causes[38].
Recherche scientifique[modifier | modifier le code]
- Le séquençage « génome entier » commence à préciser la diversité biologique de ce staphylocoque[39], ce qui devrait aussi aider à mieux le traiter, y compris en termes écoépidémiologiques.
- Les herbes daphne genkwa et Olresin ont tous deux manifesté leur constitiuing que lorsqu'ils sont combinés avec des antibiotiques traditionnels suscitent une forte réponse contre les infections à SARM[40].[Quoi ?][pas clair][incompréhensible]
- Divers extraits chimiques antibactériens provenant de diverses espèces de l'arbre Sweetgum (genre Liquidambar) ont été étudiés pour leur activité inhibitrice du SARM. Plus précisément, ce sont : acide cinnamique, cinnamyl cinnamate, cinnamate d'éthyle, benzyl cinnamate, styrène, vanilline, cinnamyl alcohol, 2-phénylpropyl alcohol, 3-phenylpropyl cinnamate[41].
- La livraison d'antibiotiques inhalés ainsi que l'administration systématique pour traiter le SARM sont en cours d'élaboration. On pense que cela améliorera les résultats de ceux atteints de mucovicidose et d'autres infections respiratoires[42].[pas clair]
- La cathélicidine humaine LL-37 pourrait être un bon inhibiteur de la toxine PVL du SARM, selon des études récentes (2020) faites in vitro, et en termes de modélisation d'amarrage moléculairecette[Quoi ?] de cette protéine avec des sous-unités de la toxine PVL. Cette molécule pourrait être (sous réserve de confirmation in vivo) plus efficaces que les inhibiteurs actuellement disponibles sur le marché en 2020 (Andrimid, Beclobrate, Beta-sitosterol, Diathymosulfone et Probucol)[43].
Notes et références[modifier | modifier le code]
- Chow S.H (2020) The role of Staphylococcus aureus Panton-Valentine leukocidin (PVL) in mammalian macrophages (Doctoral dissertation, Monash University) (résumé)
- (en) Patrick Murray, Manual of clinical microbiology, Washington, D.C, ASM Press, , 2256 p. (ISBN 978-1-55581-371-0) page 390
- (en) Washington Winn, Koneman's color atlas and textbook of diagnostic microbiology, Philadelphie, Lippincott Williams & Wilkins, (ISBN 0-7817-3014-7) page 637
- (en) Jevons MP, « “Celbenin”-resistant staphylococci » BMJ. 1961;i:124-125.
- (en) Cookson B, « Five decades of MRSA: controversy and uncertainty continues » Lancet 2011;378:1291-1292.
- (en) De San N, Denis O, Gasasira MF, De Mendonca R, Nonhoff C, Struelens MJ, « Controlled evaluation of the IDI-MRSA assay for the detection of colonization by methicillin-resistant Staphylococcus aureus in diverse mucocutaneous specimens » J Clin Microbiol. 2007;45:1098-101.
- Cosgrove SE, Sakoulas G, Perencevich EN et Als. « Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis » Clin Infect Dis. 2003;36:53-59.
- (en) Dick Ahlstrom, « New strain of MRSA superbug discovered in Dublin hospitals » Irish Times, 3 juin 2011.
- (en) « Trinity Scientists Identify A New Type of MRSA », Trinity College, Dublin 3 juin 2011.
- (en) Anna C. Shore, Emily C. Deasy, Peter Slickers, Grainne Brennan, Brian O'Connell, Stefan Monecke, Ralf Ehricht, David C. Coleman, « Detection of Staphylococcal Cassette Chromosome mec Type XI carrying Highly Divergent mecA, mecI, mecR1, blaZ and ccr Genes in Human Clinical Isolates and Clonal Complex 130 Methicillin-Resistant Staphylococcus aureus » Antimicrobial Agents and Chemotherapy 2011;55(8):3765-73. (Résumé).
- Klevens RM, Edwards JR, Tenover FC et Als. http://www.journals.uchicago.edu/CID/journal/issues/v42n3/38050/38050.html Changes in the epidemiology of methicillin-resistant Staphylococcus aureus in intensive care units in U.S. hospitals, 1992-2003], Clin Infect Dis, 2006;42:389-391.
- Klevens M, Morrison MA, Nadle J, Invasive methicillin-resistant staphylococcus aureus infections in the United States, JAMA, 2007;298:1763-1771.
- Arias C, MRSA USA300 Clone and VREF — A U.S.–Colombian connection?, N Eng J Med, 2008;359:2177-2179.
- Documentaire allemand (53 minutes) de Frank Bowinkelmann, intitulé en Français « Germes tueurs », réalisé pour la chaine Arte (en 2013) et, diffusé jeudi 9 janvier 2015 (22h20) puis rediffusé les 19.01.2015, 25.01.2015, 20.02.2015 et 20.02-27.02.2015 (lien provisoirement actif vers Arte +7).
- Samsudin, S., Al-Talib, H., Zain, Z. M., & Murugaiah, C. (2020). Panton-Valentine Leukocidin-Positive Staphylococcus aureus: A Successful Infectious Enemy?. International Medical Journal, 27(5), 540-544.
- Assessment of the Public Health significance of meticillin resistant Staphylococcus aureus (MRSA) in animals and foods Question number: EFSA-Q-2008-300 Adopted: 5 March 2009 « Résumé »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) et « étude d'évaluation (Avis de l'EFSA) »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), 3 juin 2010.
- Maria de Fatima N. F. Alves, Bruno Penna, Renata F. A. Pereira et Reinaldo B. Geraldo, « First report of meticillin-resistant Staphylococcus aureus harboring mecC gene in milk samples from cows with mastitis in southeastern Brazil », Brazilian Journal of Microbiology: [publication of the Brazilian Society for Microbiology], (ISSN 1678-4405, PMID 33083945, DOI 10.1007/s42770-020-00385-z, lire en ligne, consulté le )
- (en) Marilyn C. Roberts, Prabhu Raj Joshi, Stefan Monecke et Ralf Ehricht, « Staphylococcus aureus and Methicillin Resistant S. aureus in Nepalese Primates: Resistance to Antimicrobials, Virulence, and Genetic Lineages », Antibiotics, vol. 9, no 10, , p. 689 (ISSN 2079-6382, PMID 33066007, PMCID PMC7601186, DOI 10.3390/antibiotics9100689, lire en ligne, consulté le )
- Mj Lavery, K Macbeth et Ml Walsh, « G615(P) Beware! the emerging superbug », Abstracts, BMJ Publishing Group Ltd and Royal College of Paediatrics and Child Health, , A221.1–A221 (DOI 10.1136/archdischild-2020-rcpch.529, lire en ligne, consulté le )
- Engemann JJ, Carmeli Y, Cosgrove SE, Fowler VG, Bronstein MZ, Trivette SL et als. Adverse clinical and economic outcomes attributable to methicillin resistance among patients with Staphylococcus aureus surgical site infection, Clin Infect Dis, 2003;36:592-8.
- Laupland KB, Ross T, Gregson DB, Staphylococcus aureus bloodstream infections: risk factors, outcomes, and the influence of methicillin resistance in Calgary, Canada, 2000-2006, Clin Infect Dis, 2008;198:336-43.
- « Daptomycine », sur pharmacomedicale.org (consulté le )
- « ZINFORO (ceftaroline), céphalosporine », sur Haute Autorité de Santé (consulté le )
- « XYDALBA (dalbavancine), antibiotique de la classe des glycopeptides », sur Haute Autorité de Santé (consulté le )
- (en) Hiroshi Hamamoto et al., « Lysocin E is a new antibiotic that targets menaquinone in the bacterial membrane », Nature Chemical Biology, (DOI 10.1038/nchembio.1710, résumé).
- (en) Motoki Murai et al., « Total Synthesis and Biological Evaluation of the Antibiotic Lysocin E and Its Enantiomeric, Epimeric, and N-Demethylated Analogues », Angewandte Chemie International Edition, (DOI 10.1002/anie.201410270, résumé).
- Raphaëlle Maruchitch et Anuliina Savolainen, « Les phages, des virus guérisseurs. », sur Le Monde, .
- I. Ozkan, E. Akturk, N. Yeshenkulov et S. Atmaca, « Lytic Activity of Various Phage Cocktails on Multidrug-Resistant Bacteria », Clinical and Investigative Medicine. Medecine Clinique Et Experimentale, vol. 39, no 6, , p. 27504 (ISSN 1488-2353, PMID 27917795, lire en ligne, consulté le )
- (en) « IITD PAN Wrocław - Bacteriophage research and therapy », sur www.iitd.pan.wroc.pl (consulté le )
- (sk) « Bohemia Pharmaceuticals | Stafal » (consulté le )
- (en) « (PDF) Comparison of in vitro lytic activities of three bacteriophage preparations Stafal, Saphylon and Pyobacteriophagum liquidum against methicillin resistant Staphylococcus aureus », sur ResearchGate (consulté le )
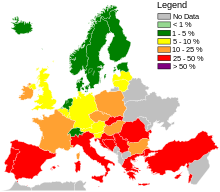
- (en) « MRSA in the European Region (EARS-Net and CAESAR), 2017 » [PDF], sur rivm.nl, Institut national de la santé publique et de l'environnement, (consulté le )
- Cooper BS, Stone SP, Kibbler CC, Cookson BD, Roberts JA, Medley GF et als. Isolation measures in the hospital management of methicillin resistant Staphylococcus aureus (MRSA): systematic review of the literature, BMJ, 2004;329:533-40.
- Charbonneau P, Parienti JJ, Thibon P, Ramakers M, Daubin C, du Cheyron D et als. Fluoroquinolone use and methicillin-resistant Staphylococcus aureus isolation rates in hospitalized patients: a quasi experimental study, Clin Infect Dis, 2006;42:778-84.
- Kluytmans J, van Belkum A, Verbrugh H, Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks, Clin Microbiol Rev, 1997;10:505-20.
- Cooper BS, Stone SP, Kibbler CC, et als. Isolation measures in the hospital management of methicillin resistant Staphylococcus aureus (MRSA): systematic review of the literature, BMJ, 2004;329:533.
- Loeb M, Main C, Walker-Dilks C, Eady A, Antimicrobial drugs for treating meticillin resistant Staphylococcus aureus colonisation, Cochrane Database Syst Rev 2003;(3):CD003340.
- Kluytmans J, Struelens M, Meticillin resistant Staphylococcus aureus in the hospital, BMJ, 2009;338:b364.
- (en) Davina Campbell, Gillian McAllister, Kelly Jackson et Isaac See, « Molecular Typing of Invasive Staphylococcus aureus from the Emerging Infections Program (EIP) Using Whole-Genome Sequencing », Infection Control & Hospital Epidemiology, vol. 41, no S1, , s71–s72 (ISSN 0899-823X et 1559-6834, DOI 10.1017/ice.2020.560, lire en ligne, consulté le )
- (en) Chiu-Fai Kuok, Sai-On Hoi, Chi-Fai Hoi, Chi-Hong Chan, Io-Hong Fong, Cheong-Kei Ngok, Li-Rong Meng et Pedro Fong, « Synergistic antibacterial effects of herbal extracts and antibiotics on methicillin-resistant Staphylococcus aureus: A computational and experimental study », Experimental Biology and Medicine (Maywood, N.J.), vol. 242, no 7, , p. 731–743 (ISSN 1535-3699, PMID 28118725, PMCID 5363687, DOI 10.1177/1535370216689828)
- (en) PhilipG Crandall, JodyM Lingbeck, CorlissA O′Bryan, ElizabethM Martin et JoshuaP Adams, « Sweetgum: An ancient source of beneficial compounds with modern benefits », Pharmacognosy Reviews, vol. 9, no 17, , p. 1 (ISSN 0973-7847, DOI 10.4103/0973-7847.156307)
- (en) Diego Maselli, Holly Keyt et Marcos Restrepo, « Inhaled Antibiotic Therapy in Chronic Respiratory Diseases (Review) », International Journal of Molecular Sciences, vol. 18, no 5, , p. 1062 (ISSN 1422-0067, DOI 10.3390/ijms18051062)
- (en) Himanshu G. Toor, Devjani I. Banerjee et Jenabhai B. Chauhan, « In Silico Evaluation of Human Cathelicidin LL-37 as a Novel Therapeutic Inhibitor of Panton-Valentine Leukocidin Toxin of Methicillin-Resistant Staphylococcus aureus », Microbial Drug Resistance, , mdr.2020.0196 (ISSN 1076-6294 et 1931-8448, DOI 10.1089/mdr.2020.0196, lire en ligne, consulté le )
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- Staphylococcus
- Maladie infectieuse
- Maladie émergente
- Résistance aux antibiotiques
- Infection nosocomiale
- Épidémiologie
- Éco-épidémiologie
- Zoonose
Bibliographie[modifier | modifier le code]
- Chow, S. H. The role of Staphylococcus aureus Panton-Valentine leukocidin (PVL) in mammalian macrophages (Doctoral dissertation, Monash University) (résumé)
