Alginate
| Acide alginique | |
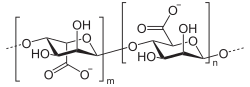 Alginate.  Acide alginique. |
|
| Identification | |
|---|---|
| Nom UICPA | acide (2R,3S,4R,5R,6S)-6-[(2R,3R,4R,5R,6S)-2-carboxy-4,5-dihydroxy-6-méthoxyoxan-3-yl]oxy-4,5-dihydroxy-3-méthoxyoxane-2-carboxylique |
| Synonymes |
acide alginique |
| No CAS | |
| No CE | 232-680-1 |
| Code ATC | A02 |
| PubChem | 25147441 |
| No E | E400 |
| SMILES | |
| InChI | |
| Apparence | poudre fibreuse blanche à jaune pâle, sans goût, pratiquement inodore[1] |
| Propriétés chimiques | |
| Formule | (C6H8O6)n |
| Masse molaire | 20 000 à 240 000 g/mol[1] |
| Propriétés physiques | |
| Solubilité | sol. dans les hydroxydes alcalins, pratiquement insol. dans l'éthanol (95 %) et les autres solvants organiques[1] |
| Masse volumique | 1,601 g cm−3[1] |
| Écotoxicologie | |
| DL50 | >5 000 mg kg−1 (rat, oral) 1 600 mg kg−1 (rat, i.p.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L’acide alginique et ses dérivés (base conjuguée, sels et esters) les alginates sont des polysaccharides obtenus à partir d'algues brunes : les laminaires ou les fucus. De couleur variant du blanc au brun jaunâtre, il est vendu sous forme filamenteuse, granulaire ou en poudre.

C'est un composant important des biofilms produits par certaines bactéries pour se protéger (ex. : par Pseudomonas aeruginosa, un pathogène majeur trouvé dans les poumons de certaines personnes atteintes de fibrose kystique[3] ou par les Borrelia responsables de la maladie de Lyme[4]) ; ces biofilms sont très résistants aux antibiotiques[5] et aux globules blancs qui semblent ne pas les considérer comme étrangers[6].
Histoire[modifier | modifier le code]
Les propriétés de l’alginate de sodium sont étudiées à Tiree (Écosse) durant les années 1860[7] par le chimiste anglais Edward Charles Cortis (1837-1899), plus connu sous le nom de « E.C.C. Stanford » (pour « Edward Charles Cortis Stanford »)[8],[9].
Le dépôt de brevet est réalisé en 1881 sans succès commercial[10],[11].
Il a alors extrait, grâce à une solution alcaline, un liquide visqueux d’une algue brune du genre Laminaria. Il nomme ce produit « algin », dont le terme est encore fréquemment utilisé pour désigner l’alginate de sodium.
L’alginate de sodium est un sel extrait à partir de ce liquide visqueux issu de la paroi cellulaire d’algues brunes. Sa fonction naturelle consiste à augmenter la flexibilité de l’algue. Les algues se développant en eaux agitées comportent généralement un contenu en alginate plus important que celles croissant en eaux calmes.
Bien que l’ensemble des algues brunes puisse être une source d’alginate, des variations dans leur structure chimique influencent les propriétés du produit final. Différentes espèces sont donc récoltées en fonction des usages auxquels elles sont destinées. Les algues les plus appréciées sont Macrocystis pyrifera (Californie) et Ascophyllum nodosum, cultivées dans l’Atlantique Nord.
Une liste d'évolutions de brevets est établie dans les différents domaines d'applications[12], en 1997, par le biochimiste Amos Nussinovitch[13].
Chez les bactéries[modifier | modifier le code]
L'alginate permet à diverses bactéries de produire des biofilms qui les rendent jusqu'à mille fois plus résistantes aux antibiotiques que quand elles vivent à l'état libre[14],[15],[16].
Propriétés[modifier | modifier le code]
L'acide alginique mis sur le marché est tiré de certaines algues ; il permet la production de fibres d'alginates de sodium et de calcium. Les alginates alcalins forment dans l'eau des solutions colloïdales visqueuses. Si l'acide alginique est insoluble dans l'eau, l'alginate de sodium est lui très soluble dans l'eau, et l'alginate de calcium est seulement soluble en milieu basique, notamment en solutions de savon qui sont presque toujours assez alcalines. Ses fibres sont d'ailleurs utilisées comme soutiens passagers, qui seront à éliminer après fabrication, par lavage ou par foulonnage. Pour transformer les articles en alginates insolubles, on les utilise sous forme de sels de béryllium ou de chrome.
Les alginates peuvent former des gels durs et thermostables utilisés comme additifs alimentaires (E400 à E405) permettant la reconstruction des aliments (jambon, cordons bleus, poisson pané, etc.). Les alginates donnent une texture onctueuse à nombre d'aliments tels que les crèmes glacées.
Composition chimique[modifier | modifier le code]
L'alginate est un copolymère linéaire issu de deux monomères : le mannuronate ou acide mannuronique, dont certains sont acétylés, et le guluronate ou acide guluronique (en). La liaison se fait via β-1-4. La proportion et la distribution des deux unités monomères sont déterminantes pour une large expansion des propriétés physiques et chimiques de l'alginate. Sa composition chimique varie selon les diverses espèces d'algues, les différentes parties de la même plante, et est sujette aux changements saisonniers. Néanmoins, par sélection de matières premières aux différentes propriétés, il est possible de fabriquer une variété d'alginate aux caractéristiques constantes.
Procédé de fabrication[modifier | modifier le code]
L'algue est coupée et nettoyée après la récolte. Ensuite, elle est mise à macérer dans un acide minéral dilué pour être déminéralisée. L'alginate contenu dans l'algue est ainsi transformé en acide alginique et, en même temps, certains constituants indésirables sont éliminés[17]. Les algues déminéralisées sont broyées en présence d'un alcali ou d'un sel alcalin afin de neutraliser l'acide alginique et de solubiliser celui-ci sous forme de sel correspondant. L'alginate est extrait et traité. Il est précipité, pressé, lavé et essoré, puis neutralisé, séché et moulu à la granulométrie désirée. On obtient alors différents sels aux propriétés bien précises : les alginates de métaux alcalins (sodium, potassium, magnésium, etc.) sont solubles dans l'eau tandis que l'acide alginique et son dérivé calcique (calcium, aluminium, fer, etc.) y sont pratiquement insolubles. Les sels solubles se dissolvent à basse température et forment des solutions épaisses et visqueuses, des gels résistants à la chaleur.
Utilisations[modifier | modifier le code]
Alimentaire[modifier | modifier le code]
Les alginates sont utilisés comme épaississants, gélifiants, émulsifiants et stabilisants de produits industriels les plus variés depuis les gelées alimentaires, les produits de beauté, jusqu'aux peintures et aux encres d'imprimerie. Les laits gélifiés le sont par des alginates et carraghénanes, qui produisent des desserts lactés pasteurisés.
Médical[modifier | modifier le code]
Des billes d'alginates peuvent également être utilisées en médecine pour encapsuler des médicaments ou des substances biologiques fragiles (enzymes, microorganismes, cellules animales ou humaines). L'alginate peut aussi être utilisé dans la confection de certains pansements.
Un exemple prometteur d’utilisation des alginates dans le domaine médical est l’encapsulation de cellules du pancréas : les îlots de Langerhans. Ces cellules permettent la sécrétion d’une hormone qui intervient dans la régulation de la glycémie : l’insuline.
Cette idée d’encapsuler ce type de cellules provient de la volonté de trouver une alternative aux greffes de pancréas, ce type de greffe nécessitant en parallèle un lourd traitement immunosuppresseur afin d’éviter tout risque de rejet. De plus, les traitements de ce genre sont souvent la cause de différents effets secondaires.
Beaucoup d’études scientifiques s’intéressent à l’encapsulation (en) d’îlots de Langerhans. Une étude consistait à évaluer le bon fonctionnement des îlots de Langerhans encapsulés transplantés au sein de souris diabétiques sur une longue période de plusieurs mois[18]. Les microcapsules d’alginates ont été réticulées grâce au baryum qui est un cation divalent. Habituellement, la réticulation se fait plutôt avec du calcium, on parle alors d’alginate de calcium. Il semblerait que le baryum permette d’obtenir des microcapsules plus stables.
Avant de transplanter les billes au sein des souris, l’efficacité ex situ des îlots de Langerhans encapsulés a été éprouvée. Une fois cette première étape validée, les microcapsules d’alginates peuvent être transplantées chez les souris. Les résultats de cette étude montrent une certaine protection des cellules contre les réactions du système immunitaire. Cela explique qu’au cours de l’étude, les îlots de Langerhans non encapsulés ont perdu l’intégralité de leur capacité après à peine quelques jours au sein des souris (entre quatre et huit jours). Par ailleurs, les souris diabétiques ont retrouvé une glycémie similaire par rapport aux souris non diabétiques. Enfin, les cellules encapsulées présentent une bonne viabilité (de l’ordre de 85 %).
D’autres études[Lesquelles ?] se concentrent sur l’encapsulation d’îlots de Langerhans et sont toujours en quête de renouveau, d’amélioration des techniques, d’obtention de microcapsules plus performantes.
Une nouvelle équipe de chercheurs a mis au point une nouvelle bille d’alginate en changeant la méthode de réticulation habituelle en ajoutant une étape méthylacrylation[19]. Cette seconde étape consiste à modifier le groupement carboxyle en ajoutant du chlorhydrate de méthacrylate de 2-aminoéthyle (AEMA) au niveau de l'alginate. Ce groupement est facilement photoactivable par l'utilisation d'UV, ce qui génère des liaisons covalentes et une structure plus organisée.

L'alginate de propane-1,2-diol (E405), ester de l'acide aliginique, est utilisé, par exemple, pour stabiliser des mousses (vinification, additif de bière, etc.), et est également utilisé dans un procédé de préparation de microcapsules.
L'alginate est également utilisé pour réaliser des moulages sur le corps humain grâce à ses qualités hypoallergéniques. C'est souvent le produit utilisé par les dentistes pour les prises d'empreintes dentaires. Sa couleur varie du blanc crème à l'ivoire foncé. Sa granulométrie très fine permet des empreintes très fidèles[20].
Art et spectacle[modifier | modifier le code]
Il est aussi utilisé par les spécialistes des effets spéciaux au cinéma pour reproduire des parties du corps humain[réf. souhaitée].
Fabrication de capsule d'eau[modifier | modifier le code]
La start-up Ooho fondée en 2014 est parvenue à encapsuler environ 4 cl d'eau dans une membrane constituée d'alginates[21]. Cela permet de lutter contre l'utilisation du plastique pour les bouteilles d'eau. Pour boire l'eau contenue dans la capsule, on peut la percer ou tout simplement avaler la capsule entière, la membrane d'alginate étant comestible.
Commerce[modifier | modifier le code]
En 2014, la France est nette exportatrice d'acide alginique, d'après les douanes françaises. Ont été exportées mensuellement en moyenne 290 t et importées 90 t[réf. nécessaire], avec un prix moyen observé à la frontière de 9 000 €/t[22].
Législation[modifier | modifier le code]
En France, l'utilisation d'additifs pouvant être employés dans la fabrication des denrées destinées à l'alimentation humaine est soumis à l'application d'un arrêté depuis 1989[23].
Références[modifier | modifier le code]
- (en) Raymond C. Rowe, Paul J. Sheskey et Marian E. Quinn, Handbook of Pharmaceutical Excipients, Londres, Pharmaceutical Press and American Pharmacists Association, , 6e éd., 888 p. (ISBN 978-0-85369-792-3, BNF 42148066), p. 20.
- (en) « ChemIDPlus » (consulté le ).
- (en) J.C. Davies (en), « Pseudomonas aeruginosa in cystic fibrosis: pathogenesis and persistence », Paediatric Respiratory Reviews (de), vol. 3, no 2, , p. 128–34 (ISSN 1526-0542, PMID 12297059, DOI 10.1016/S1526-0550(02)00003-3).
- (en) Sapi E. et al. (2019), The Long-Term Persistence of Borrelia burgdorferi Antigens and DNA in the Tissues of a Patient with Lyme Disease, Antibiotics, 8(4), 183, DOI 10.3390/antibiotics8040183.
- (en) A. Boyd et A.M. Chakrabarty, « Pseudomonas aeruginosa biofilms: role of the alginate exopolysaccharide », Journal of Industrial Microbiology (de), vol. 15, no 3, , p. 162–168 (ISSN 0169-4146, PMID 8519473, DOI 10.1007/BF01569821).
- (en) J.G. Leid, C.J. Willson, M.E. Shirtliff, D.J. Hassett, M.R. Parsek et A.K. Jeffers, « The exopolysaccharide alginate protects Pseudomonas aeruginosa biofilm bacteria from IFN-gamma-mediated macrophage killing », Journal of Immunology, vol. 175, no 11, , p. 7512–7518 (ISSN 0022-1767, PMID 16301659, DOI 10.4049/jimmunol.175.11.7512, lire en ligne).
- (en) The seaweed factory at Middleton (traduit par L’usine d'algues à Middleton), sur aniodhlann.org.uk (consulté le ).
- (en) Edward Charles Cortis (1837-1899) Later known as Edward Charles Cortis Stanford, , sur photohistory-sussex.co.uk (consulté le ).
- (en) The society of chemical industry () (traduit par La société de l’industrie chimique), , Wiley Online Library (consulté le ).
- (en) Thomas E. Furia (traduit par Manuel des additifs alimentaires), CRC Handbook of Food Additives, vol. 1, Boca Raton (Floride), CRC Press, , rel, 1016, 19 × 26,7 cm (ISBN 978-0-8493-0542-9 et 9780849305429, présentation en ligne), p. 305.
- (en) David L. Kaplan (en) (traduit par Biopolymères de ressources renouvelables), Biopolymers from Renewable Resources, Berlin / Heidelberg, Springer Verlag, , br, XIX, 420, in 8° (ISBN 978-3-540-63567-3 et 9783642083419, BNF 37543377, DOI 10.1007/978-3-662-03680-8, présentation en ligne), p. 119.
- (en) Alginates. In: Hydrocolloid Applications, Springer Verlag (consulté le ).
- Auteur : Amos Nussinovitch sur data.bnf.fr (consulté le ).
- (en) Lopes, S.P. ; Ceri, H. ; Azevedo, N.F. et Pereira, M.O. (2012), Antibiotic resistance of mixed biofilms in cystic fibrosis: Impact of emerging microorganisms on treatment of infection[PDF], Int. J. Antimicrob. Agents (en), 40, 260–263.
- (en) Römling, U. et Balsalobre, C. (2012), Biofilm infections, their resilience to therapy and innovative treatment strategies, J. Intern. Med. (en), 272, 541–561.
- (en) Sun, F. ; Qu, F. ; Ling, Y. ; Mao, P. ; Xia, P. ; Chen, H. et Zhou, D. (2013), Biofilm-associated infections: Antibiotic resistance and novel therapeutic strategies, Future Microbiol (en), 8, 877–886 (résumé).
- Les algues : une « agroressource » d'avenir, expériences autour des algues, sur CultureSciences Chimie, un site ENS-DGESCO.
- (en) Stephan Schneider, Peter J. Feilen, Frank Brunnenmeier, Timo Minnemann et al., « Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice », Diabetes, vol. 54, no 3, , p. 687–693 (ISSN 0012-1797, PMID 15734844, lire en ligne, consulté le ).
- (en) Sami I. Somo, Kelly Langert, Chin-Yu Yang, Marcella K. Vaicik et al., « Synthesis and evaluation of dual crosslinked alginate microbeads », Acta Biomaterialia, (ISSN 1878-7568, PMID 29101016, DOI 10.1016/j.actbio.2017.10.046, lire en ligne, consulté le ).
- Techniques et pratique du staff, Eyrolles (lire en ligne).
- « Ooho, la capsule d’eau sans plastique », sur Les Échos, (consulté le ).
- « Indicateur des échanges import/export », sur Direction générale des douanes (Indiquer : NC8=39131000) (consulté le ).
- Arrêté du JORF no 0242 du , relatif aux additifs dont « E400 Acide alginique » (consulté le ).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) Alginate : The history of chemistry et Introduction - Properties, sur cybercolloids.net (consulté le ))
- Histoire de la chimie des algues en Bretagne. De la soude à l'iode jusqu'aux alginates.

