« Impact anthropique sur le cycle de l'azote » : différence entre les versions
m Formatage, traduction des modèles de liens |
LD (discuter | contributions) m →Histoire des apports anthropiques en azote : trad en cours |
||
| Ligne 10 : | Ligne 10 : | ||
== Histoire des apports anthropiques en azote == |
== Histoire des apports anthropiques en azote == |
||
{{traduction à revoir|date=décembre 2020}} |
|||
{{...}} |
|||
{{Bar chart|title=Moyenne [[pluie acide|des émissions acidifiantes]] (pollution de l'air) des différents aliments pour 100g de protéines<ref name="Nemecek 987–992">{{Cite journal|last1=Nemecek|first1=T.|last2=Poore|first2=J.|date=2018-06-01|title=Reducing food's environmental impacts through producers and consumers|journal=Science|volume=360|issue=6392|pages=987–992|doi=10.1126/science.aaq0216|issn=0036-8075|pmid=29853680|bibcode=2018Sci...360..987P|s2cid=206664954}}</ref>|float=right|label_type=Food Types|data_type=Emissions acidifiantes (g. eq.<ref group="note">grammes équivalents</ref> SO<sub>2</sub> pour 100g de protéines)|bar_width=20|width_units=em|data_max=300.6|label1=[[Beef]]|data1=343.6|label2=[[Cheese]]|data2=165.5|label3=[[Porc (viande)|Porc]]|data3=142.7|label4=[[Lamb and mutton|Lamb and Mutton]]|data4=139.0|label5=[[Aquaculture|Crustacés élevés]]|data5=133.1|label6=[[Poultry]]|data6=102.4|label7=[[Aquaculture|poissons élevés]]|data7=65.9|label8=[[Egg as food|Eggs]]|data8=53.7|label9=[[Faboideae|arachides]]|data9=22.6|label10=[[Pois cultivé]]s|data10=8.5|label11=[[Tofu]]|data11=6.7|label12=|data12=|label13=|data13=}} |
|||
Environ 78% de l'atmosphère terrestre est constituée de N à l'état gazeux ({{fchim|[[Azote|N]]|2}}), qui est un composé inerte et biologiquement indisponible pour la plupart des organismes. Pour être utilisé dans la plupart des processus biologiques, {{fchim|[[Azote|N]]|2}} doit être converti en N réactif (Nr), qui comprend des formes réduites inorganiques (NH <sub> 3 </sub> et NH <sub> 4 </sub> <sup> + </sup>), formes oxydées inorganiques (NO, NO <sub> 2 </sub>, HNO <sub> 3 </sub>, N <sub> 2 </sub> O , et NO <sub> 3 </sub> <sup> - </sup>), et les composés organiques ([[urea]], [[amine]]s et [[protéine]]s). <ref name = "gallo2003" /> N <sub> 2 </sub> a une triple liaison forte, et donc une quantité significative d'énergie (226 kcal mol <sup> -1 </sup>) est nécessaire pour convertir N <sub> 2 </sub> to Nr. <Ref name = "gallo2003" /> Avant les procédés industriels, les seules sources de cette énergie étaient le rayonnement solaire et les décharges électriques. <Ref name = "gallo2003" /> Utilisant une grande quantité de métabolisme l'énergie et l'enzyme [[nitrogénase]], certaines [[bactéries]] et [[cyanobactéries]] convertissent le N <sub> 2 </sub> atmosphérique en NH <sub> 3 </sub>, un processus biologique appelé [[fixation de l'azote]] (FBN, en anglais: {{langue|en|BNF}}))<ref name = "Schles"> Schlesinger, WH 1997. '' Biogéochimie: An analy sis of global change '', San Diego, Californie. </ref>. L'analogue anthropique du FBN est le procédé [[procédé Haber|Haber-Bosch]], dans lequel H <sub> 2 </sub> réagit avec N <sub atmosphérique > 2 </sub> à des températures et pressions élevées pour produire du NH <sub> 3 </sub>. <Ref name = smil> Smil, V. 2001. '' Enrichir la terre: Fritz Haber, Carl Bosch, et la transformation de la production alimentaire mondiale ''. MIT Press, Cambridge, MA. </ref> Enfin, N <sub> 2 </sub> est converti en NO par l'énergie de la [[foudre]], qui est négligeable dans les écosystèmes tempérés actuels, ou par [[combustible fossile]]<ref name = "gallo2003"/>. |
|||
Jusqu'en 1850, la [[fixation biologique du diazote]], et la fixation du diazote induit par la culture (par exemple, la plantation de cultures [[légumineuses]]) et la matière organique incorporée étaient les seules sources d'azote pour la production agricole<ref name=smil/>. Vers le début du XIX siècle, le Nr des gisements de [[guano]] et des dépôts de [[nitrate de sodium]] a été récolté et exporté des îles arides du Pacifique et des déserts d'Amérique du Sud<ref name=smil/>. À la fin des années 1920, les premiers procédés industriels, bien qu'inefficaces, étaient couramment utilisé pour produire du NH<sub>3 </sub><ref name ="gallo2003"/>. Grâce aux efforts de [[Fritz Haber]] et [[Carl Bosch]], le procédé Haber-Bosch est devenu la plus grande source d'engrais azotés après les années 1950, et a remplacé la FND comme source dominante de production de NH<sub>3</sub><ref name =smil/>. De 1890 à 1990, le Nr créé anthropiquement a presque été multiplié par neuf<ref name ="gallo2003"/>. Pendant ce temps, la population humaine a plus que triplé, en partie en raison de l'augmentation de la production alimentaire. |
|||
Depuis la [[révolution industrielle]], une source supplémentaire d'apport d'azote anthropique est la combustion de [[combustibles fossiles]], qui est utilisée pour libérer de l'énergie (par exemple, pour alimenter les automobiles). Lorsque les [[combustibles fossiles]] sont brûlés, des températures et des pressions élevées fournissent de l'énergie pour produire du NO à partir de l'oxydation de N<sub>2</sub><Ref name = "gallo2003" /> De plus, lorsque [[combustible fossile]] est extrait et brûlé, l'azote fossile peut devenir réactif (c.-à-d. NO <sub> x </sub> émissions). <ref name = gallo2003"/>. Au cours des années 1970, les scientifiques ont commencé à reconnaître que les apports d'azote s'accumulaient dans l'environnement et affectant les écosystèmes<ref name="gallo2003"/>. |
|||
== Impacts des apports anthropiques dans le cycle de l'azote == |
== Impacts des apports anthropiques dans le cycle de l'azote == |
||
{{...}} |
{{...}} |
||
Version du 4 décembre 2020 à 20:35
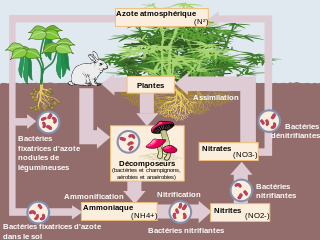
Les impacts humains sur le cycle de l'azote sont les effets, directs et indirects, de l'Homme sur le cycle de l'azote. Ces impacts sont nombreux et complexes, cet article vise à donner un bref aperçu de l'accroissement de la part d'azote dans certains écosystèmes, dont terrestres, atmosphériques et aquatiques notamment par les nitrates (NO3−, composés d'azote noté N).
En sciences des systèmes, le cycle de l'azote est un cycle biogéochimique qui se définit comme un système, c'est-à-dire « un ensemble d’éléments en interaction dynamique, organisé en fonction d’un but »[1]. Autrement dit, le cycle de l'azote est un ensemble de réservoirs, constitués de différents composés d'azote (voir Figure 1), entre lesquelles différents flux viennent en modifier la quantité par entrée ou sortie; et dont le but est sa propre conservation en tant que système organisé, stable et fonctionnel.
Les apports humains d'azote dans l'environnement[N 1], d'origines agricoles et industriels, dépassent actuellement la fixation biologique de l'azote[2]. En raison des apports anthropiques, le cycle global de l'azote a été considérablement modifié au cours du XXe siècle. Les fractions molaires globales d'oxyde nitreux (N2O) dans l'astosphère sont passées d'une valeur pré-industrielle d'environ 270 nmol/mol à environ 319 nmol/mol en 2005[3]. Les activités humaines représentent plus d'un tiers des émissions de N2O, dont la plupart sont dues au secteur agricole.
Histoire des apports anthropiques en azote
| Food Types | Emissions acidifiantes (g. eq.[note 1] SO2 pour 100g de protéines) |
|---|---|
| Beef | 343,6
|
| Cheese | 165,5
|
| Porc | 142,7
|
| Lamb and Mutton | 139,0
|
| Crustacés élevés | 133,1
|
| Poultry | 102,4
|
| poissons élevés | 65,9
|
| Eggs | 53,7
|
| arachides | 22,6
|
| Pois cultivés | 8,5
|
| Tofu | 6,7
|
Environ 78% de l'atmosphère terrestre est constituée de N à l'état gazeux (N2), qui est un composé inerte et biologiquement indisponible pour la plupart des organismes. Pour être utilisé dans la plupart des processus biologiques, N2 doit être converti en N réactif (Nr), qui comprend des formes réduites inorganiques (NH 3 et NH 4 + ), formes oxydées inorganiques (NO, NO 2 , HNO 3 , N 2 O , et NO 3 - ), et les composés organiques (urea, amines et protéines). [2] N 2 a une triple liaison forte, et donc une quantité significative d'énergie (226 kcal mol -1 ) est nécessaire pour convertir N 2 to Nr. [2] Avant les procédés industriels, les seules sources de cette énergie étaient le rayonnement solaire et les décharges électriques. [2] Utilisant une grande quantité de métabolisme l'énergie et l'enzyme nitrogénase, certaines bactéries et cyanobactéries convertissent le N 2 atmosphérique en NH 3 , un processus biologique appelé fixation de l'azote (FBN, en anglais: BNF))[5]. L'analogue anthropique du FBN est le procédé Haber-Bosch, dans lequel H 2 réagit avec N 2 à des températures et pressions élevées pour produire du NH 3 . [6] Enfin, N 2 est converti en NO par l'énergie de la foudre, qui est négligeable dans les écosystèmes tempérés actuels, ou par combustible fossile[2].
Jusqu'en 1850, la fixation biologique du diazote, et la fixation du diazote induit par la culture (par exemple, la plantation de cultures légumineuses) et la matière organique incorporée étaient les seules sources d'azote pour la production agricole[6]. Vers le début du XIX siècle, le Nr des gisements de guano et des dépôts de nitrate de sodium a été récolté et exporté des îles arides du Pacifique et des déserts d'Amérique du Sud[6]. À la fin des années 1920, les premiers procédés industriels, bien qu'inefficaces, étaient couramment utilisé pour produire du NH3 [2]. Grâce aux efforts de Fritz Haber et Carl Bosch, le procédé Haber-Bosch est devenu la plus grande source d'engrais azotés après les années 1950, et a remplacé la FND comme source dominante de production de NH3[6]. De 1890 à 1990, le Nr créé anthropiquement a presque été multiplié par neuf[2]. Pendant ce temps, la population humaine a plus que triplé, en partie en raison de l'augmentation de la production alimentaire.
Depuis la révolution industrielle, une source supplémentaire d'apport d'azote anthropique est la combustion de combustibles fossiles, qui est utilisée pour libérer de l'énergie (par exemple, pour alimenter les automobiles). Lorsque les combustibles fossiles sont brûlés, des températures et des pressions élevées fournissent de l'énergie pour produire du NO à partir de l'oxydation de N2[2] De plus, lorsque combustible fossile est extrait et brûlé, l'azote fossile peut devenir réactif (c.-à-d. NO x émissions). [7]. Au cours des années 1970, les scientifiques ont commencé à reconnaître que les apports d'azote s'accumulaient dans l'environnement et affectant les écosystèmes[2].
Impacts des apports anthropiques dans le cycle de l'azote
Astmopshère
Biosphère
Ecosystèmes terrestres
Impacts sur la productivité et le cycle des nutriments
Impacts sur la diversité des espèces végétales
Ecosystèmes aquatiques
Acidification des eaux douces
Eutrophisation des systèmes marins
Integration
Voir aussi
Bibliographie
- A. G. Good et P. H. Beatty, « Fertilizing Nature: A Tragedy of Excess in the Commons », PLOS Biology, vol. 9, no 8, , e1001124 (PMID 21857803, PMCID 3156687, DOI 10.1371/journal.pbio.1001124).
- Scarsbrook M., Barquin J. et Gray D., New Zealand coldwater springs and their biodiversity, (ISBN 978-0-478-14289-1, ISSN 1173-2946, lire en ligne), chap. 278
- H. Olde Venterink, M. J. Wassen, A. W. M. Verkroost et P. C. De Ruiter, « Species Richness–Productivity Patterns Differ Between N-, P-, and K-Limited Wetlands », Ecology, vol. 84, no 8, , p. 2191–2199 (DOI 10.1890/01-0639, JSTOR 3450042, lire en ligne [archive du ], consulté le )
Notes et références
Notes
- c.à.d l'ensemble des ajouts de matières par flux d'entrée au sein des écosystèmes.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Human impact on the nitrogen cycle » (voir la liste des auteurs).
- Joël de Rosnay, Le Macroscope, vers une vision globale, 1977; «L'aventure du Vivant», vers la compréhension de l'apparition de la vie et son fonctionnement présenté méthodiquement par la systémique, 1991, (ISBN 2020135116 et 9782020135115), Du Seuil;
- J. N. Galloway, J. D. Aber, J. N. W. Erisman, S. P. Seitzinger, R. W. Howarth, E. B. Cowling et B. J. Cosby, « The Nitrogen Cascade », BioScience, vol. 53, no 4, , p. 341 (DOI 10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2)
- Alley et al. 2007. IPCC Climate Change 2007: The Physical Science Basis. Contribution of Working Group I in the Third Assessment Report of Intergovernmental Panel on Climate Change. Report Summary for Policy Makers (SPM) « https://web.archive.org/web/20110716022730/http://www.uclm.es/area/amf/Antoine/Fusion/Ipcc_anotado.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), .
- T. Nemecek et J. Poore, « Reducing food's environmental impacts through producers and consumers », Science, vol. 360, no 6392, , p. 987–992 (ISSN 0036-8075, PMID 29853680, DOI 10.1126/science.aaq0216, Bibcode 2018Sci...360..987P, S2CID 206664954)
- Schlesinger, WH 1997. Biogéochimie: An analy sis of global change , San Diego, Californie.
- Smil, V. 2001. Enrichir la terre: Fritz Haber, Carl Bosch, et la transformation de la production alimentaire mondiale . MIT Press, Cambridge, MA.
- Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesgallo2003"
- Portail de la chimie
- Portail de l’eau
- Portail de l’écologie
- Portail de l’environnement
- Portail de la protection des cultures
Erreur de référence : Des balises <ref> existent pour un groupe nommé « note », mais aucune balise <references group="note"/> correspondante n’a été trouvée

