Titanate de strontium
| Titanate de strontium | |

| |
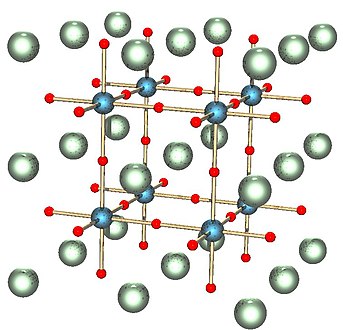
| __ Sr2+ __ Ti4+ __ O2– Structure cristalline du titanate de strontium dans sa phase pérovskite cubique. Le cube noir indique la maille élémentaire conventionnelle. |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.846 |
| No CE | 235-044-1 |
| PubChem | 82899 |
| SMILES | |
| InChI | |
| Apparence | Poudre inodore blanche ou blanchâtre[1] |
| Propriétés chimiques | |
| Formule | SrTiO3 |
| Masse molaire[2] | 183,49 ± 0,01 g/mol O 26,16 %, Sr 47,75 %, Ti 26,09 %, |
| Propriétés physiques | |
| T° fusion | 2 060 °C[1] |
| Masse volumique | 4,81 g·cm-3[1] 5,12 g/cm3[3] |
| Cristallographie | |
| Système cristallin | Cubique |
| Structure type | Pérovskite |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le titanate de strontium est un composé chimique de formule SrTiO3. Il s'agit d'une céramique paraélectrique à température ambiante et cristallisant dans une structure pérovskite cubique. À basse température, il tend vers une transition de phase ferroélectrique avec une permittivité très élevée, de l'ordre de 10 000, mais demeure paraélectrique jusqu'à la température la plus basse mesurable en raison de fluctuations quantiques qui en font un matériau paraélectrique quantique[4]. On a longtemps pensé qu'il n'existait que sous forme synthétique, jusqu'à la découverte, en Sibérie, d'un minéral appelé tausonite (en), reconnu par l'Association internationale de minéralogie en 1982[5], extrêmement rare, et n'existant que sous forme de cristaux de petite taille. Le titanate de strontium est utilisé parfois sous forme de cristaux synthétiques en optique de précision, dans les varistances, dans certaines céramiques technologiques, notamment comme diélectrique, et comme substitut du diamant sous le nom de « fabulite »[6]. En microélectronique, il est utilisé sous forme monocristalline comme substrat pour le dépôt de couches actives.
Propriétés
Physiques
Les cristaux synthétiques sont généralement transparents et incolores, mais peuvent être dopés avec certaines terres rares et métaux de transition pour donner des cristaux rouges, jaunes, bruns et bleus. La tausonite naturelle est généralement translucide à opaque, avec des tons brun rougeâtre, rouge foncé ou gris. Les cristaux synthétiques et naturels ont tous un éclat adamantin. Ils sont très fragiles, avec une cassure conchoïdale. Les cristaux naturels sont cubiques ou octaédriques à trait brun. Les cristaux synthétiques dopés observés au spectroscope montrent le spectre s'absorption riche typique de ce genre de matériaux. Le titanate de strontium synthétique a un point de fusion d'environ 2 080 °C et est facilement attaqué par l'acide fluorhydrique[5],[7]. Il se décompose par sublimation incongruente de strontium bien en dessous de son point de fusion sous une pression partielle d'oxygène très faible[8].
Le titanate de strontium est moins dur que le diamant, avec une dureté de 5,5 sur l'échelle de Mohs pour les cristaux synthétiques, et de 6 à 6,5 pour les cristaux naturels. Sa masse volumique est plus élevée que celle du diamant, de 4,88 à 5,13 g/cm3 en allant du matériau naturel vers le matériau le plus pur. Sa structure cristalline appartient au système cubique et son indice de réfraction à 589,3 nm, longueur d'onde d'une lampe à vapeur de sodium, vaut 2,410, très semblable à celui du diamant, qui vaut 2,417 à cette longueur d'onde, tandis que sa dispersion, responsable du « feu » des gemmes taillées, vaut 4,3 fois celle du diamant, d'où un éclat plus fort que celui du diamant et de ses substituts tels que le YAG, le GAG, le GGG, le dioxyde de zirconium cubique (zircone) et la moissanite[5],[7].
Cristallographiques
À température et pression ambiantes, le titanate de strontium cristallise dans une structure pérovskite cubique du groupe d'espace Pm3m (no 221) dans laquelle les cations Ti4+ sont situés au centre de la maille élémentaire, les anions O2– sont situés au centre de chaque face, et les cations Sr2+ sont situés aux angles des cubes. À des températures inférieures à 105 K, sa structure cristalline devient tétragonale[9],[10] (quadratique) dans le groupe d'espace I4/mcm (no 140).
-
Structure pérovskite cubique de SrTiO3 où les cations Sr2+ et Ti4+ sont représentés respectivement en vert et en bleu. -
Imagerie en champ sombre annulaire (en) grand angle à résolution atomique d'un cristal de SrTiO3 réalisée par microscopie électronique en transmission à balayage (STEM-HAADF) : les atomes de strontium apparaissent clairs et ceux de titane apparaissent sombres.
Le SrTiO3 est un très bon substrat pour la croissance épitaxiale de supraconducteurs à haute température et de nombreuses couches minces à base d'oxydes. Il est particulièrement bien connu comme substrat de croissance de l'interface aluminate de lanthane LaAlO3/titanate de strontium SrTiO3. Son paramètre cristallin de 390,5 pm en fait un substrat acceptable pour la croissance de nombreux autres oxydes, y compris les manganites de terres rares, les titanates, l'aluminate de lanthane LaAlO3, le ruthénate de strontium SrRuO3 et bien d'autres.
Il est également possible de faire croître des couches épitaxiales de SrTiO3 de haute qualité sur du silicium sans former de dioxyde de silicium SiO2, ce qui fait du titanate de strontium une alternative possible comme diélectrique pour réaliser des grilles de transistors. Cela permet également l'intégration d'autres couches minces d'oxydes à structure pérovskite sur du silicium[11].
Électroniques
Le titanate de strontium a un gap indirect de 3,25 eV et un gap direct de 3,75 eV[12], conforme à l'ordre de grandeur généralement observé pour les semiconducteurs. La permittivité du SrTiO3 synthétique à température ambiante et dans un champ électrique faible est très élevée, de l'ordre de 300 ; cette permittivité croît d'abord sensiblement lorsqu'on refroidit le matériau pour se stabiliser à 10 000 en dessous de 4 K, sans diverger à la température de Curie comme le ferait un matériau ferroélectrique. La résistivité du SrTiO3 dépasse 109 Ω cm pour les cristaux très purs. Il est également utilisé dans les condensateurs haute tension. L'introduction par dopage de porteurs de charge mobiles induit un comportement de liquide de Fermi métallique dès les très faibles densités de porteurs[13]. Aux densités électroniques élevées, le titanate de strontium devient supraconducteur en dessous de 0,35 K[14] et fut le premier cas de supraconductivité observée dans un oxyde isolant[15].
Les lacunes d'oxygène sont relativement abondantes dans les cristaux et les couches minces de SrTiO3. Ces lacunes injectent des électrons libres dans la bande de conduction du matériau, ce qui le rend plus conducteur et opaque. Elles peuvent résulter d'une exposition à des conditions réductrices, telles qu'un vide poussé à des températures élevées. Le dopage du titanate de strontium avec du niobium en fait un conducteur électrique (environ 55 S/cm à 650 °C pour le SrTi0,98Nb0,02O3-δ[16], où δ est l'écart à la stœchiométrie dû aux lacunes d'oxygène), de fait l'un des rares substrats monocristallins conducteurs disponibles dans le commerce pour la croissance d'oxydes de structure pérovskite.
-
Substrats monocristallins de SrTiO3 pur (à gauche) et dopé au niobium (à droite). -
Monocristal de SrTiO3 synthétique.
Le SrTiO3 présente une photoconductivité persistante par laquelle l'exposition du cristal à la lumière accroît sa conductivité électrique de plus de deux ordres de grandeur ; une fois dans l'obscurité, la conductivité accrue persiste pendant quelques jours sans décroître significativement[17]. Sa conduction à la fois ionique et électronique font du SrTiO3 un possible conducteur mixte (en)[18].
Diélectriques
Le titanate de strontium est cubique et paraélectrique à température ambiante. Dans sa phase quadratique, de 105 à 50 K, sa susceptibilité électrique suit une loi de Curie-Weiss à partir de laquelle on peut extrapoler une température de transition vers un état ferroélectrique aux alentours de 36 K. Toutefois, cette transition n'est pas observée expérimentalement : à basse température, sa permittivité augmente considérablement en s'écartant de la loi de Curie-Weiss, mais le cristal reste paraélectrique. L'explication couramment admise est que des fluctuations quantiques bloquent cette transition : on parle de matériau paraélectrique quantique.
Cet état paraélectrique est très fragile et très sensible à la composition. La substitution de l'oxygène 16 par son isotope 18O suffit à rendre le cristal ferroélectrique à basses températures[19]. La substitution du strontium par d'autres cations (calcium, baryum, plomb, cadmium) permet également d'obtenir un état ferroélectrique pour des taux très faibles de substitution[20].
Production et gisements naturels
Production
Le titanate de strontium synthétique fut l'un des titanates brevetés à la fin des années 1940 et au début des années 1950, avec notamment le titanate de baryum BaTiO3 et le titanate de calcium CaTiO3. On utilise une version modifiée du procédé Verneuil avec un soufflet à bouche traitant une poudre de précurseurs mélangés avec de l'oxyhydrogène et un excès d'oxygène pour assurer la formation du titanate par oxydation complète du titane. Le rapport des volumes d'hydrogène et d'oxygène est 3:2. La poudre de précurseurs est obtenue à partir d'un sel de double oxalate de titanyle SrTiO(C2O4)2·2H2O lui-même obtenu en faisant réagir du chlorure de strontium SrCl2 et de l'acide oxalique HOOC–COOH avec du tétrachlorure de titane TiCl4. Le sel est lavé pour en éliminer le chlorure, puis chauffé à 1 000 °C pour obtenir la poudre de composition souhaitée, et enfin broyé et tamisé pour s'assurer que tous les grains ont une taille comprise entre 0,2 et 0,5 µm[21]. La poudre obtenue s'écoule à travers la flamme d'oxyhydrogène dans laquelle elle fond et est récupérée en dessous sur un socle qui tourne lentement et dont la hauteur est constamment ajustée pour maintenir son sommet dans la position optimale sous la flamme. Le matériau fondu se refroidit ainsi sur le socle en cristallisant et s'accumule avec le temps pour former une masse allongée qui ne dépasse généralement pas 2,5 cm de diamètre et 10 cm de long. Le matériau initial est opaque et noir, et nécessite un recuit supplémentaire sous atmosphère oxydante afin de rendre le cristal incolore et d'en réduire les contraintes internes. Cela se fait à plus de 1 000 °C pendant une douzaine d'heures[21].
On peut faire croître des couches minces de SrTiO3 par épitaxie de plusieurs manières, comme l'ablation laser pulsé, l'épitaxie par jet moléculaire, la pulvérisation cathodique radiofréquence et l'Atomic Layer Deposition. Ces différentes méthodes conduisent à des matériaux ayant des défauts, des taux d'impuretés et des qualités cristallines très variables, d'où des propriétés optiques et électroniques également très variables.
Gisements naturels
On trouve le titanate de strontium à l'état naturel dans un minéral rare appelé tausonite (en), en hommage au minéralogiste russe Lev Vladimirovich Tauson. Sa présence a été rapportée pour la première fois en 1982 dans le massif de l'Aldan en Sibérie orientale où il fut trouvé sous forme de grains irréguliers et de cristaux cubiques ou cuboctaèdriques de taille allant jusqu'à 2 mm. Ces cristaux présentent des couleurs variant du rouge au brun en fonction des impuretés qu'ils contiennent. Des traces de calcium, de baryum, de lanthane et quelques autres éléments y ont été détectées[22].
Applications
Son indice de réfraction élevé fait du titanate de strontium un matériau utile pour les composants optiques et comme fenêtre dans le domaine infrarouge. C'est également un substrat très couramment employé pour faire croître des couches minces de divers oxydes partageant une structure pérovskite semblable[23], notamment les supraconducteurs à haute température tels que ceux à cuprates, comme YBa2Cu3O7. Les lacunes d'oxygène des cristaux de SrTiO3 leurs confèrent des propriétés électroniques permettant d'envisager leur application aux memristors[24].
Le titanate de strontium 90, noté 90SrTiO3, a été utilisé essentiellement au XXe siècle comme matrice céramique contenant du strontium 90, alternative meilleur marché au plutonium 238 pour les générateurs thermoélectriques à radioisotope destinés à alimenter des installations militaires sous-marines ou isolées, notamment par l'URSS en Arctique du temps de la guerre froide[25].
En micro-électronique
Le titanate de strontium SrTiO3) est un isolant électrique qui peut devenir conducteur quand il est électroniquement dopé, par exemple en y générant des lacunes d'oxygène par exemple. Les interfaces entre le SrTiO3 et certains oxydes, comme le titanate de lanthane LaTiO3 ou l'aluminate de lanthane LaAlO3, sont par ailleurs naturellement conductrices, bien que ces matériaux soient tous isolants pris séparément. De plus, leurs rendements en termes de supraconductivité, magnétorésistance et thermoélectricité sont parmi les meilleurs à température ambiante. Une difficulté à résoudre est que ces oxydes sont difficiles à interfacer.
Lors d'une expérience faite au synchrotron SOLEIL à Saint-Aubin (France), en brisant sous vide un morceau de titanate de strontium[26], on a réussi à produire une couche gazeuse bidimentionnelle de deux nanomètres d'épaisseur, conductrice, à la surface d'une couche (isolante) de titanate de strontium[27]. Facile à réaliser, cette couche de gaz d'électrons métallique pourrait doper l'électronique à base d'oxydes de métaux de transition de la famille du SrTiO3 qui intéresse beaucoup les chercheurs en raison de propriétés physiques telles que :
- supraconductivité ;
- magnétisme ;
- magnétorésistance ; avec une changement de la résistance, de plusieurs ordres de grandeur, sous l'effet d'un faible champ magnétique (principe du disque dur) ;
- multi-ferroïcité ; ex : ferroélectricité, ferromagnétisme et/ou ferroélasticité conjointes de quelques oxydes de fer ou de manganèse ;
- photocatalyse ; ex : capacité de certains oxydes de titane, en présence d'UV à casser l'eau en hydrogène et oxygène ;
- thermoélectricité (qui permettrait par exemple de recycler en électricité une partie de la chaleur fatale perdue par un ordinateur), etc.
En particulier des dispositifs microélectroniques multifonctionnels (transistor à plusieurs fonctions par exemple) semblent devenir possibles[27].
Piles à combustible à oxyde solide
La conductivité mixte (en) du titanate de strontium le rend intéressant pour le développement de piles à combustible à oxyde solide (SOFC). Ce matériau présente en effet une conductivité électrique à la fois électronique et ionique qui peut être mise à profit dans de tels dispositifs où sont échangés à la fois des ions et des électrons des deux côtés de la pile :
Le titanate de strontium est dopé avec des éléments différents de chaque côté de la pile. Du côté combustible (anode), où se déroule la première réaction, il est généralement dopé au lanthane, pour donner du LST. Dans ce cas, certains atomes de strontium des sites A sont remplacés par des atomes de lanthane, ce qui confère au matériau des propriétés de semiconducteur de type n, dont la conductivité électrique. Il permet également une conduction par anions oxyde O2– compte tenu de la tolérance de la structure pérovskite pour les lacunes d'oxygène. Son coefficient de dilatation thermique est semblable à celui de la zircone stabilisée à l'oxyde d'yttrium (YSZ), reste chimiquement stable pendant les réactions qui se déroulent à l'anode, et présente une conducivité électrique atteignant 360 S/cm aux conditions d'exploitation haute température des piles à combustible à oxyde solide[28]. Il résiste également à l'empoisonnement au soufre qui affecte les anodes en cermet nickel-céramique[29].
Des céramiques SrTi1−x Fex O3−δ (STF), où x varie généralement de 0,05 à 0,80 et δ est l'écart à la stœchiométrie, peuvent être utilisées côté comburant (cathode) car la diffusion ionique qu'ils permettent accroît la surface sur laquelle se déroule la réaction[30]. Une variante de ce matériau consiste à substituer certains atomes de titane des sites B par du cobalt en plus du fer, ce qui donne des composés SrTi1−x−y Fex Coy O3−δ (STFC) très stables et à faible résistance de polarisation comparativement à d'autres matériaux couramment utilisés côté cathode, comme les ferrites de cobalt, de strontium et de lanthane ; dépourvues de terres rares, ces cathodes sont également moins chères[31].
En joaillerie : la fabulite
Le titanate de strontium fut utilisé comme imitation du diamant sous le nom de « fabulite » entre les années 1955 et 1970. Si les indices de réfraction des deux minéraux sont très proches (2,417 contre 2,41 pour le diamant), la fabulite a une dispersion, et donc un feu, beaucoup plus forte que le diamant. De plus, la fabulite se raye facilement, contrairement au diamant. Cet usage fut abandonné à partir des années 1970 avec la production d'imitations de meilleure qualité (la zircone d'abord, puis la moissanite en 1998)[32].
Notes et références
- Entrée « Strontium titanate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 septembre 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Lütfi Bilal Taşyürek, Melike Sevim, Zakir Çaldıran, Sakir Aydogan et Önder Metin, « The synthesis of SrTiO3 nanocubes and the analysis of nearly ideal diode application of Ni/SrTiO3 nanocubes/n-Si heterojunctions », Materials Research Express, vol. 5, no 1, , article no 015060 (DOI 10.1088/2053-1591/aaa745, Bibcode 2018MRE.....5a5060B, lire en ligne)
- (en) K. A. Müller et H. Burkard, « SrTiO3: An intrinsic quantum paraelectric below 4 K », Physical Review B, vol. 19, no 7, , p. 3593-3602 (DOI 10.1103/PhysRevB.19.3593, Bibcode 1979PhRvB..19.3593M, lire en ligne)
- (en) « Tausonite », sur https://www.mindat.org/, Mindat.org (consulté le ).
- Sur le site de Diamants-infos
- (en) « Tausonite Mineral Data », sur http://webmineral.com/ (consulté le ).
- (en) Christian Rodenbücher, Paul Meuffels, Wolfgang Speier, Martin Ermrich, Dominik Wrana, Franciszek Krok et Kristof Szot, « Stability and Decomposition of Perovskite‐Type Titanates upon High‐Temperature Reduction », physica status solidi (RRL) - Rapid Research Letters, vol. 11, no 9, , p. 1700222 (DOI 10.1002/pssr.201700222, Bibcode 2017PSSRR..1100222R, lire en ligne)
- (en) L. Rimai et G. A. deMars, « Electron Paramagnetic Resonance of Trivalent Gadolinium Ions in Strontium and Barium Titanates », Physical Review Journals Archive, vol. 127, no 3, , p. 702-710 (DOI 10.1103/PhysRev.127.702, Bibcode 1962PhRv..127..702R, lire en ligne)
- (en) S. A. Hayward et E. K. H. Salje, « Cubic-tetragonal phase transition in SrTiO3 revisited: Landau theory and transition mechanism », Phase Transitions, vol. 68, no 3, , p. 501-522 (DOI 10.1080/01411599908224530, lire en ligne)
- (en) R. A. McKee, F. J. Walker et M. F. Chisholm, « Crystalline Oxides on Silicon: The First Five Monolayers », Physical Review Letters, vol. 81, no 14, , p. 3014-3017 (DOI 10.1103/PhysRevLett.81.3014, Bibcode 1998PhRvL..81.3014M, lire en ligne)
- (en) K. van Benthem et C. Elsässer, « Bulk electronic structure of SrTiO3: Experiment and theory », Journal of Applied Physics, vol. 90, no 12, , p. 6156-6164 (DOI 10.1063/1.1415766, Bibcode 2001JAP....90.6156V, lire en ligne)
- (en) Xiao Lin, Benoît Fauqué et Kamran Behnia, « Scalable T2 resistivity in a small single-component Fermi surface », Science, vol. 349, no 6251, , p. 945-948 (PMID 26315430, DOI 10.1126/science.aaa8655, Bibcode 2015Sci...349..945L, arXiv 1508.07812, lire en ligne)
- (en) Clément Collignon, Xiao Lin, Carl Willem Rischau, Benoît Fauqué et Kamran Behnia, « Metallicity and Superconductivity in Doped Strontium Titanate », Annual Review of Condensed Matter Physics, vol. 10, , p. 25-44 (DOI 10.1146/annurev-conmatphys-031218-013144, Bibcode 2019ARCMP..10...25C, arXiv 1804.07067, lire en ligne)
- (en) C. S. Koonce, Marvin L. Cohen, J. F. Schooley, W. R. Hosler et E. R. Pfeiffer, « Superconducting Transition Temperatures of Semiconducting SrTiO3 », Physical Review Journals Archive, vol. 163, no 2, , p. 380-389 (DOI 10.1103/PhysRev.163.380, Bibcode 1967PhRv..163..380K, lire en ligne)
- (en) J. Karczewski, B. Riegel, M. Gazda, P. Jasinski et B. Kusz, « Electrical and structural properties of Nb-doped SrTiO3 ceramics », Journal of Electroceramics, vol. 24, , p. 326-330 (DOI 10.1007/s10832-009-9578-7, lire en ligne)
- (en) Marianne C. Tarun, Farida A. Selim et Matthew D. McCluskey, « Persistent Photoconductivity in Strontium Titanate », Physical Review Letters, vol. 111, no 18, , article no 187403 (PMID 24237562, DOI 10.1103/PhysRevLett.111.187403, Bibcode 2013PhRvL.111r7403T, lire en ligne)
- (en) « Mixed conductors », sur https://www.fkf.mpg.de/, Institut Max-Planck de recherche sur l'état solide (consulté le ).
- (en) M. Itoh, R. Wang, Y. Inaguma, T. Yamaguchi, Y-J. Shan et T. Nakamura, « Ferroelectricity Induced by Oxygen Isotope Exchange in Strontium Titanate Perovskite », Physical Review Letters, vol. 82, no 17, , p. 3540-3543 (DOI 10.1103/PhysRevLett.82.3540, Bibcode 1999PhRvL..82.3540I, lire en ligne)
- (en) V. V. Lemanov, « Improper ferroelastic SrTiO3 and what we know today about its properties », Ferroelectrics, vol. 265, no 1, , p. 1-21 (DOI 10.1080/00150190208260600, lire en ligne), p. 8
- (en) H. J. Scheel et P. Capper, Crystal growth technology: from fundamentals and simulation to large-scale production, Wiley-VCH, 2008, p. 431. (ISBN 978-3-527-31762-2)
- (en) Pete J. Dunn, George Y. Chao, Michael Fleischer, James A. Ferraiolo, Richard H. Langley, Adolf Pabst et Janet A. Zilczer, « New Mineral Names », American Mineralogist, vol. 70, , p. 214-221 (lire en ligne), p. 218.
- (en) Florencio Sánchez, Carmen Ocal et Josep Fontcuberta, « Tailored surfaces of perovskite oxide substrates for conducted growth of thin films », Chemical Society Reviews, vol. 43, no 7, , p. 2272-2285 (PMID 24553667, DOI 10.1039/c3cs60434a, Bibcode 2014arXiv1403.7655S, arXiv 1403.7655, lire en ligne)
- (en) Taimur Ahmed, Sumeet Walia, Edwin L. H. Mayes, Rajesh Ramanathan, Paul Guagliardo, Vipul Bansal, Madhu Bhaskaran, J. Joshua Yang et Sharath Sriram, « Inducing tunable switching behavior in a single memristor », Applied Materials Today, vol. 11, , p. 280-290 (DOI 10.1016/j.apmt.2018.03.003, lire en ligne)
- (en) « Radioisotope Thermoelectric Generators », sur http://www.bellona.no/bellona.org/, Fondation Bellona, (consulté le ).
- Communiqué CNRS, intitulé Microélectronique : un gaz d'électrons à la surface d'un isolant ouvre la voie du transistor multi-fonctions, Paris, 2011-01-12
- (en) A.F. Santander-Syro, O. Copie, T. Kondo et al., « Two-dimensional electron gas with universal subbands at the surface of SrTiO3 », Nature, vol. 469, , p. 189-193 (DOI 10.1038/nature09720)
- (en) Olga A. Marina, Nathan L. Canfield et Jeff W. Stevenson, « Thermal, electrical, and electrocatalytical properties of lanthanum-doped strontium titanate », Solid State Ionics, vol. 149, nos 1-2, , p. 21-28 (DOI 10.1016/S0167-2738(02)00140-6, lire en ligne)
- (en) Mingyang Gong, Xingbo Liu, Jason Trembly, Christopher Johnson, « Sulfur-tolerant anode materials for solid oxide fuel cell application », Journal of Power Sources, vol. 168, no 2, , p. 289-298 (DOI 10.1016/j.jpowsour.2007.03.026, Bibcode 2007JPS...168..289G, lire en ligne)
- (en) WooChul Jung et Harry L. Tuller, « Impedance study of SrTi1−xFexO3−δ (x = 0.05 to 0.80) mixed ionic-electronic conducting model cathode », Solid State Ionics, vol. 180, nos 11-13, , p. 843-847 (DOI 10.1016/j.ssi.2009.02.008, lire en ligne)
- (en) Shan-Lin Zhang, Hongqian Wang, Matthew Y. Lu, Ai-Ping Zhang, Liliana V. Mogni, Qinyuan Liu, Cheng-Xin Li, Chang-Jiu Li et Scott A. Barnett, « Cobalt-substituted SrTi0.3Fe0.7O3−δ: a stable high-performance oxygen electrode material for intermediate-temperature solid oxide electrochemical cells », Energy & Environmental Science, vol. 11, no 7, , p. 1870-1879 (DOI 10.1039/c8ee00449h, lire en ligne)
- Diamants synthétiques sur allaboutgemstones.com