Bronchectasie
| Médicament | Acétylcystéine, tobramycine et tiotropium |
|---|---|
| Spécialité | Pneumologie |
| CISP-2 | R99 |
|---|---|
| CIM-10 | J47, Q33.4 |
| CIM-9 | 494, 748.61 |
| OMIM | 613021 et 613071 211400, 613021 et 613071 |
| DiseasesDB | 1684 |
| MedlinePlus | 000144 |
| eMedicine | 296961 |
| MeSH | D001987 |
| Patient UK | Bronchiectasis-pro |
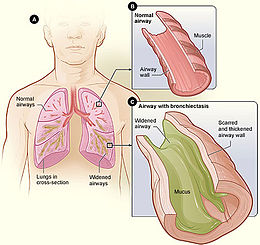
La bronchectasie ou bronchiectasie ou dilatation des bronches (DDB) est une dilatation des bronches chronique, le plus souvent acquise à la suite d'une maladie des bronches, du poumon ou de la plèvre. Elle est caractérisée par une dilatation des bronches de petit et moyen calibre et s'accompagne souvent d'une expectoration mucopurulente abondante, qui traduit l'infection surajoutée. Elles peuvent être localisées ou diffuses.
Un syndrome obstructif se développe. On a plus souvent un trouble ventilatoire mixte (baisse de la capacité pulmonaire totale et baisse du rapport de Tiffeneau (VEMS/CVF) en spirométrie).
Histoire
[modifier | modifier le code]La dilatation des bronches a été décrite pour la première fois par René Laënnec en 1819[1]. La première résection pulmonaire pour cette maladie a été réalisée en 1901 par Lothar Heidenhain et les premières imageries en 1922 par JA Sicard[1]. Le traitement est demeuré principalement chirurgical jusqu'à l'introduction des antibiotiques dans les années 1950, qui ont révolutionné la prise en charge[1]. Les hospitalisations pour des épisodes de surinfection ont ainsi été divisées par 5 au Royaume-Uni entre 1952 et 1960[2].
Définition
[modifier | modifier le code]Une bronchectasie, ou dilatation des bronches, est une anomalie morphologique correspondant à une augmentation de calibre permanente de tout ou partie de l'arbre bronchique[3]. On distingue ensuite les formes diffuses des formes localisées, et les dilatations cylindriques, variqueuses, ou sacciformes[3]. C'est une atteinte des bronches et des bronchioles.
-
Comparaison entre bronche saine et bronche dilatée.
-
Aspect macroscopique
-
Aspect microscopique. La lumière bronchique est ici occupée par un aspergillome.
Épidémiologie
[modifier | modifier le code]La prévalence globale des lésions de bronchectasie est mal connue, mais est plus élevée dans les populations défavorisées[3]. Adultes et enfants sont touchés par la maladie.
Chez les enfants et les adolescents des pays européens[1], l'incidence annuelle est en moyenne de 0,2 pour 100 000 (au Royaume-Uni en 2006-2007[4]) à 2,3 pour 100 000 (en Irlande, de 1996 à 2006)[5]. Dans les pays riches tels que la Nouvelle-Zélande, les Emirats arabes unis et les Etats-Unis d'Amérique, les enfants des populations pauvres sont touchés de manière disproportionnée par les dilatations des bronches[1]. Ainsi, en Nouvelle-Zélande, l'incidence annuelle parmi les enfants maoris est de 4,8 à 7,9 pour 100 000, contre 1,5 pour 100 000 pour les enfants d'ascendance européenne[1]. De même, les enfants aborigènes australiens et les enfants autochtones d'Alaska présentent des incidences de la maladie pouvant atteindre 140 à 735 pour 100 000[1]. Ces disparités sont directement reliées à la pauvreté[1],[6].
Chez les adultes, aux Etats-Unis en 2001[7], la prévalence est de 4,2 pour 100 000 de 18 à 34 ans, et s'élève à 271,8 pour 100 000 chez les plus de 75 ans. Les femmes sont également plus touchées que les hommes, de 1,5 à 2 fois plus. La diminution globale du nombre de nouveaux cas par an explique la fréquence moins élevée chez les gens plus jeunes[3],[7].
Causes
[modifier | modifier le code]La cause des bronchectasies n'est souvent pas retrouvée. Dans 36[8] à 56 %[9] des cas, on parle alors de dilatation des bronches idiopathique. Lorsqu'une cause est identifiée, elle est le plus souvent infectieuse[8], mais peut aussi être causée par une dyskinésie ciliaire, une aspergillose pulmonaire allergique, ou un déficit immunitaire[8]. Les différentes formes morphologiques identifiées n'influencent ni la prise en charge, ni le pronostic[10].
Formes localisées
[modifier | modifier le code]Trois types de mécanismes peuvent mener à des bronchectasies localisées[3] : obstruction bronchique par un corps étranger ou une tumeur endobronchique (le plus souvent bénigne), compression extrinsèque de la bronche par des adénopathies péri-bronchiques (par exemple dans le cadre de granulomatoses), et enfin des tractions exercées sur l'arbre bronchique après remaniement après lobectomie pulmonaire.
Dans les deux premiers cas, les patients présentent souvent des pneumopathies à répétition[3]. Le traitement relève alors de la chirurgie, ou parfois de la bronchoscopie.
Formes diffuses
[modifier | modifier le code]Les bronchectasies diffuses s'inscrivent dans le cadre de maladies plus générales[3],[10], infectieuses (séquelles de tuberculose pulmonaire, aspergillose pulmonaire allergique), génétiques (mucoviscidose et autres dyskinésies ciliaires comme le syndrome de Kartagener) ou congénitales (séquestration pulmonaire), mais aussi immunitaires (déficits congénitaux en immunoglobulines). Les maladies de système telles que la polyarthrite rhumatoïde, le lupus, ou le syndrome de Sjögren, sont également susceptibles de fournir des atteintes bronchiques[3]. L'inhalation de gaz chloré peut aussi être en cause[3]. La pollution de l'air intérieur des habitations a également été mise en cause, notamment par l'utilisation de feux ouverts pour le chauffage et la cuisine[11], mais aussi le tabagisme passif[6].
Manifestations cliniques
[modifier | modifier le code]Quelle que soit la cause, le tableau clinique est dominé par une toux chronique surtout dans la forme diffuse, avec importante production de crachats[3],[10]. Les crachats peuvent être clairs, ou au contraire purulents, parfois teintés de sang, en particulier en cas de surinfection bronchique. L'abondance des crachats, leur couleur, et leur viscosité, sont très variables et peu spécifiques[10]. Les trois quarts des patients décrivent aussi une dyspnée, et la moitié des douleurs thoraciques[3] d'autres symptômes peuvent être présents, dépendant de l’évolution de la maladie. En cas d'insuffisance respiratoire un essoufflement très important apparaît, l'hypoxie et l'hypercapnie entraînent une importante faiblesse musculaire, des maux de tète, des sueurs, un larmoiement, une injection conjonctivale, des somnolences, de la torpeur avec troubles de la conscience pouvant aller jusqu'au coma [1]
L'auscultation pulmonaire est souvent anormale, avec des crépitants (70 % des cas), des ronchis (44 % des cas) et des sibilants (34 % des cas)[3]. Il n'y a cependant pas de lien entre la normalité de l'auscultation et la sévérité des lésions observées au scanner[10].
L'hippocratisme digital, autrefois considéré comme constant, n'est observé aujourd'hui que dans environ 5 % des cas [3] et il est plutôt causé par l’hypoxémie qui est le manque d’oxygène transporté dans le sang que les bronchectasies elle-même.
Diagnostic différentiel
[modifier | modifier le code]Un tableau de toux chronique doit faire éliminer et rechercher une infection ORL chronique avec rhinorrhée postérieure, mais aussi un asthme, un reflux gastro-œsophagien (RGO), et une BPCO[3],[10]. Une étude de 1995 a en effet retrouvé, devant un tableau de toux chronique avec crachats, des causes ORL chez 40 % des patients, un asthme chez 24 % d'entre eux, un RGO dans 15 % des cas, et une BPCO dans 11 % des cas, les dilatations des bronches ne composant que 4 % des diagnostics[10],[12]. Les diagnostics différentiels plus rares comprennent les bronchites à éosinophiles, et les infections bactériennes chroniques de l'arbre respiratoire[10],[13].
Surinfections
[modifier | modifier le code]Colonisation à P. aeruginosa
[modifier | modifier le code]La colonisation de l'arbre bronchique à Pseudomonas aeruginosa est corrélée à la dégradation de la fonction respiratoire et la progression de la maladie[14],[15]. Les patients porteurs de P. aeruginosa sont plus à risque de présenter des épisodes de surinfection, et voient leur mortalité augmenter, toutes causes confondues[16],[9],[17].
Certains parlent ainsi plutôt d'infection chronique que de colonisation[16]. En Europe, 15 % des patients porteurs de bronchiectasies présentent une infection chronique à P. aeruginosa[17].
La solution pour inhalation de tobramycine est une option de traitement efficace et présente un profil d'innocuité acceptable chez les patients atteints de bronchectasie avec infection à Pseudomonas aeruginosa[18].
Examens complémentaires
[modifier | modifier le code]Aspect radiologique
[modifier | modifier le code]En raison du caractère morphologique de la définition des bronchectasies, le diagnostic dépend de l'observation radiologique des lésions[10].
Il est parfois possible d'observer des bronchectasies sur une radiographie pulmonaire, mais l'examen de référence est la tomodensitométrie[10],[3].
Explorations fonctionnelles respiratoires
[modifier | modifier le code]L'obstruction observée est liée à l'atteinte de l'arbre bronchique distal[19]. Les lésions des bronches lobaires, de même que l'emphysème, n'ont en effet pas d'impact sur les EFR[19].
Evolution
[modifier | modifier le code]- Emphysèmes de bronchectasie
- Insuffisance respiratoire chronique
- Hypertension pulmonaire
- Cœur pulmonaire (insuffisance cardiaque droite)
Traitement médical
[modifier | modifier le code]- Kinésithérapie respiratoire ; apprentissage de la toilette bronchique ;
- bronchodilatateurs ;
- oxygénothérapie normobare ;
- antibiothérapie en cas de poussée de surinfection ;
- mucolytiques et mucorégulateurs : souvent utilisés mais n'ont pas fait la preuve de leur efficacité (service médical rendu insuffisant) ;
- aérosolthérapie : notamment dans la mucoviscidose: aérosols d'antibiotiques (Tobi par exemple) en cas de surinfection par le pyocyanique ;
- embolisation artérielle bronchique en cas d'hémoptysie majeure ;
- vaccin antipneumococcique polysaccharide (Pneumo 23) ;
- vaccin contre la grippe saisonnière, notamment à Influenzavirus A sous-type H5N1 ;
- soins ORL ;
- suppression du tabac et des autres irritants bronchiques ;
- les antitussif opiacés sont contre-indiqués.
Traitement chirurgical
[modifier | modifier le code]Le traitement chirurgical est réservé aux formes localisées symptomatiques et affectant la qualité de vie du malade. Les bronchectasies, comme toutes les maladies respiratoires chroniques, peuvent être très invalidantes pour les personnes atteintes
Pronostic et suivi
[modifier | modifier le code]La mortalité est principalement le fait d'infections respiratoires ou de détresse respiratoire aiguë souvent causées par l’aggravation brutale de l'insuffisance respiratoire chronique[9]. Le risque de mortalité est augmenté par l'étendue des lésions, la sévérité de l'atteinte respiratoire (VEMS et DLCO), et par le retentissement clinique, en particulier une dyspnée plus sévère[9]. Il n'y a en revanche pas de différence de risque selon l'étiologie[9]. Un âge plus élevé, le sexe masculin, et la colonisation bronchique à Pseudomonas aeruginosa sont d'autres facteurs de risque[9].
Notes et références
[modifier | modifier le code]- Gabrielle B. McCallum et Michael J. Binks, « The Epidemiology of Chronic Suppurative Lung Disease and Bronchiectasis in Children and Adolescents », Frontiers in Pediatrics, vol. 5, (ISSN 2296-2360, PMID 28265556, PMCID PMC5316980, DOI 10.3389/fped.2017.00027, lire en ligne, consulté le )
- C. E. Field, « Bronchiectasis. Third report on a follow-up study of medical and surgical cases from childhood », Archives of Disease in Childhood, vol. 44, no 237, , p. 551–561 (ISSN 1468-2044, PMID 5345322, PMCID PMC2020072, lire en ligne, consulté le )
- Alan F. Barker, « Bronchiectasis », New England Journal of Medicine, vol. 346, no 18, , p. 1383–1393 (ISSN 0028-4793, PMID 11986413, DOI 10.1056/NEJMra012519, lire en ligne, consulté le )
- A. Laverty, A. Jaffé et S. Cunningham, « Establishment of a web-based registry for rare (orphan) pediatric lung diseases in the United Kingdom: the BPOLD registry », Pediatric Pulmonology, vol. 43, no 5, , p. 451–456 (ISSN 1099-0496, PMID 18383113, DOI 10.1002/ppul.20783, lire en ligne, consulté le )
- A. A. Zaid, B. Elnazir et P. Greally, « A decade of non-cystic fibrosis bronchiectasis 1996-2006 », Irish Medical Journal, vol. 103, no 3, , p. 77–79 (ISSN 0332-3102, PMID 20666070, lire en ligne, consulté le )
- Thomas Kovesi, « Respiratory disease in Canadian First Nations and Inuit children », Paediatrics & Child Health, vol. 17, no 7, , p. 376–380 (ISSN 1205-7088, PMID 23904781, PMCID PMC3448538, lire en ligne, consulté le )
- (en) Derek Weycker, John Edelsberg, Gerry Oster et Gregory Tino, « Prevalence and Economic Burden of Bronchiectasis », Clinical Pulmonary Medicine, vol. 12, no 4, , p. 205–209 (DOI 10.1097/01.cpm.0000171422.98696.ed, lire en ligne, consulté le )
- (en) A. Shoemark, L. Ozerovitch et R. Wilson, « Aetiology in adult patients with bronchiectasis », Respiratory Medicine, vol. 101, no 6, , p. 1163–1170 (DOI 10.1016/j.rmed.2006.11.008, lire en ligne, consulté le )
- (en) M. R. Loebinger, A. U. Wells, D. M. Hansell et N. Chinyanganya, « Mortality in bronchiectasis: a long-term study assessing the factors influencing survival », European Respiratory Journal, vol. 34, no 4, , p. 843–849 (ISSN 0903-1936 et 1399-3003, PMID 19357155, DOI 10.1183/09031936.00003709, lire en ligne, consulté le )
- Rosen et coll 2006
- Stephen B. Gordon, Nigel G. Bruce, Jonathan Grigg et Patricia L. Hibberd, « Respiratory risks from household air pollution in low and middle income countries », The Lancet. Respiratory Medicine, vol. 2, no 10, , p. 823–860 (ISSN 2213-2619, PMID 25193349, PMCID PMC5068561, DOI 10.1016/S2213-2600(14)70168-7, lire en ligne, consulté le )
- (en) Nicholas A. Smyrnios, Richard S. Irwin et Frederick J. Curley, « Chronic Cough with a History of Excessive Sputum Production », Chest, vol. 108, no 4, , p. 991–997 (ISSN 0012-3692, DOI 10.1378/chest.108.4.991, lire en ligne, consulté le )
- (en) Christopher E. Brightling, Richard Ward, Kah Lay Goh et Andrew J Wardlaw, « Eosinophilic Bronchitis Is an Important Cause of Chronic Cough », American Journal of Respiratory and Critical Care Medicine, vol. 160, no 2, , p. 406–410 (DOI 10.1164/ajrccm.160.2.9810100, lire en ligne, consulté le )
- (en) S. A. Evans, S. M. Turner, B. J. Bosch et C. C. Hardy, « Lung function in bronchiectasis: the influence of Pseudomonas aeruginosa », European Respiratory Journal, vol. 9, no 8, , p. 1601–1604 (ISSN 0903-1936 et 1399-3003, PMID 8866579, lire en ligne, consulté le )
- (en) C. B. Wilson, P. W. Jones, C. J. O'Leary et D. M. Hansell, « Systemic markers of inflammation in stable bronchiectasis », European Respiratory Journal, vol. 12, no 4, , p. 820–824 (ISSN 0903-1936 et 1399-3003, PMID 9817152, lire en ligne, consulté le )
- (en) Simon Finch, Melissa J McDonnell, Hani Abo-Leyah et Stefano Aliberti, « A Comprehensive Analysis of the Impact ofPseudomonas aeruginosaColonisation on Prognosis in Adult Bronchiectasis », Annals of the American Thoracic Society, (DOI 10.1513/annalsats.201506-333oc, lire en ligne, consulté le )
- (en) James D. Chalmers, Simon Finch, Michal Shteinberg et Pieter Goeminne, « Late Breaking Abstract - The prevalence and burden of Pseudomonas aeruginosa among bronchiectasis patients in Europe- data from the FRIENDS cohort », European Respiratory Journal, vol. 50, no suppl 61, , OA1967 (ISSN 0903-1936 et 1399-3003, DOI 10.1183/1393003.congress-2017.OA1967, lire en ligne, consulté le )
- Wei-Jie Guan, Jin-Fu Xu, Hong Luo et Xing-Xiang Xu, « A Double-Blind Randomized Placebo-Controlled Phase 3 Trial of Tobramycin Inhalation Solution in Adults With Bronchiectasis With Pseudomonas aeruginosa Infection », Chest, , S0012–3692(22)01247–8 (ISSN 1931-3543, PMID 35863486, DOI 10.1016/j.chest.2022.07.007, lire en ligne, consulté le )
- (en) H. R. Roberts, A. U. Wells, D. G. Milne et M. B. Rubens, « Airflow obstruction in bronchiectasis: correlation between computed tomography features and pulmonary function tests », Thorax, vol. 55, no 3, , p. 198–204 (ISSN 0040-6376 et 1468-3296, PMID 10679538, DOI 10.1136/thorax.55.3.198, lire en ligne, consulté le )
Annexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]Articles généraux
[modifier | modifier le code]Recommandations des sociétés savantes
[modifier | modifier le code]- (en) Mark J. Rosen, « Chronic Cough Due to Bronchiectasis: ACCP Evidence-Based Clinical Practice Guidelines », Chest, Elsevier BV, vol. 129, no 1, , p. 122S-131S (ISSN 0012-3692, DOI 10.1378/chest.129.1_suppl.122s, lire en ligne) ;
- (en) M. C. Pasteur, D. Bilton et A. T. Hill, « British Thoracic Society guideline for non-CFbronchiectasis », Thorax, BMJ, vol. 65, no Suppl 1, , i1-i58 (ISSN 0040-6376, DOI 10.1136/thx.2010.136119, lire en ligne) ;
- (en) Eva Polverino, Pieter C. Goeminne, Melissa J. McDonnell, Stefano Aliberti, Sara E. Marshall, Michael R. Loebinger, Marlene Murris, Rafael Cantón, Antoni Torres, Katerina Dimakou, Anthony De Soyza, Adam T. Hill, Charles S. Haworth, Montserrat Vendrell, Felix C. Ringshausen, Dragan Subotic, Robert Wilson, Jordi Vilaró, Bjorn Stallberg, Tobias Welte, Gernot Rohde, Francesco Blasi, Stuart Elborn, Marta Almagro, Alan Timothy, Thomas Ruddy, Thomy Tonia, David Rigau et James D. Chalmers, « European Respiratory Society guidelines for the management of adult bronchiectasis », European Respiratory Journal, European Respiratory Society (ERS), vol. 50, no 3, , p. 1700629 (ISSN 0903-1936, DOI 10.1183/13993003.00629-2017, lire en ligne).
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- Ressources relatives à la santé :
- « DDB - Dilatation des bronches », sur Fondation du Souffle (consulté le ) ;
- A. Taytard et P. Delaval, « Dilatations des bronches », sur Respir.com, (consulté le ).