Répétition pentapeptidique
| Pfam | PF00805 |
|---|---|
| InterPro | IPR001646 |
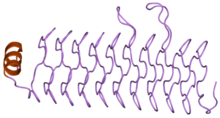
Une répétition pentapeptidique, ou répétition de pentapeptides, est un type de séquence peptidique observé dans les protéines sous forme de copies adjacentes de séquences de cinq résidus d'acides aminés[2],[3]. On les trouve chez toutes les espèces, mais sont particulièrement présentes chez les cyanobactéries. Une telle répétition a été identifiée pour la première fois dans la protéine hglK[4] avant d'être observée dans de nombreuses autres protéines bactériennes[3]. La fonction de ces répétitions n'est pas connue avec certitude dans la plupart des cas, cependant, il a été proposé que celle de la protéine MfpA, un inhibiteur de l'ADN gyrase, reproduit la structure tridimensionnelle de l'ADN[5]. Ces répétitions forment une hélice β droite régulière à quatre côtés appelée repliement Rfr.

Les répétitions pentapeptidiques observées dans les protéines sont à peu près de la forme Ala–(Asp/Asn)–Leu–Xaa–Xaa, soit, en utilisant les codes à une lettre, A(D/N)LXX. La position centrale de ces pentapeptides est généralement occupée par un résidu de leucine et est appelée position i ; les deux positions précédentes sont désignées par i-1 et i-2, tandis que les deux suivantes sont désignées par i+1 et i+2. Le résidu en i-2 est généralement une alanine. Les chaînes latérales des positions i-2 et i pointent vers l'intérieur hydrophobe de la protéine, tandis que les chaînes latérales des positions i-1, i+1 et i+2 sont exposées à la surface de la molécule.
On pensait initialement que les répétitions pentapeptidiques formaient des hélices β droites à trois côtés[3] mais la première structure d'une telle protéine observée par cristallographie aux rayons X a révélé une hélice droite à quatre côtés[5], chaque tour d'hélice étant constitué de quatre répétitions, l'ensemble formant un domaine en solénoïde.
Notes et références[modifier | modifier le code]
- (en) Shuisong Ni, George M. Sheldrick, Matthew M. Benning et Michael A. Kennedy, « The 2 Å resolution crystal structure of HetL, a pentapeptide repeat protein involved in regulation of heterocyst differentiation in the cyanobacterium Nostoc sp. strain PCC 7120 », Journal of Structural Biology, vol. 165, no 1, , p. 47-52 (PMID 18952182, DOI 10.1016/j.jsb.2008.09.010, lire en ligne)
- (en) Matthew W. Vetting, Subray S. Hegde, J. Eduardo Fajardo, Andras Fiser, Steven L. Roderick, Howard E. Takiff et John S. Blanchard, « Pentapeptide Repeat Proteins », Biochemistry, vol. 45, no 1, , p. 1-10 (PMID 16388575, PMCID 2566302, DOI 10.1021/bi052130w, lire en ligne)
- (en) Alex Bateman, Alexey G. Murzin et Sarah A. Teichmann, « Structure and distribution of pentapeptide repeats in bacteria », Protein Science, vol. 7, no 6, , p. 1477-1480 (PMID 9655353, PMCID 2144021, DOI 10.1002/pro.5560070625, lire en ligne)
- (en) K. Black, W. J. Buikema et R. Haselkorn, « The hglK gene is required for localization of heterocyst-specific glycolipids in the cyanobacterium Anabaena sp. strain PCC 7120 », Journal of Bacteriology, vol. 177, no 22, , p. 6440-6448 (PMID 7592418, PMCID 177493, DOI 10.1128/jb.177.22.6440-6448.1995, lire en ligne)
- (en) Subray S. Hegde, Matthew W. Vetting, Steven L. Roderick, Lesley A. Mitchenall, Anthony Maxwell, Howard E. Takiff et John S. Blanchard, « A Fluoroquinolone Resistance Protein from Mycobacterium tuberculosis That Mimics DNA », Science, vol. 308, no 5727, , p. 1480-1483 (PMID 15933203, DOI 10.1126/science.1110699, Bibcode 2005Sci...308.1480H, lire en ligne)