Acide tartrique
| Acide tartrique | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 2,3-dihydroxybutanedioïque | |
| Synonymes |
acide 2,3-dihydroxy succinique |
|
| No CAS | L-(+) ou (2R,3R) D-(−) ou (2S,3S) méso ou (2S,3R) (racémique) |
|
| No ECHA | 100.121.903 | |
| No CE | 201-766-0 (L-(+)) 205-695-6 (D-(–)) 205-105-7 (DL-(±)) |
|
| DrugBank | DB01694 | |
| PubChem | 875 | |
| ChEBI | 15674 | |
| No E | E334 | |
| FEMA | 3044 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre cristalline blanche[1] | |
| Propriétés chimiques | ||
| Formule | C4H6O6 [Isomères] |
|
| Masse molaire[2] | 150,086 8 ± 0,005 4 g/mol C 32,01 %, H 4,03 %, O 63,96 %, |
|
| pKa | 3,04 ; 4,37 | |
| Propriétés physiques | ||
| T° fusion | 206 °C pour le racémate et 171 à 174 °C pour chaque énantiomère[3] | |
| Solubilité | dans l'eau : 1 394 g·l-1 à 20 °C[1] | |
| Masse volumique | 1,79 g·cm-3[1] | |
| T° d'auto-inflammation | 425 °C[1] | |
| Point d’éclair | 210 °C (coupelle ouverte)[1] | |
| Thermochimie | ||
| Cp | ||
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | P21[5] | |
| Précautions | ||
| SIMDUT[6],[7],[8],[9] | ||
Acide tartrique : E, D-(−)-Acide tartrique :  E, Acide mésotartrique :  E, L-(+)-Acide tartrique :  E, |
||
| NFPA 704 | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
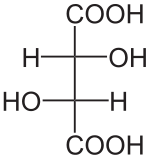
L'acide tartrique est le nom usuel de l'acide 2,3-dihydroxybutanedioïque qui a pour formule brute C4H6O6. C'est un acide α-hydroxylé. Sa formule semi-développée est HOOC-CHOH-CHOH-COOH. L'acide tartrique est présent dans de nombreuses plantes. Il fut isolé pour la première fois en 1769, par le chimiste suédois Carl Wilhelm Scheele, qui fit bouillir du tartre avec de la craie et décomposa le produit en présence d'acide sulfurique. Il peut être synthétisé. C'est le principal acide du vin (provenant du raisin), sous sa forme naturelle c'est-à-dire L-(+).
Les ions tartrates sont utilisés dans la liqueur de Fehling pour tester la présence d'aldéhydes. Le tartrate de potassium évite une cristallisation du vin en bouteille, phénomène exploité dès l'Antiquité par les Grecs et les Romains.
Chimie[modifier | modifier le code]
L'acide tartrique possède deux atomes de carbone asymétriques mais ne possède que trois stéréoisomères car le (R,S)-acide tartrique est une forme achirale dite « méso » car possédant deux atomes de carbone asymétriques tout en ayant un centre de symétrie au milieu de ces deux atomes de carbone.
L'acide nitrique oxyde l'acide tartrique en acide oxalique, tandis que l'acide sulfurique concentré le convertit en acide acétique. Chauffé en présence de dioxyde de manganèse et d'acide sulfurique dilué, il se décompose en CO2 et en acide formique[10].
Une distillation à sec en présence d'hydrogénosulfate de potassium produit de l'acide pyruvique[11].
Propriétés[modifier | modifier le code]
Il se présente sous la forme de cristaux transparents incolores solubles dans l'eau. La présence d'acide tartrique peut être testée par le résorcinol. L'acide tartrique active la salivation ; il est légèrement laxatif et diurétique.
Les bases conjuguées de l'acide tartrique sont l'ion tartrate, −OOC-(CHOH)2-COO− et l'ion bitartrate ou hydrogénotartrate, HOOC-(CHOH)2-COO−. Ainsi un des sels les plus communs est le (2R,3R)-bitartrate de potassium, un énantiomère présent dans le raisin et le vin[12].
Isomérie[modifier | modifier le code]

Louis Pasteur a étudié l'activité optique des isomères optiques des tartrates. La fermentation des jus de raisin produit sur la surface interne du récipient une croûte blanche de tartrate acide de potassium ou tartre brut. Ce dernier, bouilli en présence d'acide chlorhydrique dilué, précipite sous forme de tartrate de calcium, par addition d'hydroxyde de calcium. Son traitement par de l'acide sulfurique dilué libère la forme dextrogyre (+) de l'acide tartrique, composé qui fait tourner le plan de polarisation de la lumière polarisée vers la droite. L'acide L-(+)-tartrique a une température de fusion de 171 à 174 °C et est facilement soluble dans l'eau et l'alcool. Il est insoluble dans l'éther.
Il existe une autre forme de l'acide tartrique, l'acide D-(−)-tartrique (lévogyre). Cet autre énantiomère fait tourner le plan de polarisation de la lumière vers la gauche. Il fut préparé pour la première fois vers 1847 par Louis Pasteur dans le cadre de son doctorat, à partir du sel (double) d'ammonium et de sodium.
L'acide tartrique préparé en laboratoire est un mélange équimolaire des formes dextrogyre (+) et lévogyre (−). Ce mélange (acide DL-tartrique), dit racémique, du nom ancien de ce produit, l'acide racémique, ne modifie pas la direction du plan de polarisation de la lumière.
Il existe une troisième forme, l'acide mésotartrique, qui, achirale, ne modifie pas la direction du plan de polarisation de la lumière.
Utilisations[modifier | modifier le code]
Il est utilisé comme acide solide dans certains médicaments utilisés contre les indigestions et les maux de tête. Lorsqu'on les met dans l’eau, l'acide se dissout et réagit avec le bicarbonate de sodium pour libérer du dioxyde de carbone gazeux.
Il est utilisé dans l'alimentation comme additif alimentaire (numéro E334[13]), principalement comme antioxydant, régulateur de pH et séquestrant[14]. Il est autorisé dans la plupart des produits alimentaires et dans certains produits spécifiques tels que les produits de cacao et de chocolat, les confitures et gelées, les fruits et légumes en conserve, les pâtes fraîches et les biscuits et biscottes destinés aux nourrissons[13].
Il possède aussi une autre utilisation assez courante : dans certains cas précis, il permet, par ses propriétés de recristallisation (acide tartrique L-(+) et D-(–)), de séparer deux énantiomères.
En analyse gravimétrique, on utilise une solution d'acide tartrique pour précipiter le calcium, le potassium, le magnésium, la scandium, le strontium et le tantale[15].
Illustrations[modifier | modifier le code]
-
Acide tartrique brut issu du raisin
-
Acide tartrique commercialisé sous forme de poudre
Notes et références[modifier | modifier le code]
- ACIDE TARTARIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- D'après l'article en anglais.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) F. Stern et C.A. Beevers, « The crystal structure of tartaric acid », Acta Cryst., vol. 3, no 5, , p. 341-346 (DOI 10.1107/S0365110X50000975)
- « Acide tartrique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Acide tartarique (d-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acide méso-tartarique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acide tartarique (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Thomas Thomson, A system of chemistry of inorganic bodies, vol. 2, Baldwin & Cradock, , 7e éd., 944 p., p. 60, 66
- Organic Syntheses, vol. 4, p. 63 (1925), Coll. vol. 1, p. 475 (1941)
- (en) H. D. Flack, « Louis Pasteur's discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work », Acta Crystallogr. Sect. A, vol. 65, , p. 371–389 (PMID 19687573, DOI 10.1107/S0108767309024088, lire en ligne [PDF], consulté le )
- Commission européenne, « La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel, no L 61, , p. 1-56. [lire en ligne] [PDF]
- Codex Alimentarius, Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p. 1-35. [lire en ligne] [PDF]
- (en) John A. Dean. et Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 15e éd., 1424 p. (ISBN 978-0-070-16384-3, OCLC 40213725), p. 11.67
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) DL-Tartaric acid, Compendium of Food Additive Specifications (Addendum 7) - Joint FAO/WHO Expert Committee on Food Additives 53rd session, Rome, 1-10 juin 1999






