Pou du saumon
Lepeophtheirus salmonis
femelle mature avec ruban d'œufs ;
femelle mature sans ruban d'œufs ;
- Caligus salmonis Krøyer, 1837
Le Pou du saumon, Lepeophtheirus salmonis, est une espèce de copépodes parasites de la famille des Caligidae, au corps mou et protégé par une carapace aplatie et chitineuse. La femelle adulte mesure 12 mm (29 mm en incluant les rubans d’œufs). Le mâle adulte mesure 6 mm.
C'est l'une des espèces dites « pou du poisson », une dénomination qui rassemble des espèces de copépodes parasites vivant dans toutes les mers du monde. Il est parfois aussi nommé pou de mer.
Son cycle de vie comprend trois stades libres et planctoniques (non parasitaires) ; puis au stade pré-adulte et adulte, il devient un parasite externe fixé (ectoparasite). Comme son nom l'indique, Lepeophtheirus salmonis affecte surtout le saumon dont il consomme le mucus et parfois la peau et le sang (pour la femelle adulte)[2]. Au stade adulte ou pré-adulte, il peut causer des plaies ulcérées, entretenues ou élargies par des infections bactériennes et fongiques opportunistes. Il se fixe parfois aussi sur les nageoires où il se nourrit également de mucus. Plus rarement on le trouve sur les branchies.
Lepeophtheirus salmonis est une espèce économiquement et écologiquement préoccupante au Canada ou en Norvège puis Écosse et Irlande ; elle semble y avoir profité du rapide développement de l'élevage du saumon (depuis le début des années 1990) pour pulluler en devenant de plus en plus résistantes aux pesticides antiparasitaires. Elle cause d'importantes pertes financières.
Dans le même temps on a montré qu'au Canada, et en Europe, le nombre des saumons sauvages juvéniles parasités et mourant en mer augmentait. Par exemple pour l'Europe du Nord : 143 500 smolts (jeune saumon qui redescend vers la mer) marqués ont été relâchés en eau douce en 1997 et 2009 dans des cours d'eau norvégiens et dans des fjords de 2007 à 2009 (avec 1 à 6 opérations par an)[3] ; le taux de recapture de ces smolts (tant relâchés en rivière qu'en fjords) a été faible et en diminution : il était de 0,8–1,7 % de 1997-2002 et a ensuite régulièrement décliné pour tomber à 0 à 0,2 % en 2007/2008[3]. Ce phénomène était accompagné d'une moindre croissance des saumons et d'un retard de l'âge de maturité sexuelle tant chez le saumon sauvage que d'élevage. le taux de survie et de recapture a légèrement augmenté quand les saumons ont été relâchés de manière plus dispersée, ou quand les smolts avaient été traités contre les poux du saumon avant d'être relâchés (mais pas de manière significative par rapport à la variabilité naturelle de la mortalité en mer)[3]. Ceci indique une dégradation générale des conditions de vie du saumon atlantique en mer de Norvège, au moins en partie due à l'augmentation du parasitisme par les poux[3].
Après plus de 10 ans de débats, il y a depuis 2010 un consensus sur le fait que les élevages sont devenus une source de parasites pour le saumon sauvage juvénile se rendant en pleine mer[4] et que la densité d'une zone en parcs d'élevage est un facteur critique pour le risque de parasitose par les poux de mer[5], mais certains experts estiment que ces parasitoses des juvéniles n'expliquent pas à elles seules (au Canada) le recul ni les variations démographiques des saumons sauvages[6].
Au Canada, en Norvège, en Irlande et Écosse, les infestations de plus en plus importantes et conjointes de saumons sauvages et d'élevage sont jugées très préoccupantes, même si des divergences existent sur le degré de menace pour les populations sauvages de salmonidés migrateurs. En Irlande, après 9 ans d'études, Jackson & al. concluaient en 2012 que si ces poux peuvent effectivement tuer de nombreux smolts sauvages lors de leurs premiers mois en mer, ils ne sont ensuite qu'une cause mineure de mortalité des saumoneaux en mer[7]. Néanmoins malgré des variations annuelles et intrapopulationnelles importantes, des preuves d'infestations massives et récentes par L. salmonis existent chez les saumons remontant à l'ouest de l'Irlande, où une prévalence élevée (jusqu'à 100 % des saumons adultes marins remontant vers la terre) et une intensité élevée de parasitage (abondance moyenne maximale de 25,8 poux par saumon enregistrées en 2004) posent question[8].
Liste des sous-espèces[modifier | modifier le code]
Selon NCBI (29 décembre 2018)[9] :
- sous-espèce Lepeophtheirus salmonis oncorhynchi Skern-Mauritzen, Torrissen & Glover, 2014
- sous-espèce Lepeophtheirus salmonis salmonis Krøyer, 1837
Histoire[modifier | modifier le code]
Les poux de poissons sont connus depuis longtemps, mais ils étaient rares et n'étaient pas détectés sur les smolts. Les tout premiers problèmes sont nés avec l'apparition des premiers élevages dans les années 1970[10], d'abord en Europe du Nord, et peu après (tout début des années 2000) en Amérique du Nord où le problème a vite été pris très au sérieux.
En effet, un an après l'apparition de poux du poisson (nouvelle espèce ou variant génétique pour le Canada apparemment[11]) sur les alevins du saumon rose en 2001 (alors que les populations d'alevins étaient exceptionnellement importantes), en 2002 les remontées migratoires avaient chuté de façon spectaculaire, à la suite d'une mortalité très importante de saumons en mer ; « la population de saumons est passée d'environ 300 à 50 millions en une seule génération »[11]. Cette chute démographique est brutale, mais peut être expliquée par d'autres facteurs ou co-facteurs que le seul parasitisme par le pou des poissons. En effet, de tels effondrement de population avaient déjà été observés sans que ce parasite puisse être mis en cause. De 2005 à 2010, la prévalence du poux du poisson a chuté tant chez le poisson d'élevage et chez le saumon sauvage, sans doute au moins en partie à la suite des mesures prises par les salmoniculteurs. Mais les populations sauvages de salmonidés semblent toujours en mauvais état[11].
Ailleurs dans le monde, partout où des piscicultures intensives en parcs marins s'installent (y compris avec des parasites qui maintenant vivent très bien en eaux saumâtres, non loin d'élevages de Tilapias en Asie du Sud-Est par exemple[10], des phénomènes émergents similaires existent avec d'autres poux de mer proches ou de la même famille. Par exemple Caligus rogercresseyi pullule depuis le début des années 2000 dans les élevages piscicoles chiliens de saumons et de truite de mer[12],[13], corrélativement à des épidémies bactériennes[14] et/ou virales (virus de l'anémie du saumon) qui semblent associés dans un phénomène de co-infection, le parasite étant sans doute vecteur du virus et le virus favorisant peut-être le parasite[15]. En Corée, c'est le sébaste d'élevage (Sebastes schlegelii) qui est élevé comme les saumons en cages et en mer, qui est infesté de parasites de la même famille (Caligidae) ; Lepeophtheirus elegans[16]. Dans le passé, ce pou n'avait jamais été cité comme parasite de ce sébaste, mais en 2012 jusqu'à 98 % des poissons d'élevage sont parasités par ce pou de mer[16], dans des dizaines d'élevages différents[16], avec jusqu'à 29 poux par individu[16].
Ces caractéristiques évoquent des potentialités sur le plan de l'invasivité.
Confusions possibles[modifier | modifier le code]

(mâle et femelle)
D'autres espèces de poux de mer existent et lui ressemblent ; En particulier Caligus clemensi est au autre parasite, également parfois dénommé pou du saumon[17], mais il semble moins dépendant des fermes salmonicoles, en tous cas ses larves en sont trouvées à plus grande distance et plus dispersées[17]. Caligus longirostris a été trouvé récemment sur des saumons d'élevage en Australie (Tasmanie)[18].
Le consommateur risque peu de les voir car ils se décrochent des poissons après la pêche, quand ils sont manipulés[19].
Habitat, répartition[modifier | modifier le code]
On ignore encore l'origine géographique de cette espèce, mais il est aujourd'hui répandu dans la plupart des fermes salmonicoles : il est devenu très commun en quelques années dans les élevages de la côte ouest de l'Amérique du Nord, comme dans les élevages écossais, d'où il menace de contaminer les saumons sauvages[20].
L'« habitat » du pou adulte est son hôte, mais au stade larvaire planctonique, c'est la pleine eau. Des travaux récents conduits à partir d'observations faites dans le Hardangerfjord (zone marine norvégienne riche en parcs salmonicoles) montrent qu'au stade de larve planctonique, sa distribution générale et son abondance sont régies par les courants, la salinité mais aussi la température, trois variables que l'on tente d'intégrer dans des modèles numériques afin de mieux prévoir les risques, lieux et dates d'infestations. Ce type de modèle devrait aussi permettre de mieux gérer les risques de co-infections virales et bactériennes quand les pathogènes sont diffusés par les courants. On ignore comment et à quelle distance la larve perçoit la présence d'hôtes potentiels, mais on sait qu'elle sait utiliser les courants et les « vagues internes » marines pour se déplacer plus vite et plus loin[21].
Écologie, biologie[modifier | modifier le code]
Reproduction et cycle de vie[modifier | modifier le code]
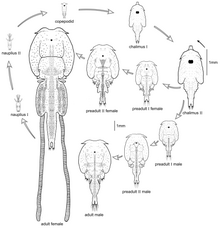
La reproduction a lieu toute l'année, mais avec une forte augmentation au printemps quand la température de l'eau remonte.
L'accouplement de L. salmonis se produit de manière similaire (approche, postures…) à celui de L. pectoralis mais avec des durées différentes[22].
Les mâles adultes (deux fois plus petits que la femelle) prennent des positions précopulatoires principalement avec les femelles « pré-adultes II »[22]. Il semble y avoir de la part du mâle un comportement de reconnaissance des femelles sans doute basé sur des stimuli biochimiques de type hormonal (les dernières mues abandonnées par la femelle mature peuvent attirer des groupes de mâles)[22].
Il s'accroche à sa partenaire au niveau du 4e segment porteur de pattes, en utilisant sa seconde paire d'antennes[22].
Les femelles approchant de leur mue finale produisent des filaments frontaux temporaires qui leur permettent de s'ancrer durant la mue[22]. Les mâles restent fixés au céphalothorax de la femelle lors de sa mue finale, puis ils se rattachent au complexe génital de la femelle avant de se rapprocher de la surface ventrale de celle-ci. Le mâle (adulte) s'accouple à la femelle qui vient de muer. Avec des mouvements complexes et précis, il utilise ses maxillipèdes pour manipuler et soulever le complexe vaginal de cette femelle, pour finalement y déposer une paire de spermatophores au moyen de ses pattes natatoires. Une fois cette opération accomplie, il revient sur le dos de la femelle et semble durant un certain temps faire en sorte que ses spermatophores restent pressés contre la femelle[22]. On observe ensuite (du moment de l'insémination à celui de la production des premiers œufs) une croissance allométrique du complexe génital de la femelle[22]. Les œufs sont produits en deux longs filaments souples contenant plusieurs centaines d'œufs qu'elle traîne derrière elle (elle est alors dite « ovigère »). Chaque œuf éclot en donnant une minuscule larve mobile dite « nauplius ». Les nauplii nagent et/ou se laissent porter par le courant.
Les nauplies grandissent en muant 3 fois[11], les exuviations se produisant pendant une période de jeûne.
La 4e mue les fait passer au stade « copépodite », stade crucial car c'est le moment où le pou doit trouver un poisson à parasiter. Il remonte la « piste odorante » laissée par une "proie" (ou par un élevage de saumons), et une fois arrivé à proximité de son hôte, il utilise dans un premier temps un petit filament pour s'attacher à lui. L'hôte est souvent un salmonidé (saumon, truite de mer ou omble chevalier anadrome[4], mais il peut s’agir d'une épinoche (migratrice amphihaline, ou épinoche marine) ou d’un hareng)[11].
Une fois fixé à son poisson au moyen de crochets, il va longuement en consommer le mucus (celui du saumon atlantique est composé d'environ 530 protéines[23]). Le pou pré-adulte subit encore plusieurs exuviations qui lui permettent de grandir et de se sexuer (il devient mâle ou femelle adulte et sexuellement mature)[11]. Vient l’accouplement et la ponte.
La totalité de ce cycle dure de 45 à 50 jours, selon la température de l'eau[11], et le cycle peut recommencer.
Selon les conclusions d'une étude ayant utilisé dans la Baie de Fundy des échantillonneurs lumineux (piège lumineux attirant les larves), il y a beaucoup plus de larves actives de poux près des fermes en début d'automne que dans les sites de référence[24]. Dans l'environnement proche d'une ferme d'élevage située en eau peu profonde, le jour, les larves étaient distribués à la fois dans le haut et le bas de la colonne d'eau. En raison des traitements chimiques certains des poux femelles meurent[24]. Des mesures faites en laboratoire montrent qu'un chapelet d'œufs libre tombe vers le bas à environ 1 cm/s, alors que fixé à une femelle gravide morte, il tombe près de deux fois plus vite : 9 cm/s, et les œufs éclosent avec succès sur les sédiments vaseux[24]. Sachant que dans les zones de salmonicultures les courants moyens sont d'environ 10 cm/s un calcul prenant en compte ces deux vitesses de sédimentation montre que les œufs sont dispersés autour de l'élevage jusqu'à 160 à 300 m[24]. Après l'éclosion, les larves nagent à une vitesse de 1 à 3 mm/s[24]. Ceci suggère qu'elles pourraient nager du bas de la colonne d'eau à la surface en 3 à 8 heures tout en dérivant avec le courant et entretenir un cycle d'infestation. Une vidéo[25] faite par A. norton (biologiste canadienne) montre des larves femelles ovigères fixées sur la coque même d'un bateau-usine emballeur (le Viking Star) qui vient récupérer et traiter les saumons fraichement récupérés dans les parcs d'élevage, suggérant que des bateaux de ce type puissent eux-mêmes véhiculer des parasites[24].
Dynamique de population[modifier | modifier le code]
Avant la mise en place des parcs d'élevage de salmonidés, les poux de mer et leurs hôtes sont probablement longuement coévolués, et des variations naturelles de la population des poux de mer existait probablement, dépendant notamment de celles de leurs hôtes ou de certains pathogènes ou prédateurs des poux de mer, notamment à l'état de larve.
La dynamique de population de l'espèce a été fortement modifiée par l'Homme. D'abord avec la surpêche qui a causé une régression des saumons sauvages, et ensuite depuis quelques décennies par la mise à disposition des poux de millions de saumons d'autant plus facilement parasités qu'ils sont encagés et que les cages sont positionnées dans les zones favorables aux poux.
Dans l'océan, hormis sous les fermes salmonicoles les larves planctoniques sont peu présentes et elles semblent largement dispersées par les courants. Elles sont donc difficiles à capturer, identifier et tracer, ce pourquoi on ignore encore avec quelle efficacité elles peuvent se déplacer, cibler et parasiter leur hôte.
Des études sont en cours dans plusieurs pays pour mieux comprendre comment les poux se dispersent et évoluent en mer. Elles utilisent des pièges à plancton pour étudier le stade larvaire planctonique, et pour des réseaux de cages de « poissons sentinelle » pour étudier le stade copépodite et parasite adulte. Récemment un système (« smoltsimulator ») a été utilisé[26]. Il s'agit d'une cage mobile saisonnièrement remorquée (de 2011 à 2012) dans un archipel norvégien pour simuler le trajet des smolts des l'estuaires vers la pleine mer (le mouvement de la cage étant en quelque sorte calqué sur ce que l'on suppose être le mouvement de migration d'après des captures faites au filet dans le même environnement). Ce smoltsimulator permet de mieux observer la vitesse et l'intensité de l'acquisition de poux par les smolts au fur et à mesure de leur voyage vers la pleine mer en passant par une aire d'alimentation qui était déjà connue des scientifiques.
Dans le même temps, une autre étude cherche à modéliser la dispersion des poux dans un fjord écossais qui concentre à lui seul 10 % de la production salmonicole de toute l'Écosse[27].
De nombreux indices et les modèles laissent penser que la diffusion pélagique des larves planctoniques joue un grand rôle pour le déplacement géographique des larves et pour l'entretien de la diversité génétique au sein de l'espèce ;
Il est également possible que des larves de diverses souches aient été transportées par l'Homme avec des stocks de saumons déplacés vers les parcs ou via les eaux de ballasts de certains navires. Ceci pourrait avoir favorisé des adaptations génétiques plus rapides des poux aux pesticides utilisés pour les tuer.
Détection à distance d'une « proie »[modifier | modifier le code]
Après sa 4e mue, grâce à des chémorécepteurs olfactifs, la larve du pou est capable remonter la « piste chimique » formée par une ou plusieurs molécules perdues par sa proie (molécules dites kairomones jouant le rôle d'une « signature olfactive »)[28].
Fixation sur la « proie » ?[modifier | modifier le code]
Quand il a localisé son hôte (salmonidé le plus souvent), s'il peut s'en approcher suffisamment, il entre en contact avec le mucus du saumon. Ce contact induit alors chez le parasite une série de réactions comportementales[28].
Le pou semble également capable de choisir des saumons dont la peau, voire la chair ont une composition biochimique qui leur convienne[28].
Des études de rhéotaxie utilisent en tube en forme de Y dans les branches duquel un expérimentateur peut présenter au pou diverses molécules de l'hôte (protéine extraite du mucus, urine…) et/ou des molécules susceptibles d'être répulsives ou de masquer l'odeur des kariomone émises par l'hôte. Ces études visent à mieux comprendre les capacités olfactives du pou (L. salmonis et C. rogercresseyi dans un premier temps), et - si cela s'avère possible - à les inhiber[28]. Des extraits de certaines plantes semblent efficacement perturber l'olfaction des parasites. Des extraits des plantes qui se sont montrées les plus efficaces dans ces expériences ont été intégrés dans des aliments commerciaux qui ont servi à nourrir des saumons en mer, et ces saumons se sont montrés effectivement moins parasités, avec en parallèle un moindre taux de survie des poux[28]. Ce type de traitement pourrait compléter l'immunostimulation des saumons élevés en cage. Si une kéromone spécifique était clairement identifiée, il serait peut être possible de créer des leurres ou des pièges capables d'attirer les larves en recherche d'un hôte.
Décrochage de la « proie » ?[modifier | modifier le code]
Le pou du saumon était réputé de pas supporter l'eau douce et rapidement se décrocher du saumon lors de sa remontée dans les fleuves[29]. Cependant des salmonidés encore porteurs de poux sont périodiquement détectés en eau douce, dont par exemple en France dans le Pas-de-Calais à un point de comptage situé à Nampont-Saint-Martin (Montigny) à 18,5 km de la mer[30]. Durant leur phase marine de vie, les salmonidés, selon une étude ayant comparé les réactions immunitaires de saumons encagés et de saumons naturellement porteurs de poux, ces parasites ne semblent pas gravement affecter la santé du poisson ; on observe autour de la plaie des cellules brisées ou pycnosées, et une certaine hyperplasie autour des larves de stade IV, mais « Peu d'autres lésions ou réaction de l'hôte ont été notées. Il n'y avait pas de réaction sérique d'anticorps à une infection manifeste, telle que déterminée par buvardage, et les valeurs de dénombrement des globules blancs des groupes de poissons témoins et infectés étaient statistiquement les mêmes »[31]. D'autres études dont en Écosse ont aussi observé d'autres changements pathologiques chez l'hôte incluant l'apparition d'un « œdème, d'une desquamation des cellules et d'inflammations cellulaires sur et autour du point d'alimentation et d'attache. parmi les lésions macroscopiques, des graves dommages ont lieu dans l'épiderme avec une perte de tissus et des hémorragies comme caractéristique commune ».
Quand le pou d'un saumon en train de migrer vers la source se décroche en eau douce, le parasite laisse brutalement une plaie ouverte, au moment où le saumon doit faire d'intenses efforts pour lutter contre le courant et sauter les obstacles. Ces plaies peuvent a priori être une porte d'entrée pour des bactéries ou des virus spécialisés ou opportunistes.
Les poux de mer et la lumière (dont spectre UV)[modifier | modifier le code]
La résistance aux UV et à la lumière des poux de mer et d'autres parasites copépodes pélagiques n'est que partiellement explorée, mais elle a été expérimentalement testée par exposition à différentes intensités d'UVB (avec un maximum de l'éclairement spectral à 313 nm et la lumière visible supplémentaire. Ces organismes ont montré des comportements d'évitement ainsi qu'une certaine capacité à réparer les dégâts produits par les UV (photoréparation) et à s'en protéger par la synthèse de pigments (caroténoïdes). Lepeophtheirus salmonis s'est montré beaucoup plus résistant aux UV que Calanus finmarchicus. Selon une modélisation, si on suppose que Calanus ne peut pas synthétiser de pigments protecteurs, des comportements d'évitement (incluant la migration verticale selon le taux d'UVB) permettraient à ce copépode de survivre aux UVB à 1 m de profondeur dans le fjord d'Oslo, alors que sans ceux-ci, il ne survivrait qu'à 7 m de profondeur[32].
Génétique, génomique[modifier | modifier le code]
Les parasites coévoluant généralement avec leur hôte, il est intéressant d’étudier conjointement la génomique de ces deux entités biologiques afin de mieux comprendre comment l’une s’adapte à l’autre ou y résiste.
Le saumon atlantique en raison de son intérêt commercial et parce qu'il a fait l'objet de projet et d'essais d'« améliorations » par génie génétique transgenèse fait l'objet d'études génétiques depuis la fin du XXe siècle, avec une « cartographie génétique » publiée en 2005[33].
En connaissant mieux les facteurs génétiques et les interactions durables et les évolutions récentes entre ces hôtes et parasites, on espère développer de futurs antiparasitaires moins écotoxiques et ciblant mieux les parasites.
Une stratégie proposée est de sélectionner des souches plus résistantes de saumons d'élevage et de mieux lutter contre les « souches plus virulentes de poux », mais cette stratégie n'est pas sans risque, car l’expérience a montré dans d’autres domaines agroécologiques que la diffusion d’une souche résistante est souvent suivie d’une adaptation du parasite et peut entrainer de nouveaux problèmes dus à la perte de diversité génétique des souches cultivées.
Génome séquencé[modifier | modifier le code]
Concernant le pou du saumon L. salmonis, plusieurs lignées de laboratoire, stables ou mutantes sont cultivées et disponibles depuis 2008-2009 pour la recherche. C'est l'ADN de l'une de ces souches (lignée européenne, consanguine et à faible variation génétique) qui a servi au premier séquençage génétique de l'espèce[34]. Fin 2010, le séquençage était réalisé (par l'université de Bergen et le Max Planck Institute for Molecular Genetics), mais les séquences n'étaient pas encore assemblées[35]. Les premiers éléments utiles étaient disponibles en 2011, et fin 2012 le séquençage était réalisé, assemblé et annoté, avec une publication finale prévue pour 2013 après un contrôle de qualité des données. Ceci a pu être fait grâce à l'aide technique de Institut européen de bioinformatique, et des financements de l'Institut norvégien de recherche marine[36] et des contributions significatives du Centre de recherche sur le pou du saumon (Salmon Louse Research Centre ou SLRC), du Marine Harvest (leader mondial en salmoniculture et production de nourriture pour pisciculture[37] et du Fonds norvégien de recherche sur la mer[38].
La taille de son génome est de 600 Mbp environ, comparable par exemple à celle du scorpion Mesobuthus martensii Karsch[39].
Transcriptome[modifier | modifier le code]
D'après leur transcriptome, les souches nord américaines trouvées dans le Pacifique sont génétiquement différente des souches atlantiques[40] Lelong et Koop les considèrent comme des espèces différentes[40].
L'étude du transcriptome de 12 poux prélevés dans des lieux différents situés entre la mer de Béring et le sud de l'île de Vancouver montrent une complexité génétique associée à des différenciations génétiques entre saumons d'élevage et sauvages et variant significativement dans le temps en deux ans (entre 2007 et 2009), qui n'ont pas pu être expliquée ni associées à un modèle de structuration de la population[41]. Ceci conforte l'hypothèse d'intenses mouvements migratoires des larves portées par le courant et sans doute d'adultes portés par leurs hôtes et d'une panmixie de L. salmonis (au moins dans la zone d'étude). Ce contexte est favorable à une adaptation rapide des poux face à diverses pressions sélectives.
Nombreux transposons[modifier | modifier le code]
L'étude des transposons et rétrotransposons d'un génome peut apporter des renseignements importants sur la structure du génome et sur son système de régulation, ainsi que sur les capacités de l'espèce à évoluer rapidement face à des changements de ses conditions de vie (l'insertion de transposons dans le génome est réputée faciliter l'évolution adaptative et certaines mutations dirigée)[42]. La présence de transposons semble souvent permettre une restructuration du génome à grande échelle. Elle est aussi impliquée dans le phénomène de spéciation[42]. Des chercheurs ont récemment comparé (in silico) la composition et l'abondance des éléments transposables (transposons) trouvés dans le génomes de 2 sous-groupes de poux du saumon, l'un ayant été échantillonnés en Atlantique (Norvège) et l'autre dans le Pacifique (au Canada)[42]. Les éléments de classe II (transposons) ont été les plus abondants dans les deux génomes. Des rétrotransposons de classe I étaient également présents. Selon les données extraites de cette étude, 54 % du génome du pou Pacifique et 58 % du génome de l'Atlantique sont composés d'éléments transposables, et contrairement à ce qui est le cas chez leur hôte le saumon atlantique (Salmo salar), les constituants de ces éléments transposables appartiennent à une très large variété de familles (plusieurs centaines de famille), ce qui laisse penser que ce parasite possède probablement une capacité d'évolution rapide, y compris face aux antiparasitaires chimiques qu'on lui opposera[42].
Expression génétique[modifier | modifier le code]
Elle est étudiée ou abordée de plusieurs manières, dont voici quelques exemples :
- En 2010, des biopuces ont été utilisées pour étudier « la structure de l'expression génétique chez le saumon et le pou du poisson en vue d'identifier quels gènes subissent des changements importants dans leur expression durant une infestation »[43].
- plusieurs études ciblent l'expression des gènes impliqués dans une susceptibilité ou au contraire une résistance particulière aux antiparasitaires[44]
- d'autres auteurs se sont intéressés aux gènes impliqués dans la vulnérabilité/résistance à un champignon parasite (Facilispora margolisi, intracellulaire obligatoire) du genre Microsporidia, parfois trouvé sur le pou et qui peut être transmis de la femelle à sa descendance via une infection des œufs[45]
Marqueurs génétiques[modifier | modifier le code]
Des marqueurs génétiques sont répertoriés chez les poux des poissons pour étudier leur dynamique et structure de populations, leurs capacités migratoires, leurs préférences en ce qui concerne l'hôte et certains phénomènes évolutifs et génétiques qui pourraient influencer la réaction hôte-pathogène[46].
Pullulations[modifier | modifier le code]


Chez toutes les espèces existe une variation naturelle du taux de parasitisme. Mais des taux globalement croissants et anormaux de parasitoses par poux de mer sont observés chez le saumon depuis les années 1990.
C'est notamment le cas en 2001, avec une forte hausse de la prévalence sur les saumons de la Côte ouest de l'Amérique du Nord, et en particulier chez les juvéniles sauvages de l'archipel de Broughton au Canada (plus de 70 % des individus étaient porteurs d’au moins un pou). Les raisons de cette pullulation ne sont pas comprises, mais pourraient inclure des effets secondaires et synergiques du réchauffement climatique, de l'augmentation des salmonicultures et peut-être de la marée noire de l'Exxon Valdez (40 000 t de pétrole brut répandues sur plus de 7 000 km2 et ayant touché 2 000 km de trait de côte)[47]. cette pullulation des poux de mer a déclenché, un programme annuel de surveillance (entamé en 2004), et qui a montré que cette prévalence avait fortement diminué (5 à 20 % des juvéniles parasités)[48]. Diverses études ont suivi et sont encore en cours pour tenter de comprendre ce phénomène et l’évolution de la distribution spatiale des larves planctoniques ou pré-adulte du pou du poisson dans l'archipel de Broughton.
Des phénomènes similaires sont observés dans les zones norvégiennes de salmonicultures, ainsi qu'en Irlande et Écosse. À titre d'exemple, l'étude de jeunes saumons placés dans 10 cages sentinelles disposées entre l'embouchure d'un fleuve à saumon écossais, et la pleine mer a montré que les larves du pou du saumon L. salmonis y sont maintenant capables d'infester en grand nombre les smolts arrivant en mer. les smolts sentinelles ont été relevés et remplacés chaque semaine. Ils étaient porteurs de tous les stades de développement du parasite, mais les stade copépodes et chalimus I étaient nettement plus fréquents (respectivement 33,36 % et 55,89 % des cas). La prévalence et l'intensité de la parasitose variait selon la position de la cage et selon l'époque (en : 5,88 % à 63,16 % des saumons ont acquis au moins un parasite dans leur cage ; avec 1,0 à 1,46 parasite par smolt), avec une forte augmentation de la prévalence ensuite : en 69,39 % à 98,57 % des saumons étaient parasités avec 2,15 à 13,4 parasite par poisson). Ceci suggère que les stades copépodites et adultes sont les plus problématiques pour les saumons. Cette étude a aussi montré que le pou L. salmonis était présents dans tout le système du Loch Linnhe du printemps à l'automne, bien qu'à une densité variant selon les lieux du loch, et que la pression parasitaire était beaucoup plus forte en automne, à des niveaux a priori souvent préjudiciable à la santé du poisson-hôte
L'aggravation récente de certaines pullulations semble liée à l'apparition de résistances aux pesticides utilisés par les salmoniculteurs. En particulier une épidémie récente au Nouveau-Brunswick préoccupe les autorités et salmoniculteurs, car liée à « tolérance accrue des poux du poisson à certains traitements »[49] ; Au sud-ouest du Nouveau-Brunswick, l'antiparasitaire distribué aux poissons via leur nourriture est devenu « largement inefficaces » et il n'existe aucun traitement homologué et disponible pour des bains médicamenteux antiparasitaires. Des infestations massives de poux apparues dans les élevages de cette région de 2009 à 2011 a conduit les autorités à enregistrer en urgence plusieurs pesticides (Salmosan, Azaméthiphos, AlphaMax et Paramove) aux impacts potentiellement préoccupants pour les écosystèmes et pour la santé des consommateurs[50].
Pathogénicité[modifier | modifier le code]
Ce parasite semble parfaitement adapté aux saumons. Il est d'abord consommateur de mucus puis de sang (au stade adulte et pré-adulte). Or, le mucus et le sang contiennent des protéines ou d'autres molécules qui défendent l'extérieur et l'intérieur du saumon contre les attaques parasitaires et microbiennes.
On cherche à mieux comprendre les mécanismes de digestion du copépode. Ce dernier peut à la fois inhiber ou contourner le système immunitaire de ses hôtes, consommer un sang dont la teneur en fer serait toxique pour d'autres crustacés, et dégrader les protéines du système du complément qui sont présentes dans ce sang[51].
Selon des études d’infestations contrôlées faites sur la truite de mer, la parasitose devient mortelle à partir de 1,6 poux mobiles par gramme de poisson, mais ce chiffre semble varier selon l'espèce de saumon concernée, selon les conditions environnementales[52] et semble-t-il selon la souche du parastite (Il est possible que pour des raisons génétiques, certains poux soient plus adaptés à certains hôtes ou certains hôte moins résistants).
Des saumons rouges juvéniles en bassin ont été mis en présence de copépodites (100 par poisson). Chaque saumon a été parasité par au moins un pou, mais aucun n'est mort. Par contre, chez les saumons d'un autre lot mis cette fois en présence de 300 copépodites, tous les saumons ont été plus fortement infestés et 70 % en sont morts (pour un taux moyen d'infestation par poisson de 0,35 poux par gramme de poisson).
Réponses comportementales du saumon[modifier | modifier le code]
Habituellement les saumons ne sautent hors de l'eau que devant un obstacle ou pour le franchir. Une expérience récente (publiée en 2018) a montré que les jeunes saumons rouges (Oncorhynchus nerka) se débarrassent d'une partie de leurs poux en sautant jusqu'à 30 centimètres au-dessus de l'eau ou rasant parfois la surface sur près d'un mètre[53]. Ce comportement survenait environ neuf fois par jour (moyenne)[53]. Les poissons infestés de poux bondissent ainsi hors de l'eau 14 fois plus souvent que ceux qui n'en portent pas. Ce moyen n'est pas très efficace (il lui faut environ 55 sauts pour se débarrasser d'un seul pou)[53].
Réponses physiologiques du saumon[modifier | modifier le code]
De même que la mortalité, l'ampleur des réponses physiologiques augmente avec le nombre de poux par poisson, et s'aggravent fortement lorsque la larve du pou passe au stade pré-adulte.
Les principales modifications physiologiques (mesurées en condition d'infestation contrôlée sur le saumon rouge juvénile) sont :
- une diminution de l'hématocrite après une vingtaine de jours de parasitage ;
- une augmentation significative de l'osmolarité plasmatique (dès le 15e jour après l'infestation) ; Cette perturbation du système ionorégulatoire du saumon juvénile de 1 à 2 grammes advient au moment il termine son adaptation au milieu marin. ce milieu marin étant « hyperosmotique », la parasitose augmente la teneur en ions chlore et sodium de l'organisme.
Il semble exister un seuil de masse corporelle (ex : 0,5 g chez le saumon rose) pour les poissons infectés par un pou au stade chalimus (quand la larve n'est attachée à l'hôte que par un filament). Au-dessus de ce seuil, l’infestation par le pou du poisson n'a plus d’effet sur les teneurs en ions corpxorels (mais il peut encore avoir d’autres conséquences comme la transmission d’une maladie vectorielle). Les scientifiques ayant mis en évidence ce seuil de masse corporelle ont invité les gestionnaires à en tenir compte dans la planification des opérations salmonicoles et de gestion du risques, afin de diminuer les parasitoses des juvéniles de saumons sauvages qui sont obligés de passer près des parcs d'élevage de plus en plus nombreux entre les estuaires et les zones marines de grossissement que les saumons doivent gagner en pleine mer[54] ;
- une augmentation du taux de cortisol ; c'est un indicateur de perturbation du système immunitaire[54], qui rendent très probable des infections ou co-infections par des pathogènes opportunistes ; la lyse et digestion du mucus puis de la peau par le parasite est en effet une porte d'entrée pour des pathogènes tels que virus, bactéries ou mycoses. Le parasite pouvant en outre lui-même inoculer au saumon certaines maladie dont il est porteur ;
- un examen histologique des branchies montre une hyperplasie focale sévère des cellules épithéliales basales de la peau et la fusion des lamelles secondaires (sur les zones où les poux étaient fixés) ;
- les nageoires présentaient une érosion superficielle à profonde de la peau autour du site d'attache des chalimus, sans preuve toutefois d' hyperplasie ni de réponse inflammatoire ;
- des signes d'abrasions cutanées et pertes d'écailles, ils n'apparaissaient qu'au moment où les parasites passaient aux stades pré-adultes (c'est-à-dire +/- 20 jours après l'attache des parasites sur les saumons) ;
Conséquences sur les dynamiques de population de saumons[modifier | modifier le code]
La combinaison de ces effets décrits ci-dessus laisse penser que le saumon rouge juvénile est de loin le plus vulnérable au copépode parasite Lepeophtheirus salmonis. À ce stade, l'épiderme du saumon est encore très fin, ses écailles sont imparfaitement développées et la smoltification n'est pas tout à fait terminée.
Dix ans après les pullulations de 2001, au Canada seuls 3 % des saumons sauvages capturés lors de la montaison en Colombie Britannique étaient porteurs de poux[55], mais c'est au début de la vie juvénile et marine du saumon que la parasitose semble la plus dangereuse, et quand elle est aussi la plus difficile à suivre par les scientifiques, alors que l'alevin ne pèse que 1 à 2 grammes.
L’impact démographique global et à moyen et long terme de ces parasitoses pour les populations sauvages est encore mal cerné.
Enjeux[modifier | modifier le code]
- Enjeux économiques : Ce parasite semble profiter des conditions d’aquaculture en cage qui lui sont très favorables (grande promiscuité et grand nombre d’hôtes potentiels). Cette « maladie émergente » touche un nombre croissant de salmoniculteurs à la fin des années 1990 et au début des années 2000. Au Canada, de 2000 à 2010 l’industrie du saumon aurait dépensé plus de 50 millions de dollars (10 à 20 % de la valeur totale récoltée) pour la lutte et surveillance contre le poux du saumon (ce à quoi il faudrait ajouter les diverses aides gouvernementales ont subventionné la recherche connexe à ce domaine)[17]. Les salmoniculteurs norvégiens devaient en 2013 y consacrer 10 % du revenu de leurs élevages[56].
- Enjeux sanitaires et zootechniques : Comme le poux inhibe au moins localement (autour de la plaie) l’immunité de son hôte, il peut probablement aussi contribuer à la diffusion d’autres parasitoses et de maladies virales et bactériennes (y compris maladies émergentes dont le risque d’apparition augmente avec la mondialisation des échanges) chez les poissons[17].
- Enjeux écologiques : Les élevages salmonicoles où le poux se multiplie deviennent des « sources de larves » qui peuvent réinfester l’élevage à la saison suivante, ou infester d’autres élevages plus ou moins proches ou encore toucher les saumons sauvages. En effet, les larves de poux sont diffusées en grand nombre par les courants et peuvent parasiter des saumons sauvages (juvéniles arrivant de l'estuaire et se dirigeant peu à peu vers la pleine mer).
Le risque de « contagion » est encore mal connu, mais il est démontré qu’il augmente pour le saumon sauvage juvénile au fur et à mesure qu’on s’approche des cages d'élevage[57]. Ce risque dépend a priori principalement du taux de transmission (du saumon d’élevage vers le saumon sauvage), mais aussi de la pathogénicité des poux pour les saumons sauvages, qui est encore mal cernée.
- Enjeux de recherche : Ils sont importants pour la viabilité économique des piscicultures comme pour le bon état écologique des océans, des cours d’eau et des bassins versants remontés par les salmonidés. Les scientifiques, canadiens notamment, cherchent à aider les éleveurs à mieux positionner géographiquement leurs cages d'élevage de saumons pour limiter les risques de pullulation de poux et leurs effets collatéraux sur d’autres espèces[17]. Ils étudient pour cela le cycle de reproduction du pou du poisson et les capacités de dissémination des œufs, larves (« dérive des larves ») et des adultes ainsi que leurs capacités d’infestation selon les conditions de température, salinité et de santé de l’hôte[17]. Une étude a par exemple porté sur« la répartition du pou du poisson larvaire planctonique dans l'inlet Knight et l'archipel Broughton » au Canada à différentes périodes de l’année[17].
Rôle de la salmoniculture dans les pullulations de poux ?[modifier | modifier le code]

La salmoniculture a contribué à diminuer la pression de pêche et la surpêche, mais des indices laissent penser qu'elle influence négativement la santé du saumon sauvage.
- Par exemple dans les zones qui accueillent des salmonicultures en cage, la « productivité » des populations sauvages de saumon Coho a chuté. Elle y est sept fois moindre que celle des populations sauvages dans des zones comparables, non pêchées et sans élevages[58]. La productivité y est même devenue négative, avec donc un effet de « puits écologiques » et démographique.
- Le même constat est fait si l'on compare les populations vivant près de zones d’élevage à celles qui vivaient dans ces zones avant l’apparition des élevages de saumon en mer[58]) et des preuves scientifiques ont récemment montré que la salmoniculture est à la fois victime et au moins en grande partie responsable des pullulations de ce parasite[59],[60].
Les études canadiennes ont en effet toutes montré que les élevages salmonicoles jouent involontairement un rôle d’élevage de ces parasites. « Même si l'abondance des larves de pou du poisson était assez faible aux printemps 2007 et 2008[61] (et qu'elle se trouvait au seuil de détection en 2009), les maximums spatiaux locaux étaient uniformément situés près des sites de pisciculture »[17].
- Par exemple et de manière générale : plus un saumon du pacifique sauvage juvénile vit près d’une cage d’élevage salmonicole, plus il présente de risques d’être infesté par le pou des poissons[62].
- De même les mesures de densité de larves planctoniques (nauplii + copepodides au stade infestant) faites dans l’eau de mer au Canada (publication 2008) ont montré que plus on s’éloignait (de 2 à 30 km) des fermes aquacoles (par rapport au courant), plus rares étaient les larves dans un même volume d’eau[63],[64].
- Ce sont les nauplii (larves de un à quelques dixièmes de mm) qui sont observés avec la plus fort densité spatiale, ainsi que le stade fixé des poux. La distribution automnale larvaire (au stade planctonique) est égale en automne et au printemps[17]. Ces mêmes études montrent que les mesures de lutte contre les poux dans les élevages réduisent aussi le risque d’infestation de saumons sauvages[60].
On admet généralement que dans la nature, c’est la prédation sur les animaux parasités et les maladies que ces animaux risquent plus de contracter qui régulent les populations de parasites. Or, ce principe de sélection naturelle devient inefficient dans un contexte d'élevage en cage où les prédateurs sont absents et où les poissons sont soignés ou vaccinés contre les maladies.
Quand ils sont infestés par des parasites, les élevages deviennent alors des sources d’infestation pour les saumons sauvages, avec une efficacité que Frazer a essayé de modéliser (2009)[65] en soumettant l'hypothèse que dans un contexte d'élevage les populations de poux seront dans une dynamique d'expansion au-dessus d’un seuil d’environ 1 % de poissons parasités.
Le risque d’infestation de saumons sauvages est alors a priori (et selon les données disponibles) plus élevé quand les cages d’élevage sont situées dans ou à proximité d'un « corridor biologique sous-marin de migration » utilisé par les saumons juvéniles sauvages pour gagner leurs zones de grossissement en mer[66], quand les juvéniles sont le plus longtemps exposés au risque de contact avec le parasite en recherche d’un hôte[67].
Les élevages salmonicoles sont pour cette raison suspectés d’être l’une des causes importantes du déclin général des saumons sauvages[68], même si d’autres facteurs aggravants ou facilitateurs sont probablement aussi en cause (pollutions, perturbateurs endocriniens…) et même si le premier modèle épidémiologique (élaboré par Krkosek et al en 2007) avait prédit une extinction à court terme, qui ne s’est pas produite[69], sans doute parce que ce modèle était trop simplifiant - ne tenant pas compte par exemple de certaines capacités de résilience du saumon sauvage une fois qu’il a acquis ses capacités d’osmorégulation [voir plus bas] et ne prenant pas en compte des « facteurs de productivité » encore mal compris de certains bassins-versants permettant une meilleure survie des jeunes saumons et/ou des géniteurs que dans d'autres bassins versants[70] ou ne tenant pas compte des effets des traitements anti-poux des poissons utilisés par les éleveurs. Les modèles ont été plusieurs fois révisés et affinés, prédisant une extinction de masse du saumon rose en 8 ans, puis en 10 ans[71]. Ils doivent intégrer les effets complexes et imparfaitement connus (pour les moyen et long termes notamment) des traitements antiparasitaires qui modifient fortement les relations parasite-hôte et les capacités d’infestation du parasite, ce qui complique le travail des modélisateurs[72],[73]. Ces traitements aux pesticides semblent avoir dans les années 2000 diminué l’importance de la responsabilité des élevages dans la diffusion des poux du saumon, mais des modèles récemment améliorés (en prenant mieux en compte par exemple la pression de pêche sur le « stock » des adultes) continuent à conclure que l’exposition des juvéniles du saumon rose ou Coho aux parasites des salmonicultures reste un facteur de déclin du saumon sauvage[74] et bien qu’aucune réduction d’efficacité de l’antiparasitaire Slice n’ait été observée en 5 ans (de 2003 à 2008), la possibilité que les poux ne finissent par s’adapter aux pesticides ne doit pas être écartée[75].
Recherche[modifier | modifier le code]
En raison -entre autres- de l'augmentation importante et rapide des parasitoses par "poux de mer" dans plusieurs parties du globe, des centaines d'études ont été conduites ou sont en cours dans le monde entier afin de mieux les connaitre et les comprendre. Elles portent notamment sur le cycle de vie de l'animal, son comportement, son rôle éventuel de vecteur biologique, ainsi que sur les sujets suivants :
Traçabilité[modifier | modifier le code]
Ces parasites se montrent capables de se déplacer sur d'assez grandes distances. Les études écoépidémiologiques seraient plus précises si les scientifiques pouvaient disposer d'informations précises sur l'origine des œufs, larves et poux adultes trouvés en mer et/ou sur les poissons. Il serait utile d'au moins pouvoir différencier ceux qui proviennent d'une ferme piscicole de ceux qui se sont nourris sur des poissons sauvages. Il a été proposé pour cela d'utiliser les pigments caroténoïdes de Lepeophtheirus salmonis (ou de ses œufs)[76]. En les comparant aux pigments échantillonnés sur des saumons sauvages (Salmo salar L.) et sur des saumons d'élevage (c'est-à-dire nourris avec des aliments artificiels), il est possible de distingur si un œuf provient d'une femelle ayant parasité un poison sauvage ou d'élevage. Les pigments dominants observés au chromatogrammes (HPLC) sont l'astaxanthine quand l'hôte était un saumon sauvage, et de type canthaxanthine s'il était un saumon d'élevage. Néanmoins ce traceur est d'utilisation difficile car il existe une grande variation des concentrations en pigment dans les aliments utilisés par les fermes salmonicoles et il existe aussi une variabilité naturelle chez les poux "sauvages"[76].
Modélisation[modifier | modifier le code]
Il est difficile d'établir un monitoring fin sur de vastes territoires marins. Les scientifiques et la filière salmonicole font donc appel à des modélisations mathématiques et informatiques.
Objectifs et enjeux de la modélisation[modifier | modifier le code]
Ces modèles visent à mieux « prédire » les lieux, les conditions et les moments où les risques d'infestation sont les plus élevés, la dérive planctonique des larves et leur taux de survie, ainsi que d'éventuels phénomènes d'expansion et d'advection (de déplacement) du pou du saumon selon des facteurs ou « forçages » biologiques ou physiques (tels que vents/tempêtes, courants, apports d'eau douce liés aux crues et à la fonte des neiges, les « vagues internes », températures, salinité, etc.[77]), ainsi que selon la date, la durée et la pression d'exposition des poissons aux parasites.
Ces modèles chercheront aussi à mieux prévoir les risques d’infestation avec co-infections bactériennes ou virales, les risques de contagion d'un parc à l'autre et d'une ferme salmonicole à l'autre[78], ainsi que l'efficacité de différentes mesures d'atténuation ou de gestion des risques.
Types de modèles en cours de développement[modifier | modifier le code]
Divers modèles sont en cours de développement notamment en Norvège (par exemple pour le Romsdalsfjord sur la base du modèle hydrodynamique SINMOD[79] et au Canada dans le cadre des recherches soutenues par le gouvernement en matière d'aquaculture[80], en lien avec le « Forum du saumon du Pacifique » et le « Programme de recherche sur la réglementation de l'aquaculture » (MPO), notamment pour l'archipel de Broughton.
Les principaux types de modèles sont :
- des modèles hydrodynamiques : tridimensionnels et idéalement à haute résolution, ils doivent simuler avec assez de précision le milieu marin dans lequel les parasites et leurs hôtes vivent et interagissent ;
- des modèles de dynamique des populations : ils concernent les saumons d'une part, et les poux de mer d'autre part (ce qui implique de bien connaitre la part des œufs de copépodes fécondés qui donnera des larves viables aux différents stades d'infestation.
Le travail des modélisateurs est compliqué par le fait que le pou de mer a d'abord une phase de vie planctonique et pélagique et qu'ensuite certains de ces poux se développeront sur des saumons enfermés dans les parcs ou sur des saumons sauvages beaucoup plus mobiles. Le cycle de développement du saumon est également complexe et encore assez mal connu pour ce qui concerne la phase de croissance en mer. Les modèles doivent aussi pouvoir tenir compte des différences de contextes biogéographiques. Les scientifiques et les éleveurs doivent aussi intégrer de nombreux facteurs encore mal compris. L'enjeu est de mieux comprendre à partir de quand (nombre de poux, densité de femelles, etc.) un seuil est atteint ou un traitement chimique est inutile ou utile[81]...
- des modèles de patterns et de dispersion des larves[27] : très liés aux modèles de dynamique de population, ils doivent décrire la répartition spatio-temporelle des individus d'une espèce, poux, saumons ou espèces proches (truites de mer par exemple[82]). Ils serviront à évaluer ou prévoir les risques d'infestation et les liens entre l'intensité et types de salmoniculture et l'abondance locale de poux de mer sur les poissons sauvages (saumons ou autres). Ils nécessitent notamment de comprendre les variables environnementales qui influencent la densité de poux du poisson à un instant « t » (dont par exemple le facteur "température" et la quantité des apports d'eau douce en mer)[82]. Ces modèles sont calés sur des comptages de poux in situ (un comptage de poux a par exemple porté sur 4 800 truites de mer capturées dans 15 fjords norvégiens en 6 ans (2004-2010)[82] ; ils ne remplacent donc pas un programme de surveillance[82].
- des modèles zootechniques qui vont simuler les effets des différentes stratégies possibles des éleveurs.
- des modèles écoépidémiologiques : ils doivent idéalement tenir compte des interactions classiques « prédateurs-proies », et d'évolutions temporelles parfois contradictoires (ex : apparition en quelques années de médicaments-pesticides et de vaccins traitant des maladies du saumon, mais aussi d'adaptations des poux, qui par le biais de la sélection naturelle résistent de mieux en mieux à un ou plusieurs de ces pesticides). Les modèles pourront peu à peu mieux intégrer des variables climatiques ou d’intérêt écoépidémiologiques de risques et facteurs de propagation de maladies virales ou bactériennes par exemple et jouer un rôle plus « prospectif ».
Couplages de modèles et premiers résultats[modifier | modifier le code]
Les modélisateurs cherchent à coupler les modèles cités ci-dessus, et à les améliorer par étapes au fur et à mesure des retours d'expérience et de l'amélioration de la connaissance de l'espèce et de ses effets sanitaires et écologiques.
En 2010-2012, les modèles couplés sont encore relativement rudimentaires. Ils ne considèrent leurs principaux « acteurs » (c'est-à-dire les poux et les smolts en migration) que comme des particules dérivant avec les courants et marées, et "risquant" de se rencontrer[83], alors qu'en réalité les poux semblent capables de proactivement détecter leurs proies et de s'en approcher. Les rencontres entre le poux et sa "proie" ne sont pas dues au seul hasard des courants et de la trajectoire des smolts, mais les comportements - en mer - de ces deux acteurs sont encore mal connus.
Les modélisateurs peuvent néanmoins déjà - dans une certaine mesure - "corriger" les modèles initiaux ou couplés en s'appuyant sur les séries statistiques collectées in situ depuis le début des années 2000 sur quelques sites mieux suivis (ex : comptage sur les saumons pêchés au filets ou élevés en parcs, comptage des poux sur des smolts-sentinelles (conservés en cages flottantes au Canada ou en Norvège[84],[5],[85])… Ils pourront aussi et peu à peu les améliorer en s'appuyant sur une meilleure connaissance de l'écologie des espèces, des systèmes salmonicoles et des écosystèmes concernées. On a ainsi pu montrer que Lepeophtheirus salmonis semble plus dépendant des installations salmonicoles que Caligus clemensi), que les pratiques salmonicoles pouvaient augmenter ou réduire le risque d'infestation.
Les modèles doivent être "calés" sur les données de terrain. Ils peuvent ensuite aussi être "vérifiés" par des simulations a posteriori sur des événements passés de pullulation[17],[67]. Côté pacifique nord-est, des relations interspécifiques entre saumons pourraient également intervenir : un modèle laisse penser que la prédation de juvéniles de saumons roses parasités par des poux pourrait aussi augmenter celle de leurs prédateurs quand le prédateur est un juvénile de saumon coho de plus de 100 mm[86].
- Les modèles disponibles en 2012 au Canada comme en Europe confirment que la plupart des poux de mer qui s'accrochent sur les smolts proviennent des élevages de saumons les plus proches, même si certaines larves peuvent se laisser porter à grande distance par les courants[84].
- Des simulations faites pour 2008 et 2011 pour un fjord écossais de grande importance salmonicole montrent que les larves de poux issues d'œufs pondus dans ce fjord peuvent être facilement transportées sur des distances de 20 à 30 km par le courant[87]. Ce faisant, elles peuvent potentiellement traverser les zones de cages d'élevage, avant de devenir copépodites « en concentrations élevées mais localisés »[87]. Selon ce modèle (qui doit être affiné en 2013), dans ce contexte au moins « les copépodites se développent souvent loin des hôtes de leurs parents »[87].
- Un modèle "sans élevages" montre que s'il n'y avait jamais eu d'élevages en parcs marins, les juvéniles arrivant en mer auraient peu de risques de contracter un parasite qui proviendrait de saumons adultes[88], alors que tous les modèles avec élevage montrent que ce risque existe maintenant et qu’il augmente avec le nombre d’élevages et la quantité de saumons parasités qu’ils abritent.
On cherche donc à mieux modéliser le risque de rencontre des larves dispersées par les élevages avec les juvéniles sauvages qui migrent vers la mer via certains corridors écologiques marins.
Ecoépidémiologie[modifier | modifier le code]
Enjeux : Les ectoparasites sont potentiellement vecteurs d’autres parasites ou de maladies infectieuses, notamment parce qu’ils sont souvent capable d’affaiblir le système immunitaire de leur hôte (au moins autour de leur point de fixation ou d’alimentation, de manière que celui-ci ne les rejette pas), et parce qu’ils sont sources de blessures externes qui sont autant de portes d’entrées pour des agents infectieux. Des études sont en cours à ce sujet, de même qu'à propos des réactions des poux du saumon à leurs propres pathogènes ou aux pathogènes dont ils seraient éventuellement « porteurs sains », dans divers contextes environnementaux (p. ex. température, salinité, selon le stade larvaire, le sexe, etc.).
Deux agents pathogènes ont notamment requis l’attention des scientifiques : Aeromonas salmonicida et le virus de la nécrose hématopoïétique infectieuse (vNHI), car il est maintenant démontré que
- le poux du poisson peut passivement acquérir ces agents dans l’eau, quand les concentrations de bactéries ou de virions y sont élevés (ce qui est le cas en contexte d’épidémie dans un élevage) ;
- il peut aussi s’infecter en s'alimentant sur des saumons malades (saumon atlantique, saumon rose ou saumon kéta).
Reste à évaluer dans quelle proportions ces agents peuvent être diffusés par les poux (mâles et/ou femelles) entre eux ; entre saumons hôtes ; et du saumon d’élevage vers des saumons sauvages ou inversement ;
La réponse immunitaire du saumon face à la parasitose par le pou du poisson : Les données disponibles évoquent des réponses immunitaires temporellement et biologiquement différentes selon l’espèce de saumon considérée ; par exemple le saumon atlantique, saumon rose et saumon kéta réagissent différemment au parasite, avec des différences d'expression génomique : le saumon rose répond par une réaction inflammatoire vive, marquée par une production élevée d'interleukine-1, Bêta (IL1β), alors que le saumon atlantique réagit plus vite avec une expression initiale plus forte. De manière générale, les juvéniles du saumon rose et du saumon Coho y résistent bien une fois leur smoltification tout à fait terminée, alors que le saumon chum et le saumon atlantique y sont plus vulnérables (affaiblissement ou mort plus fréquents)[89]. Le système immunitaire du saumon atlantique réagit peu au parasite, mais il a été montré que l'ajout d'immunostimulants (exemple : Oligodéoxynucléotide CpG, connu pour être immunostimulant) dans sa nourriture améliore cette réaction[90] et pouvait améliorer la résistance naturelle du saumon (le saumon ainsi stimulé est jusqu'à moitié moins parasité[91]). Cette stimulation pourrait aussi accompagner un traitement chimique pour le rendre plus efficace[91].
Capacités naturelles de résistance des saumons : Des études canadiennes (2007-2011)[92] reposent sur l'observation d'une part d'infections contrôlées de saumons juvéniles par des poux au stade copépodite, et d'autre part sur l'observation des juvéniles en mer. Le juvénile du saumon rose s'y montre très vulnérable, mais seulement à une certaine période de sa vie[93]. Au-delà de cette période (quand il a dépassé les 2-3 grammes), il peut se débarrasser des poux qui le parasitent ou les supporter sans effet apparent (on dit qu'ils sont résilients à ces « attaques » ; par exemple, après un mois de parasitisme, les juvéniles parasités une fois que leur peau écailleuse est complètement [manque un mot ici] prennent autant de poids que les individus non parasités[94] ; leur performance natatoire (endurance) n'est pas diminuée[95]), pas plus que leurs capacités sur le plan de l'équilibre ionique.
Au contraire, quand ils arrivent en mer et tant que leur masse corporelle ne dépasse pas 0,5 à 0,7 g les juvéniles sont très sensibles aux poux. En laboratoire, 37 % des juvéniles de moins de 0,7 g “infestés” par 1 à 6 poux (4,7 poux par poisson en moyenne) meurent en moins de 36 jours avec une mortalité corrélée au nombre de poux, et les survivants étaient moins gros. Alors que les saumons juvéniles un peu plus âgés (pesant 2 à 3 g ou plus) toléraient très facilement une infestation initiale par 6 poux et même grandissaient aussi vite que leurs congénères non infestés[93].
Il semble que le développement des écailles et les changements dans la composition de la peau du poisson réduisent la vulnérabilité des juvéniles de 2 - 3 g et plus aux infestations par des poux des poissons[93].
Il a été noté que la « présence de poux dans une colonne d'eau de 10 m » a un effet sur la distribution verticale et diurne du saumon rose juvénile. On sait qu'à son arrivée en mer, il fréquente d'abord plutôt le mètre supérieur de la colonne d'eau, avant de progressivement s'enfoncer en profondeur alors que son organisme finit de s'acclimater au milieu salé, avec toutefois un cycle nycthéméral marqué (la nuit, le juvénile tend à remonter en surface.
Si expérimentalemment des juvéniles de saumons« sont mis en présence de L. salmonis pendant trois heures, de 43 à 62 % des poissons sont infectés et les poissons élargissent leur distribution verticale » ; le juvénile infecté rechercherait une eau moins salée[96],[97]. Rien n'indique que ce soit pour se débarrasser du pou qui ne supporte pas l'eau douce comme on le lit parfois. Son équilibre osmotique perturbé le pousse plutôt à rechercher un milieu moins salé de type Fleuve marin côtier, qu'il peut par exemple trouver en aval de grands estuaires.
Effets collatéraux des pesticides utilisés pour lutter contre le pou du saumon. Ces produits sont de plus en plus utilisés, en bassins d'élevage ou en bateaux viviers (ex en réservoirs de 480 à 550 m3)[98]. Ils sont toxiques pour de nombreuses espèces d'invertébrés non ciblés, et des crustacés notamment (crevette, crabe, homard) ou des organismes filtreurs (moules par ex). Les « panaches de diffusion » de ces pesticides libérés dans l'environnement (ou de leurs métabolites) ainsi que leur évolution temporelle en fonction des courants ont été évalués sur quelques sites au moyen de colorants (fluorescéine[99]), montrant de grandes variations selon les contextes ; « L'élimination du colorant des cages de traitement prenait de quelques minutes à quelques heures et dépendait sans doute de l'encrassement biologique des filets et de la vitesse des courants » ; Les pesticides résiduels sont retrouvés en concentrations significatives jusqu'à quelques kilomètres parfois sur une période de 1 à 3 heures après le déversement[99]
En 2011, dans le cadre d’un programme de recherche canadien[100], la crevette tachetée a été exposés en laboratoire, à des taux de 100, 400, 800, 1 200 et 4 800 ppb de BE (durant un délai atteignant 8 jours). Du BE a aussi été ajouté aux sédiments des aquariums où les crevettes étaient maintenues. À toutes les doses, une variation de la production d'ARN a été observée, avec une expression différentielle de gènes dans les tissus musculaires. Des études complémentaires sont nécessaires pour expliquer ces modifications comprendre et où leur conséquences pour l'espèce.
Moyens de lutte[modifier | modifier le code]

Ils sont de plusieurs nature :
Stratégies zootechniques et sanitaires[modifier | modifier le code]
Pour la salmoniculture (comme dans les poulaillers industriels) la stratégie d'élevage peut être adaptée pour moins favoriser les parasites, avec par exemple
- un meilleur positionnement des installations (positionnement des cages les unes par rapport aux autres, et par rapport aux courants) ;
- les « mises en vide sanitaire » (parfois nommées « mise en jachère ») : Elles se font de manière annuelle (généralement en milieu d'hiver) ou en situation « post-épidémie » ; les modélisations comme le suivi de poissons-sentinelles montrent que si elles sont faites au bon moment dans l'année, elles peuvent fortement limiter le risque d'infestation des smolts sauvages[5] et le risque de réinfestation rapide des saumons d'élevage. Elle est pour cette raison devenue obligatoire dans le Hardangerfjord en Norvège, où elle doit être synchronisée entre élevages pour augmenter son efficacité (sinon un élevage non mis en jachère devient une source de réinfestation rapide pour les parcs voisins[5] ;
- une modification des cycles de certains traitements chimiques peut éviter de libérer des quantités d'œufs et de larves au moment où arrivent en mer les saumons juvéniles sauvages (période durant laquelle ils sont les plus vulnérables à cette parasitose)[101] ;
- une modification des cycles de production peut limiter le temps de présence des saumons élevés avec le parasite quand il est apte à se fixer sur le saumon[102] ;
- une capture plus précoce (un à deux mois plus tôt) des saumons élevés en parcs semble aussi diminuer le taux de parasitose[17].
- la lutte biologique.
La lutte biologique[modifier | modifier le code]
Elle est utilisée par les éleveurs de saumons bio, selon eux avec autant de succès que les autres salmoniculteurs qui utilisent tous des produits chimiques[103],[104], mais demande de connaitre les prédateurs naturels du poux et de les favoriser. En particulier :
- Des labres (Labridae) sont utilisés comme "poissons-nettoyeurs" dans des élevages salmonicoles bio depuis la fin des années 1990 au moins, dont en Norvège et Écosse, autour de partenariats associant notamment (2010) Villa Organic, Marine Harvest et la station de recherche aquacole de l'« Institute of Marine Research » d'Austevoll[103]; et dans d'autres élevages souvent en complément d'autres traitements[105]. Diverses espèces de labres se nourrissent de crustacés (crevettes notamment), et quand ils sont juvéniles peuvent consommer les ectoparasites d'autres poissons. La plupart de ces espèces de labres ne vivent pas dans les zones d'élevage des saumons, mais le « labre ballan » qui y vit a semblé être un candidat idéal (jusqu'à 300 poux de mer trouvés dans un seul estomac de ce labre). Cependant, avec quelques autres espèces de labres, il a récemment été trouvé lui-même porteur de poux de mer[106] peut-être acquis à partir des élevages. Des labres ballan utilisés comme poisson-nettoyeurs de saumons en Écosse ont aussi été victimes d'une infection inhabituelle pouvant être transmise par les saumons (ex : Aeromonas salmonicida[107]).
En 2012, Maya et al. invitent à utiliser des « modèles individus-centrés » (Individual-based models ou IBMs) qui pourraient être plus utiles que les modèles déterministes pour étudier et simuler le rôle potentiel du « labre Ballan » dans les élevages, et plus généralement sous l'angle de la dynamique des populations et de l'alternative aux pesticides[105].
Il faut aussi maîtriser l'élevage d'alevins du labre Ballan jusqu'à l'âge d'un an environ pour pouvoir les introduire en quantités suffisantes dans les cages de salmoniculture. La demande estimée en 2010 était d'environ 15 millions de labres ballan par an[103], soit un marché de 250 millions de couronnes norvégiennes par an pour la Norvège pour les années 2010-2020 si elle réussit comme elle en a le projet à maîtriser cet élevage[103]. Il faut aussi nettoyer les filets des parcs d'élevage pour que les labres ne s'y nourrissent pas, ce qui est un gros travail quand cela n'est pas fait chimiquement (dans les élevages "bio")[103].
- Parmi les prédateurs naturels de larves de L. salmonis figurent certains animaux filtreurs (fixés ou non) pouvant être élevés par les pisciculteurs, comme cela est déjà fait par certaines formes d'aquaculture biologique avec « l'aquaculture multi-trophique intégrée » (IMTA pour Integrated multi-trophic aquaculture).
Des essais ont montré que les coques (Clinocardium nuttallii), des moules (Mytilus spp.), des huîtres (Crassostrea gigas), le pétoncle du Pacifique (Mizuhopecten yessoensis x Patinopecten caurinus) et des coquilles Saint-Jacques consomment ces larves (au stade naupliien surtout, en plus grandes quantités quand ces coquillages sont gros et quelle que soit la température de l'eau ; de 5° à 15 °C pour les études faites en Amérique du Nord)[108].
La réglementation des piscicultures évolue en intégrant des principes de biosécurité. Au Canada, les contrôles et audits ont été, comme dans d'autres pays, renforcés[109].
Pesticides chimiques[modifier | modifier le code]

Selon un reportage réalisé par France 3 sur les élevages intensifs de saumon en Norvège, certains pesticides tel le diflubenzuron seraient injectés directement dans l'eau, entraînant des conséquences importantes pour l'environnement, en plus d'entraîner des brûlures et déformations importantes sur les saumons en captivité. Il a été également démontré, selon un propriétaire interviewé, que tous les poissons autres que ceux de l'élevage se trouvant à proximité pendant le déversement du produit dans l'eau meurent systématiquement[111].
Des traitements antiparasitaires périodiques des installations aquacoles marines sont régulièrement conduits à l’aide des pesticides spécifiques. Ils peuvent être obligatoires au-delà d'un certain seuil d'infestation.
Ils peuvent être très stressants pour les poissons. Ils impliquent aussi un délai entre le dernier traitement et la mise sur le marché du saumon pour garantir que le poisson soit conforme à la limite maximale de résidus de pesticides.
Dans les années 2000 à 2010, tous les traitements connus ont perdu de leur efficacité (ou sont encore plus toxiques pour le poisson que pour le pou). Leur efficacité avait toujours été surestimée.
Ceci a incité des scientifiques norvégiens à proposer de nouvelles méthodes pour calculer plus précisément les marges d'incertitude dans les études portant sur l'efficacité des traitements antiparasitaires[112]. Pour limiter les biais d'évaluation de toxicité aiguë d'un antiparasitaire contre le pou du saumon, il est également important de pouvoir bien différencier et compter les poux vivants, moribonds et morts (après un ou plusieurs traitements du saumon par un ou plusieurs pesticides, et aux différents stades de développement du pou) ; le colorant rouge neutre peut y contribuer[112]. Une autre étude a montré que le taux d'infestation pouvait significativement varier selon les cages d'un même environnement, ce qui doit être mieux pris en compte par les modèles et par les protocoles de comptages utilisés lors des évaluations d'infestations[113]. Si la prévalence est faible, la loi de distribution statistique sera de type distribution binomiale négative ; alors qu'à forte prévalence la distribution tend à être normale. La stratégie fréquente de surveillance par échantillonnage de la cage manifestement la plus infestée d'une ferme pour lancer au-delà d'un certain seuil un traitement chimique est donc erronée[113] ; la précision dans l'estimation de la prévalence et de l'abondance des poux sur le site nécessite un échantillonnage aléatoire de plusieurs cages, comptage qui semble pouvoir être fait par le personnel. « Il n'existe aucune preuve de partialité systématique découlant de l'utilisation du personnel de la ferme pour compter les poux de mer adultes par rapport à des équipes de comptage dédiées »[113], mais les employés tendent à sous-déclarer le nombre de larves au stade chalamus et préadulte par rapport aux audits faits par un tiers spécialisé et indépendant (selon une étude ayant porté sur 28 comptages faits en 2011 dans 16 fermes à saumons du Nouveau-Brunswick par des auditeurs d'un côté et par le personnel de l'autre)[114].
Les biocides ou pesticides utilisés sont :
- le benzoate d'émamectine (BE), matière active d'un médicament vétérinaire vendu sous le nom SLICE et seul produit homologué au Canada entre 2000 et 2011 contre le pou du saumon. Il s'agit d'une avermectine autrefois efficace sur les stades juvéniles pré-adultes et les stades adultes des poux du poisson et d’autres copépodes, notamment sur les femelles[115].
Ce pesticide est distribué aux saumons par voie orale (en mélange à l’alimentation) et à des doses de plus en plus élevées pour compenser les phénomènes d'adaptation du pou de mer à ce produit (par exemple dosages passés de 50 à 100 μg kg-1 voire 150 μg kg-1 sur 7 jours). De nombreux cas d'émergence de résistance à cette molécule ont été écrits (avec une résistance différente selon qu'il s'agisse de poux mâles ou femelles[116] (et on connait déjà chez les poux des poissons des génomes plus ou moins sensibles à ce produit[117],[118]), il réduit d’environ 80 % en un mois l’abondance des copépodes parasites de l’élevage[75] et maintient un taux d’infestation assez bas durant au moins 3 mois[75]. Cependant, les restes d’aliments qui « pleuvent » sous les cages d’élevage ou sont emportés par le courant deviennent une source de contamination environnementale par les biocides. Cette nourriture est distribuée sous forme de granulés de taille et nature adaptés à l'âge et aux besoins du poisson. Toute la nourriture n'est pas consommée par les poissons. Les restes des granulés (et du médicament qu'il contiennent) « pleuvent » sur le sédiment sous-jacent et/ou sont emportés par le courant. Ils peuvent aussi être directement consommés par d'autres espèces animales, et certaines d'entre elles (moules, crustacés, poissons…) peuvent être pêchées pour être consommées par l’homme. Des études portent sur le devenir de ces restes alimentaires[119], et un modèle animal utilisé pour étudier les effets de la dispersion dans l'eau de ce pesticide sur des crustacés, a été la crevette tachetée du Pacifique (Pandalus platyceros) dans les muscles de laquelle on retrouve effectivement du BE quand ces crevettes ont grandi près de fermes salmonicoles ayant été traitées au SLICE[102], avec des effets observés sur l'expression des gènes du système musculaire de la crevette.
- Pyréthrinoïdes. Ce traitement « topique » utilise en « bains » un pesticide fréquemment utilisé dans les bombes insecticides domestiques[120]. Le produit montre une certaine toxicité pour les crustacés, mais également pour les poissons[120]. Aux doses utilisées, il peut être stressant pour le poisson, notamment parce que dans l'eau ce produit consomme environ 50 % de l'oxygène dissous[120]. Après le traitement, les saumons montrent parfois des comportements anormaux (changements de la vitesse de nage, hyperactivité)[120].
- l'azaméthiphos (molécule organophosphorée, ingrédient actif du Salmosan). Il est utilisé en bâche ou en « bateau vivier » à la dose de 100 à 150 μg/litre, en tant qu'ingrédient actif avec un temps de contact qui doit être de 30 à 60 min (selon la température). Il est efficace contre les étapes adulte et préadulte du pou, hors éventuel phénomène de résistance acquise. Il a comme inconvénient de ne pas être spécifique et d'être très écotoxique (« La CL 50 après une heure d'exposition se situait entre 30 et >100 μg/litre, tandis que la concentration la plus élevée sans effet observé létale se situait entre <0,4 et 19 μg/litre, selon l'espèce et l'étape du cycle de vie, à des températures ambiantes de l'eau de 8 à 12 °C (concentrations mesurées) »[99]).
- la deltaméthrine (ingrédient actif de l'AlphaMax utilisé depuis le milieu des années 1990 en Norvège). Ce produit, utilisé en bains, présente le même inconvénient que le précédent. Il est écotoxique, mortel pour d'autres invertébrés dont crustacés et en particulier le homard qui est parfois pêché à proximité des parcs d'élevage[99]. Il se montre mortel pour le homard à des taux de 0,01 à 0,14 μg/litre pour une exposition de 24 h (selon le stade du cycle de vie des homards). La crevette mysis effilée[99] et d'autres y sont aussi très vulnérables, alors que la crevette grise y résiste mieux[121].
- les flubenzurons (téflubenzuron et diflubenzuron) administrés oralement[122], qui interfèrent avec le synthèse de la chitine du pou de mer[122]. Ces produits sont peu métabolisés par le saumon ; il les rejette dans ses excréments, qui peuvent en contenir des doses deux fois plus fortes que ce que contenait la nourriture donnée au saumon[122]. Assez peu solubles dans l'eau, ils tendent à se disséminer avec la matière organique issue des excréments[122]. Ils sont a priori hautement toxiques pour toutes les espèces de crustacés (dont crevette, crabe, homard…). Ils ont été utilisés dans les années 1990 et jusqu'en 2001 en Norvège, avant d'être remplacés par d'autres produits (emamectine, cyperméthrine et deltaméthrine). Mais après que ces trois produits eurent perdu de leur efficacité, les flubenzurons ont été réintroduits dans la nourriture des saumons en 2008 (avec 3 441 kg utilisés en 2009 puis 2 919 kg en 2010)[122].
- le peroxyde d'hydrogène, ingrédient de l'Interox-Paramove 50 (50 %). Il est autorisé dans certains conditions (par exemple dans les bateaux-viviers au sud-ouest du Nouveau-Brunswick (en 2013)[99]. Il est utilisé « à grande échelle »[123] en Europe et Amérique contre le pou du poisson aux étapes adulte et préadulte, avec un dosage de 1 800 mg/litre comme ingrédient actif durant 20 à 30 minutes, selon la température de l'eau. « La concentration la plus élevée sans effet observé létale après une heure se situait autour de <187 mg/L pour la mysis effilée et la crevette de sable et entre 375 mg/litre et 2 100 mg/litre pour le homard aux étapes I et adulte, respectivement (concentrations mesurées) »[99]. Ce traitement, qui se fait souvent au moment de la mise en place d’un « vide sanitaire », est en réalité efficace pour décrocher les poux de la peau des saumons, mais quasiment inefficace quant à la lutte antiparasitaire car le peroxyde d’hydrogène ne débarrasse que provisoirement les poux des saumons ; ils ne les tue pas ni même n'inhibe leur reproduction[123]. Une étude récente s’est basée sur le comptages des poux vivants, des poux capables de se reproduire, sur la survie des œufs et des poux à différents stades de développement, en récupérant dans l’eau les poux décrochés de 6 000 saumons exposés durant de 22 min à 1 460 ppm de peroxyde d’hydrogène[123]. Dans ce cas, le taux d’infestation avant traitement était très élevé : environ 40 poux par poisson (soit 220 000 poux pour 6 000 saumons)[123]. Plus de 80 % des femelles adultes y ont en outre survécu bien que restant sans hôte durant 7 jours, et après 19 jours sans un hôte, 20 % de ces femelles étaient encore actives[123]. Le taux d'éclosion des œufs portés par les femelles gravides a été similaire à celui du groupe témoin non traité, qu’elles aient ou non été traitées au peroxyde d’hydrogène[123]. Et les taux d'éclosion étaient similaires pour les chapelets d'œufs attachés ou détachés de femelles gravides traitées[123].
Difficultés : des émergences de populations de poux résistantes aux pesticides se produisent en continu. Toute stratégie antiparasitaire chimique induit d'une part un risque d’effets environnementaux collatéraux et adverses et d’autre part le risque de voir apparaître des phénomènes de résistance aux pesticides (fréquemment observés chez d’autres arthropodes dans le monde).
- Ainsi, en 2013, plus de 500 cas de résistance d'un arthropode à un ou plusieurs biocides ont été documentés par la littérature scientifique, et ce pour tous les principaux groupes d'insecticides connus. L'exposition continue ou répétée et intensive des arthropodes à ces produits chimiques est une source de pression sélective qui a induit chez de nombreuses espèces la sélection de mutations aboutissant à des phénotypes résistants à un ou plusieurs pesticides (une résistance croisée apparait souvent : un même mécanisme de résistance confère à l'arthropode une protection contre les effets de plusieurs insecticides, souvent d'une même famille chimique néanmoins). Parfois plusieurs mécanismes adaptatifs sont présents chez un même individu, qui résiste alors à plusieurs familles de pesticides[110].
- Des chercheurs, avec l’industrie du saumon (au Canada : Intervet Schering-Plough et Marine Harvest Canada ) suivent donc en laboratoire et in situ (par évaluation des taux d’infestation) la vulnérabilité du pou du poisson aux antiparasitaires chimiques utilisés par les salmoniculteurs[17].
- Lors de des tests récents, au stade « chalamus » du parasite, ces pesticides (et d'autres également testés tels que Resméthrine (pyréthroïdd), ivermectine (lactone macrocyclique) ou le B7 (milbémycine) s'avèrent plus toxiques pour le poisson que pour le parasite[124].
- On a récemment montré que les phénomènes de résistance peuvent apparaître de manière différenciée chez le poux mâle et la femelle, et à divers stades de leur développement[125].
- Les mécanismes génétique de ces résistances font l'objet d'études (pour le benzoate d'emamectine par exemple[117]).
- Enfin, des saumons sains et "naïfs" (c'est-à-dire n'ayant jamais été parasités par un pou de mer) ont été placés dans des bacs de 1 m et mis en présence des poux ayant subi le traitement ; un peu moins de poux mâles adultes ou préadultes se fixaient sur ces saumons par rapport à ceux d’un groupe-témoin non traité, mais pour tous les stades fixés du pou il y a eu des "réattachements post-traitement" (pour 30 % des poux traités comparativement à 43 % pour le groupe témoin non traité). Le péroxyde détache provisoirement au moins les poux de la peau du saumon, mais il se montre in fine peu efficace, et probablement stressant pour les saumons. Le péroxyde semble en effet endommager le mucus et la structure de la peau des saumons traités et favoriser leur réinfestation par des poux. « Les dommages au derme (...) pourraient aussi entraîner le rejet par le saumon de substances sémiochimiques ou chimiotactiques absolument irrésistibles pour le pou du poisson »[126].
Il conviendrait aussi de compléter les traitements au peroxyde par une filtration de l’eau de manière à récupérer et détruire les adultes, larves et œufs de poux de mer. En 2013, les bateaux viviers ne sont pas prévus pour cela, mais l'adjonction de système de filtration des eaux de rejets semble possible.
En 2012, T.E. Horsberg recommandait[127], sur la base d'une veille écoépidémiologique et d'essais de traitements en environnement contrôlé de :
- préférer tant que possible les stratégies "non chimiques" de contrôle des poux, surtout quand des résistances apparaissent ;
- n'appliquer les traitements chimiques que dans le cadre d'une stratégie réfléchie et coordonnée entre régions voisines (sinon le traitement n'aura qu'une efficacité locale et de courte durée ;
- n'utiliser que des traitements assez efficaces pour ne pas favoriser de résistances ;
- renforcer la rotation des produits utilisés ;
- favoriser les traitements alternatifs même s'ils sont plus coûteux ou demandent plus de travail.
- écotoxicité difficile à maîtriser : Selon les données disponibles en 2013, l'incidence écotoxique varie selon le contexte marin (courant, profondeur…), selon l'espèce et le moment de son cycle de vie (les larves peuvent être bien plus sensibles que les adultes), et bien entendu selon l'agent thérapeutique utilisé : la toxicité des produits empire de l'Interox-Paramove 50 au Salmosan 50 WP à l'AlphaMax (deltaméthrine)[99].
Ainsi pour le homard, l'AlphaMax (deltaméthrine) est plus toxique que le Salmosan 50 WP, lui-même plus toxique qu'Interox-Paramove 50[99], et « des expositions d'une heure à des concentrations de traitement de Salmosan de 5 % et de 10 % (respectivement 5 μg/L et 10 μg/L) deux fois par semaine ont donné lieu à des taux de mortalité considérables et à une réduction du taux de réussite du frai des homards ayant survécu. Par conséquent, des tests de laboratoire confirment les effets sublétaux et différés à l'exposition à des concentrations de Salmosan 50 WP inférieures aux concentrations de traitement prescrites »[99].
Évaluation des effets adverses des pesticides salmonicoles[modifier | modifier le code]
Des études visent à évaluer les effets collatéraux du peroxyde d'hydrogène et surtout de l’antiparasitaire (SLICE) sur les espèces non-cibles qui vivent autour des systèmes ouverts de salmoniculture.
Le Canada avait en 2011 un triple objectif :
- évaluer les taux de matière active (BE) et de son principal métabolite (le BE déméthylé) dans l'environnement ;
- évaluer in vitro et en laboratoire l’effet des panaches et de leurs concentration dans l'eau mais aussi sur les organismes des sédiments (qui font en outre l'objet de suivis en ce qui a trait à l'eutrophisation/dystrophisation afin d'éviter l'apparition de zones mortes par la mise en place de "mises en jachères" quand les pollution est trop importante sous une cage de pisciculture en mer[128],[129].
- évaluer (par des techniques génomiques) l’impact de ce pesticide sur une espèce d’intérêt commercial qui est aussi la nourriture de poissons sauvages, la crevette tachetée.
Ceci a été fait en Colombie-Britannique, avec l’aide de l' Institut des sciences de la mer de Pêches et Océans qui ont développé des méthodes affinées d'analyses permettant de détecter dans l'eau ou le sédiment jusqu’à 1 ppb de ces produits (c'est-à-dire une partie par milliard), par spectrométrie de masse ( LC/ESI-MC (chromatographie liquide/ionisation par électronébulisation – spectrométrie de masse).
On a ainsi pu confirmer que le taux de BE pouvait être significativement élevé sous les cages en filet (jusqu’à 30 ppb trois semaines après le début d’un traitement au SLICE) ; Les sédiments peuvent aussi en accumuler à proximité de l’élevage (plus ou moins selon la nature du sédiment et les conditions de courant, mais avec une certaine rémanence), bien que le produit se diluait rapidement aux alentours (au-delà de 60à 100 m autour de la ferme salmonicole).
Un modèle informatique simplifié dit DEPOMOD[130] est utilisé depuis 2004 pour mieux prédire l'évolution du BE dans les écosystèmes aquatiques et le cas échéant préciser la réglementation en matière de protocoles de traitements par le SLICE[131].
Solutions alternatives et efforts de réduction des effets adverses des pesticides salmonicoles[modifier | modifier le code]
Diverses pistes sont explorées ou peuvent l'être pour utiliser plus efficacement moins de produits, trouver des alternatives moins écotoxiques et contrôler leur rejets en mer (rejets prétraités ou dilués sous les seuils de toxicité[99]).
- ECO-Bath est le nom d'un réservoir de traitement expérimenté au Canada. Il permet d'isoler les poissons dans un environnement contrôlé le temps du traitement, ce qui permettrait aussi réduire l'utilisation totale de pesticides et la contamination environnementale[49]. La manipulation des saumons pour les y introduire peut cependant être une source de stress pour eux. On a montré que le mélange d'un « épouilleur chimique » dans l'eau est très important[132]. Or comme la taille des bassins et le nombre de saumons tendent à augmenter, le risque que certains saumons soient surexposés au produit (dans un hotspot chimique) alors que d'autres y soient sous-exposés doit être mieux maitrisé[133].
- Captage des molécules antiparasitaire toxiques : les capturer à fin d'exportation (pour destruction ou mise en décharge) avant leur rejet dans l'environnement est une stratégie également étudiée. C’est une étape de gestion des risques qui peut être ajoutée au traitement en bateaux viviers ou La filtration de l’eau sur charbon activé pur a été testée pour le Salmosan (azaméthiphos) , l’Alphamax (deltaméthrine) avec une absorption de 90 % des ingrédients actifs, mais les salmoniculteurs auraient alors de grandes quantités d’eau à filtrer et/ou de fréquents changements du charbon de bois.
- Dégradation/désactivation des biocides avant rejet dans le milieu marin. C'est une alternative (étudiée[134]) ou un complément aux solutions précédentes.
- Vaccination ? Elle fait l'objet d'intenses recherche depuis quelques années, mais elle nécessite d'abord que des antigènes parasitaires pertinents soient identifiés, puis testés et insérés dans des vaccins. Et il est probable qu'un vaccin durablement efficace soit difficile trouver face à un parasite aussi complexe et génétiquement adapté au contexte de l'élevage[135]
Plusieurs molécules d'intérêt comme antigène possible ont récemment été repérée[51],[136].
- Leurres chimiques : des produits « sémiochimiques » pour leurrer le parasite (lui cacher la présence du saumon où l'attirer dans un piège. Des essais ont permis de réduire le taux d'infestation jusqu'à 40% ou 60%[137].
- Tests de résistance : des biopuces devraient bientôt permettre de plus rapidement tester la résistance des poux à différents pesticides et ainsi éviter des traitements inutiles, qui contribuent en outre à aggraver ou entretenir les phénomènes de résistance[138].
- Barrière physique : il a été constaté qu'une jupe permanente de type bâche en plastique entourant les 5 mètres supérieurs de la cage réduisait préventivement le niveau d'infestation des saumons par les poux (et le cas échéant limite la dilution trop rapide d'un médicament dans l'eau), mais cette solution génère de nouveaux inconvénients : la jupe alourdit la cage et la rend beaucoup plus « résistante au courant » avec donc des tensions supplémentaires sur les systèmes d'amarrage. La jupe limite aussi la circulation de l'eau dans la cage, avec donc une eau plus sale pour les saumons[139]. Un premier test en vraie grandeur a néanmoins été fait en mer du nord à Hirtshals (Danemark) en 2012 pour évaluer la faisabilité de cette solution potentielle[139]. Outre un risque de déformation ou détérioration des cages[140], plusieurs problèmes se posent dont une moindre luminosité dans la cage et une chute du taux d'oxygène dans l'eau[141],[142].
- Barrière électromagnétique : (Seafarm Pulse Guard ou SPG ou Elektropuls[143]) est un système breveté testé en 2011 en Norvège, et qui pourrait être loué à 10 à 20 fermes norvégiennes en 2013-2014 ; une « jupe » de fils électriques crée un champ d'impulsions électrique dans l'eau de mer autour des cages. Après 5 ans de recherche pour concevoir le câble sous-marin et le système, ses impulsions ont été ajustées en laboratoire puis testées en mer durant 5 mois de manière à « étourdir » le pou au stade copépodite. Ce dernier - selon l'inventeur du système - n'arrive alors plus à s'accrocher aux saumons. Les paramètres biochimiques suivis durant 5 mois pour mesurer d'éventuels effets sur la santé des saumons laissent penser qu'ils ne sont pas affectés par le champ électrique. La parasitose est réduite de 70 % dans les premiers tests mais l'entreprise pense pouvoir atteindre 95 %.
Notes et références[modifier | modifier le code]
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 20 octobre 2013
- C. Tröße, H. Kongshaug, L. A. Hamre and F. Nilsen (2012). Characterisation of iron regulatory protein 1 and 2 in the salmon louse (Lepeophtheirus salmonis Krøyer 1837). Exposé fait pour la 9e conférence internationale sur les poux des poissons , 21 au 23 mai 2012, à Bergen (Norvège), voir p. 22/74.
- Ove T. Skilbrei, Bengt Finstad, Harald Sægrov, Kurt Urdal, Gunnar Bakke, Frode Kroglund and Rita Strand (2012). Impact of early infestation with the sea louse (Lepeophtheirus salmonis) and variability in survival and marine growth of sea ranched Atlantic salmon (Salmo salar) smolts 1997 – 2009. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 35/74.
- P. Gargan (2012). Interaction of sea lice between farmed and wild salmonids; Potential for impact, lessons learnt and future prospects, a wild fish perspective. Exposé fait pour la 9e conférence internationale sur les poux des poissons , 21 au 23 mai 2012, à Bergen (Norvège), voir p. 35/74.
- Pål Arne Bjørn, Ingrid Askeland Johnsen, Rune Nilsen, Rosa Maria Serra Llinnares, Peter Andreas Heuch, Bengt Finstad, Karin Boxaspen & Lars Asplin (2012), The effects of fallowing zones on the distribution and risks of salmon lice infection in wild salmonids in an intensively farmed Norwegian fjord system. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 35-36/74.
- G. D. Marty, S. M. Saksida, T. J. Quinn (2010). Relationship of farm salmon, sea lice, and wild salmon populations. Dans Proceedings of the National Academy of Sciences ; DOI: 10.1073/pnas.1009573108, et synthèse Wild salmon decline was not caused by sea lice from farm salmon, new research suggests. Dans sciencedaily (2010).
- David Jackson, Deirdre Cotter, Pauline O’Donohoe, Sarah McEvoy, Frank Kane, Tom McDermott, Jonathan White, Suzanne Kelly & Alan Drumm (2012). Lepeophtheirus salmonis infestations of migrating Atlantic salmon smolts at eight locations in Ireland with an analysis of se a lice induced marine mortality. Exposé fait pour la 9e conférence internationale sur les poux des poissons , 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 21/74
- D. Jackson, F. Kane, P. O'Donohoe, T. McDermott, A. Drumm et S. Kelly (2012). Sea lice levels on Atlantic salmon returning to the West Coast of Ireland. Poster présenté à la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir rp 22/74.
- NCBI, consulté le 29 décembre 2018
- P. M. Hayes and G. A. Boxshall (2012), Introducing Sealice Explorer – a diagnostic e-taxonomy system for sealice ; 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p 59/74.
- William Pennell (océanographe, directeur (par intérim) de l'Institut pour la recherche côtière, Université Vancouver Island) ayant auparavant enseigné la salmoniculture durant 30 ans à Alert Bay et également à Nanaimo, à l'Université Vancouver Island., audité le 3 mai 2010 par le Comité permanent des pêches et des océans du Canada.
- M. Nuñez, S. Bravo et M. T. Silva (2012). Behaviour of Caligus rogercresseyi infecting Atlantic salmon (Salmo salar) in a farm located in a new fish farming location in Chile. Poster scientifique fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 29/74.
- J.W. Treasurer et S. Bravo (2010). The spatial distribution patterns of Caligus rogercresseyi and C. elongatus on Atlantic salmon hosts (Salmo salar). Dans Aquaculture, Vol. 320, no 3–4, 01 novembre 2011, Pp. 154–158. Sea Lice 2010, Proceedings of the 8th International Sea Lice Conference, Victoria, BC, Canada, 9-12 mai 2010 (résumé).
- T. Steinum, K. Sjåstad, K. Falk, A. Kvellestad, D.J. Colquhoun (2009). An RT PCR-DGGE survey of gill-associated bacteria in Norwegian seawater-reared Atlantic salmon suffering proliferative gill inflammation. Dans Aquaculture, Volume 293, Issues 3–4, 2009-08-16, Pages 172–179 (résumé).
- P. Valdes-Donoso, F.O. Mardones, M. Jarpa, M. Ulloa, T.E. Carpenter, A.M. Perez (2012). Co-infection patterns of two high-risk diseases affecting farmed Atlantic salmon in southern Chile (2007- 2009). Poster scientifique fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 29/74.
- B. A. Venmathi Maran, Seong Yong Moon, Sung-Yong Oh, and Jung-Goo Myoung (2012), Sebastes schlegelii Gusev, 1951 (Copepoda: Caligidae), a pest on the ranched Korean rockfish Sebastes schlegelii in Korea. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 21-22 sur 74.
- Pêches et Océans Canada (Gouvernement du Canada). Pou Du Poisson. Dans R et D en aquaculture au Canada de 2011, consulté le 31 octobre 2013.
- B.F. Nowak, C.J. Hayward, L. González, N.J. Bott, R.J.G. Lester (2011). Sea lice infections of salmonids farmed in Australia. Dans Aquaculture, Volume 320, Issues 3–4, 1 nov.2011, Pages 171-177 (résumé).
- Pêches et Océans Canada.Information sur le pou du poisson, page d'archive, 11 octobre 2005.
- « Écosse : les ravages sanitaires de l'élevage intensif des saumons • FRANCE 24 » (consulté le )
- L. Asplin, A. D. Sandvik, I. A. Johnsen, V. Sundfjord, J. Albretsen, P. A. Bjørn, K. Boxaspen et J. Aure (2012). Fluctuations in the physical climate of the Hardangerfjord and its influence on salmon lice distribution. Poster scientifique fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 28-29/74.
- G. Ritchie A.J. Mordue(Luntz), A.W. Pike et G.H. Rae (1996). Observations on mating and reproductive behaviour of Lepeophtheirus salmonis, Krøyer (Copepoda: Caligidae). Dans Journal of Experimental Marine Biology and Ecology, Volume 201, Issues 1–2, 1 septembre 1996, Pages 285–298 (résumé).
- Linda Jensen, Eivind Larsen, Kai Erik Uleberg, Daniela Pampanin, Fiona Provan (2012). The use of proteomics in sea lice research. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 31/74.
- S.M.C. Robinson, A. Bartsch, M. Luitkus, K. Pee Ang, D. Cleaves, T.A. Lander, C.M. Pearce et J.L. Webb (2012). Studying the early life-history of sea lice in the Bay of Fundy for the purpose of developing alternative strategies to reduce epidemic level infestations. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 49/74
- Alexandra Morton (2010), vidéo intitulée Sea Lice Investigation - what is government doing ?, consulté le 11 juin 2013.
- K.V. Vollset, B.T. Barlaup, U. Pulg, S-E. Gabrielsen (2012) Collection of pelagic stages of salmon lice in a Norwegian Archipelago. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 38/74.
- N.K.G. Salama, B. Rabe, A.G. Murray (2012), Modelling sea lice di spersal in a Scottish fjordic system. Poster scientifique présenté à la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 38-39/74.
- J. Pino, J.L. González Vecino, J. Gonzalez, J. Troncoso, J. Mordue, M. Burkett, A. Quiroz, S.L. Wadsworth (2012), The effect of masking compounds on the disruption and settlement of sea lice (Lepeophtheirus salmonis and Caligus rogercresseyi on Atlantic salmon (Salmo salar). Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 31-32/74.
- Heffernan M.L. (1999). A review of the ecological implications of mariculture and intertidal harvesting in Ireland. Dúchas. p. 18.
- Étude intitulée Suivi comportemental des grands salmonidés sur le bassin de l’Authie - Année 2013 ; Annexe D. PDF, 65 pages : Fiche d’identification des grands migrateurs, dans laquelle on décrit les poissons amphihalins capturés. Exemple : saumon atlantique de 3 ans ayant passé 2 hivers en mer, de 76,6 cm, capturé et observé le 28/05/2013, porteur « de nombreux poux de mer avec cicatrices »... la plupart des autres salmonidés observés dans le même piège durant cette même étude présentaient soit des poux de mer (de quelques-uns à beaucoup) et des cicatrices, soit des cicatrices seules
- MacKinnon BM (1993) Host response of Atlantic salmon (Salmo salar) to infection by sea lice (Caligus elongatus). Canadian Journal of Fisheries and Aquatic Sciences, 50(4), 789-792 (résumé)
- (résumé)
- Siemon H.S. Ng, Carlo G. Artieri, Ian E. Bosdet, Readman Chiu, Roy G. Danzmann, William S. Davidson, Moira M. Ferguson, Christopher D. Fjell, Bjorn Hoyheim, Steven J.M. Jones, Pieter J. de Jong, Ben F. Koop, Martin I. Krzywinski, Krzysztof Lubieniecki, Marco A. Marra, Leslie A. Mitchell, Carrie Mathewson, Kazutoyo Osoegawa, Sarah E. Parisotto, Ruth B. Phillips, et al.(2005) A physical map of the genome of Atlantic salmon, Salmo salar Original Research Article Genomics, Volume 86, Issue 4, October 2005, Pages 396-404
- Lars A. Hamre, Kevin A. Glover, Frank Nilsen (2009) Establishment and characterisation of salmon louse (Lepeophtheirus salmonis (Krøyer 1837) laboratory strains; Parasitology International, Volume 58, Issue 4, December 2009, Pages 451-460
- IMR (2012) The salmon louse genome has been sequenced, consulté 2013-10-06
- Institut norvégien de recherche marine
- Site internet de Marine Harvest et présentation du groupe
- Site internet du FHF (Fonds norvégien de recherche sur la mer) ; Fiskeri - og havbruksnæringens forskningsfond (FHF), en norvégien
- Li S, Ma Y, Jang S, Wu Y, Liu H, Cao Z, Li W. (2009) A HindIII BAC library construction of Mesobuthus martensii Karsch (Scorpiones:Buthidae): an important genetic resource for comparative genomics and phylogenetic analysis ; Genes Genet Syst. 2009 Dec;84(6):417-24 (résumé)
- J. S. Leong and B. F. Koop (2012). A Pacific sea lice reference genome. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 55-56/74.
- Amber M. Messmer, Eric B. Rondeau, Stuart G. Jantzen, Krzysztof P. Lubieniecki, William S. Davidson, Ben F. Koop (2011), Assessment of population structure in Pacific Lepeophtheirus salmonis (Krøyer) using single nucleotide polymorphism and microsatellite genetic markers . Dans Aquaculture, Volume 320, Issues 3–4, 1 November 2011, Pages 183-192.
- D. Minkley, B. Koop and J. Leong (2012), Composition and high abundance of transposable elements in Atlantic and Pacific Lepeophtheirus salmonis genomes. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p 56/74
- Étude financée par « Génome Colombie-Britannique » et conduite par Ben Koop (Université de Victoria) ; William Davidson (Université Simon Fraser) ; Simon Jones (Pêches et Océans Canada) et Grant Murray (de l’Université de l'île de Vancouver)
- S. Carmichael, A. Tildesley, J. Ireland, J. B. Taggart, P. Skuce, J. E. Bron and A. Sturm (2012). A study of gene expression in Atlantic Lepeophtheirus salmonis populations with differing susceptibilities to emamectin benzoate. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p 56/74.
- S. R. M. Jones, B. J. G. Sutherland and B. F. Koop (2012), Biological and transcriptional consequences of infection with Facilispora margolisi (Microsporidia: Crustaceacida) following vertical transmission among larval salmon lice Lepeophtheirus salmonis. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p 57/74.
- Études conduits dans le cadre du programme « Génome Colombie-Britannique » financé par le Ministère de l'Agriculture et des Terres de la Colombie-Britannique, Pêches et Océans Canada (MPO), conduites avec Grieg Seafood BC Ltd., Mainstream Canada, Marine Harvest Microtek Research and Development Ltd., l'Université de Victoria (UVic), Université de l'île de Vancouver (VIU), avec Ben Koop (UVic), Grant Murray (VIU), Simon Jones (MPO – SBP), William Davidson (SFU) (en savoir plus)
- Oceana, Exxon Valdez Oil Spill Facts, consulté le 03 novembre 2013.
- Farrell, Anthony -eter, Gold, Diane., tang, Steve., Ho, Carmen (2012). A review of scientific literature related to « can farmed and wild salmon coexist in British Columbia ? Parasitic sea lice and other diseases of Pacific Salmon ». The University of British Columbia, Vancouver, BC, décembre 2012, PDF, voir page 9/ 67 de la version PDF.
- Projet (mai 2010 –mars 2011) conduit par Evan Kearney (Admiral Fish Farms), Amber Garber (CSMH), Chris Bridger (AEG), Phil Dobson (AEG), Bill Hogans (CSMH), Jack Pendleton (Admiral Fish Farms), James Snider (inVentures Technologies), Craig Glassford (inVentures Technologies), Mike Beattie (MAPA), Kathy Brewer-Dalton (MAPA), Clarence Blanchard (Future Nets) Financement : MPO, Programme d'innovation en aquaculture et d'accès aux marchés (PIAAM), Fondation de l'innovation du Nouveau-Brunswick (FINB).
- Fred Page, Les Burridge, Jiselle Bakker, Bill Ernst, Randy Losier, Susan Haigh, Blythe Chang, Monica Lyons, David Wong (2012). Transport and Dispersal of Sea Lice ther apeutants used in salmon farms located in southwest New Brunswick, Canada. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 20/74.
- C. R. Wiik-Nielsen, C. Ridaura and S. Grove (2012), Phage display – a method for identification of immune inhibitory factors in salmon louse. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 33/74.
- Morton, A., Routledge, R., Peet, C. and Ladwig, A. (2005). Sea lice (Lepeophtheirus salmonis) infect ion rates on juvenile pink (Oncorhynchus gorbuscha) and chum (Oncorhynchus keta) salmon in the nearshore marine environment of British Columbia, Canada. Dans Can. J. Fish. Aquat. Sci., 61: 147-157.
- B Joshua Rapp Learn (2018) Why are these salmon jumping ?, News publiée le 13 juillet 2018
- Sackville, M., Tang, S., Nendick, L., Farrell, A.P. and Brauner, C.J. (2011). Pink salmon (Oncorhynchus gorbuscha) osmoregulatory development plays a key role in sea louse (Lepeophtheirus salmonis) tolerance. Dans Can. J. Fish . Aquat. Sci., 68: 1087-1096.
- Farrell & al. (2012). A review of scientific literature related to « can farmed and wild salmon coexist in British Columbia? Parasitic sea lice and other diseases of Pacific Salmon ». The University of British Columbia, Vancouver, BC ; décembre 2012, PDF, 67 p.
- Jay Abolofia, Frank Asche, Atle Guttormsen (2012). The Economics of Salmon Lice: Putting a Price on Lice. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 20/74.
- Morton, A.B. and Williams, R. (2003). First report of a sea louse, Lepeophtheirus salmonis, infestation on juvenile pink salmon, Oncorhynchus gorbuscha, in nearshore habitat. Dans Can. Field. Nat., 1 17: 634-641.
- Connors, B.M., Krkosek, M., Ford, J., and Dill, L.M. (2010). Coho salmon productivity in relation to salmon lice from infected prey and salmon farms. Dans J. Appl. Ecol., 47:1372-1377.
- Price, M.H.H., Morton, A. and Reynolds, J.D. (2010). Evidence of farm - induced parasite infestations on wild juveni le salmon in multiple regions of coastal British Columbia, Canada. Dans Can. J. Fish. Aquat. Sci., 67: 1925-1932.
- Marty G.D., Saksida, S.M. and Quinn, T.J. (2010). Relationship of farm salmon, sea lice, and wild salmon populations. Dans Proc. Natl. Acad. Sci., 107: 22599-22604.
- Mackas, D. and Galbraith, M. (2008). Abundance of planktonic sea lice in Knight Inlet/Trib une Channel - Project A.5. BC Pacific Salmon Forum Summary of 2008 Interim Research Findings pgs. 33-37. Synopsis : « Mackas and Galbraith (2008) used plankton tows in the Broughton Archipelago in spring of 2007 and 2008 to estimate densities of planktonic sea lice larvae in areas around active farms. Mean density of sea lice nauplii and copepodids were averaged 0.01 - 0.03 lice/m3 and ranging from 0 – 0.4 lice/m3 . Thus, extensive plankton tows around active salmon farms revealed a very low density of infective larval sea lice, which declined with distance (2 - 30 km) from the farms. »
- Saksida, S.M., Greba, L., Morrison, D. and Revie, C.W. (2010). Sea lice on wild juvenile Pacific salmon and farmed Atlantic salmon in the northernmost salmon farming region of British Columbia. Dans Aquaculture, 320: 193-198.
- Mackas, D. and Galbraith, M. (2008). Abundance of planktonic sea lice in Knight Inlet/Trib une Channel - Project A.5. BC Pacific Salmon Forum Summary of 2008, Interim Research Findings, pp. 33-37.
- Morton, A., Routledge, R., McConnell, A. and Krkosek, M. (2011). Sea lice dispersion and salmon survival in relation to salmon farm activity in the Broughton Archipelago. ICES, dans J. Marine Sci., 68: 144–156.
- Frazer, N. (2009). Sea - Cage Aquaculture, Sea Lice, and Declines of Wild Fish. Dans Conservation Biol., 23: 599-607.
- Krkosek, M., Lewis, M.A., Morton, A., Frazer, L.N. and Volpe, J.P. (2006). Epizootics of wild fish induced by farm fish. Dans Proc. Nat. Acad. Sci., USA. 103: 15506-15510.
- Krkosek, M., Morton, A., Volpe, J.P. et Lewis, M.A. (2009). Sea lice and salmon population dynamics: effects of exposure time for migratory fish. Dans Proc. R. Soc. B., 276: 2819-2828.
- Krkosek, M., Ford, J.S., Morton, A., Lele, S., Mye rs, R.A. and Lewis, M.A. (2007). Declining wild salmon populations in relation to parasites from farm salmon. Dans Science, 318: 1772-1775.
- Brooks, K.M. and Jones, S.R.M. (2008). Perspectives on Pink Salmon and Sea Lice: Scientific evidence fails to support the extinction hypothesis. Dans Rev. Aquat. Sci., 16: 403-412.
- Riddell, B.E., Beamish, R.J., Richards, L.J. and Candy, J.R. (2008). Comment on declining wild salmon populations in relation to parasites from farm salmon. Dans Science, 322: 1790b.
- Krkosek, M ., Ford, J. S., Morton, A., Lele, S. and Lewis, M. A. (2008). Response to comment on declining wild salmon populations in relation to parasites from farm salmon. Dans Science, 322: 5909.
- Marty G.D., Saksida, S.M. and Quinn, T.J. (2010). Relationship of farm salmon, sea lice, and wild salmon populations. Dans Proc. Nat. Acad. Sci., 107: 22599-22604.
- Krkosek, et al. (2011). Effects of parasites from salmon farms on productivity of wild salmon. Dans Proc. Natl. Acad. Sci. 108: 14700-14704.
- Krkosek, M. and Hilborn, R. (2011). Sea lice (Lepeophtheirus salmonis) infestations and the productivity of pink salmon (Oncorhynchus gorbuscha) in the Broughton Archipelago, British Columbia, Canada. Dans Can. J. Fisheries Aquat. Sci., 68: 17-29.
- Saksida, S.M., Morrison, D. et Revie, C.W. (2010). The efficacy of emamectin benzoate against infestations of sea lice, Lepeophtheirus salmonis, on farmed Atlantic salmon, Salmo salar L., in British Columbia. Dans J. Fish. Dis., 33: 913 - 917.
- P. T. Noack, L. M. Laird et I. G. Priede (1997). Carotenoids of sea lice (Lepeophtheirus salmonis) as potential indicators of host Atlantic salmon (Salmo salar L.) origin. Dans ICES J. Mar. Sci., 54 (6): 1140-1143. doi:10.1016/S1054-3139(97)80019-7, courte communication (résumé).
- M. Foreman, D. Stucchi, M. Guo, P. Chandler, B. Kelly, S. Murphy (2012). Modelling inter-annual and intra-seasonal water property variations and their impact on sea lice in the Broughton Archipelago, Canada. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 39/74.
- T. Adams (2012). Connectivity and population modelling of sea lice in a Scottish sea loch. Poster scientifique présenté à la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 38/74.
- SINMOD ; exemples animés 2D : exemple 1 : évolution de la salinité, et exemple 2 : évolution de la température de surface).
- janvier 2009 – décembre 2009 Financement : MPO Programme coopératif de recherche et développement en aquaculture (PCRDA).
- Marit Stormoen, Brad Schofield (2012). Salmon Lice Population Dynamics Modeling with Applications to Treatment Strategies. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 58/74.
- I.P. Helland, P. A. Bjørn, O. Diserud, B. Finstad, F. Hansen, P. A. Jansen, R. Nilsen, I. Uglem (2012). Modelling sea lice on wild sea trout; effects of environmental variations and density of farmed fish. Exposé fait pour la 9e conférence internationale sur les poux des poissons , 21 au 23 mai 2012, à Bergen (Norvège), voir p. 38/74.
- Øyvind Knutsen, Ingrid Ellingsen, Lionel Eisenhauer and Hans Bjelland. Modelling dispersion of sea lice (Lepeophtheirus salmonis) in Romsdalsfjorden –implications for wild and farmed salmon. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 36-37/74.
- L. Asplin, H. A. Svedberg, P. A. Bjørn, R. Nilsen, R. M. S. Llinares, A. D. Sandvik and M. Myksvoll (2012). Validation of a salmon lice dispersion model in a northern Norwegian fjord. Poster scientifique fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 29/74.
- C.C. Pert et S. Middlemas (2012). Identifying variations in the infection pressure from parasitic sea lice in a Scottish sea loch containing salmonid aquaculture. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 36/74.
- Connors, B. M., Hargreaves, N. B., Jones, S. R. M., and Dill, L. M. (2010). Predation intensifies parasite exposure in a salmonid food chain. Dans J. Appl. Ecol., 47: 1365-1371.
- N.K.G. Salama, B. Rabe, A.G. Murray (2012). Modelling sea lice dispersal in a Scottish fjordic system. Poster scientifique fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 38-39/74.
- Ashander, J., Krkosek, M. and Lewis, M.A. (2012). Aquaculture - induced changes to dynamics of a migratory host and specialist parasite: a case study of pink salmon and sea lice. Dans Theor. Ecol. 5: 231–252.
- Simon Jones (2012). Global approaches to understanding diverse mechanisms of resistance to Lepeophtheirus salmonis among salmon species. Contribution à la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 30/74.
- M.D. Fast, S.E. Friend, S. L. Purcell, J.F. Burka, R.J.F. Markham, A. Donkin, D.B. Groman, J. M. Covello (2012). CPG ODN inclusion in feed induces transient inflammatory responses towards Lepeophethrius salmonis and greater protection in Atlantic salmon (Salmo salar) following infection and re-infection. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 29/74.
- M.D. Fast, J. Poley, O.O. Igboeli, A. Donkin, D.B. Groman, H. Wotton, S. L. Purcell (2012). Combinatorial effects of administration of immunostimultory compounds in feed prior to triple dose Slice® (emamectin benzoate) on Atlantic salmon (Salmo salar) infection with Lepeophtheirus salmonis.
- Travaux (février 2007 – mars 2011) conduits par A. P. Farrell (UBC), C. J. Brauner (UBC), L. Nendick (UBC), S. Tang (UBC), M. Sackville (UBC), A. M. Grant (UBC), M. Gardner (UBC), L. M. Hanson (UBC), A. G. Lewis (UBC), C. DiBacco (UBC). Avec l’aide du Forum du saumon du Pacifique de la Colombie-Britannique. (FSP), Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) (en savoir plus).
- Jones, S., Kim, E. and Bennett, W. (2008). Early development of resistance to the salmon louse, Lepeophtheirus salmonis (Kroyer), in juvenile pink salmon, Oncorhynchus gorbuscha (Walbaum). Dans J. Fish. Dis., 31: 591–600.
- Pêches et Océans Canada (Gouvernement du Canada) Pou Du Poisson ; R et D en aquaculture au Canada de 2011, consulté le 31 octobre 2013.
- Mages, P.A. and Dill, L.M. (2010). The effect of sea lice (Lepeophtheirus salmonis) on juvenile pink salmon (Oncorhynchus gorbuscha) swimming endurance. Dans Can. J. Fisheries Aquat. Sci., 67: 2045-2051.
- Webster, S.J., Dill, L.M. and Butter worth, K. (2007). The effect of sea lice infestation on the salinity preference and energetic expenditure of juvenile pink salmon (Oncorhynchus gorbuscha). Dans Can. J. Fisheries Aquat. Sci. 64: 672-680.
- Projet de recherche (février 2007 – mars 2011) conduit par S. Tang (UBC), A. G. Lewis (UBC), M. Sackville (UBC), L. Nendick (UBC), C. DiBacco (UBC), A. P. Farrell (UBC), C. J. Brauner, financés par le « Forum du saumon du Pacifique de la C.-B. » (FSP) et le « Conseil de recherches en sciences naturelles et en génie du Canada » (CRSNG) (en savoir plus).
- Randi Nygaard Grøntvedt, Bjørn Bjøru, Frode Finne-Fridell, Rune Stigum Olsen, Pundharika Barkved, Vidar Moen and Solveig Gåsø (2012). Delousing in well boats – distribution studies with tracers and pyrethroids 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 48/74.
- MPO (2013). Lignes directrices visant à définir l’exposition potentielle et les effets biologiques connexes issus des traitements des parasites et des agents pathogènes en aquaculture : bains contre le pou du poisson dans la baie de Fundy (Nouveau-Brunswick). Secr. can. de consult. sci. du MPO, Avis sci. 2012/070.
- MPO Programme de recherche sur la réglementation de l'aquaculture (PRRA), Ministère de l'Environnement de la Colombie-Britannique (MOE C.-B.), Environnement Canada (EC), Fédération du Saumon du Pacifique, Université de Victoria (UVic), étude (avril 2009 – mars 2011) conduite par Michael G. Ikonomou (MPO – ISM), Caren Helbing (U Vic), Nik Veldhoen (U Vic), Cory Dubetz (MPO – ISM), Jon Chamberlain (Ministère de l'Agriculture et des Terres de la C.-B.), Graham van Aggelen (EC), Craig Buday (EC) (en savoir plus).
- ScienceDaily (2012). Saving salmon from deadly sea lice, d'après l'Université d'Alberta (2012-11-15), consulté le 03 novembre 2013.
- DFO (2012). Évaluation du devenir du Benzoate d'émamectine, l'ingrédient actif du Slice, près des installations d'aquaculture en Colombie-Britannique et de ses effets sur la crevette tachetée du Pacifique (Pandalus platyceros). Secrétariat canadien de consultation scientifique - Avis scientifique 2011/082. Voir aussi MPO Pêches et Océans Canada.
- New Approach to Combating Sea Lice: Wrasse to the Rescue, 2010-04-23, consulté le 03 novembre 2013.
- SINTEF (28 septembre 2010). Wrasse to fight salmon lice. Dans ScienceDaily, consulté le 03 novembre 2013.
- Maya L. Groner, Ruth Cox, George Gettinby et W. Crawford (2012). Individual-based models : A new approach to understanding the biological control of sea lice (Review). Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 26/74.
- Bron, J. E., Treasurer, J.W. (1992). Sea lice (Caligidae) on wrasse (Labridae) from selected British wild and salmon-farm sources. Dans J. Mar. Biol. Assoc. UK, 72, 645-650 (résumé)
- Laidler, L. A., Grant, A. N., & Cox, D. I. (1999). Atypical Aeromonas salmonicida infection in wrasse (Labridae) used as cleaner fish of farmed Atlantic salmon, Salmo salar L., in Scotland. Dans Journal of fish diseases, 22(3), 209-213.
- J.L. Webb, J. Vandenbor, B. Pirie, S.F. Cross, S.R.M. Jones, S.M.C. Robinson, C.M. Pearce (2012). Effects of temperature, diet, and bivalve size on the ingestion of Lepeophtheirus salmonis larvae by filter-feeding shellfish. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 42/74.
- Diane Morrison (Fish Health and Food Safety Director) (2012). Marine Harvest Salmon Farm Biosecurity, 06 septembre 2012.
- Denholme, Ian., (2012) : Evolution in the fast lane: recent research on pesticide resistance in arthropod pests. Exposé introductif fait par Ian Denholm à la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir ref 32 p. 19/74.
- Pièces A conviction, France3, 28 juin 2010.
- Daniel F. Jimenez, Peter A. Heuch, Crawford W. Revie et George Gettinby (2012). Confidence in assessing the effectiveness of bath treatments for the control of sea lice on Norwegian salmon farms. Dans Aquaculture, Volumes 344–349, 2012-05-21, pp. 58–65 (résumé).
- Peter A. Heuch, George Gettinby, Crawford W. Revie (2010). Counting sea lice on Atlantic salmon farms — Empirical and theoretical observations. Sea Lice 2010, Proceedings of the 8th International Sea Lice Conference, Victoria, BC, Canada, 9-12 mai 2010 ; Dans Aquaculture, Vol. 320, no 3–4, 2011-11-01, p. 149–153 (résumé).
- A. Elmoslemany, S. K. Whyte, K. L. Hammell, and C. W. Revie (2012). Sea lice counts on Atlantic salmon farms : Comparing audit and farm staff counts. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 49/74.
- Marty G.D., Saksida, S.M. et Quinn, T.J. (2010). Relationship of farm salmon, sea lice, and wild salmon populations. Dans Proc. Nat. Acad. Sci. 107(52): 22599 - 22604.
- Sonja Saksida, Diane Morrison, Peter McKenzie, Barry Milligan, Elan Downey, Brad Boyce and Alexandra Eaves (2012). Evaluation of SLICE® efficacy on farmed Atlantic Salmon (Salmo salar)in British Columbia. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 41-42/74.
- Trond Ove R. Hjelmervik, Per Gunnar Espedal, Heidi Kongshaug, Ketil Malde, Tor Einar Horsberg, Frank Nilsen (2012). Gene expression differences in emamec tin benzoate resistant and sensitive salmon lice identified by use of microarray and QPCR. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 41/74.
- S. Carmichael, A. Tildesley, J. Ireland, J. B. Taggart, P. Skuce, J. E. Bron et A. Sturm (2012). A study of gene expression in Atlantic Lepeophtheirus salmonis populations with differing susceptibilities to emamectin benzoate. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir ref 32 p. 18/74.
- Archives Web de Pêches et Océans Canada : Étude du devenir des granulés pour poisson sur le plancher océanique.
- F. Oppedal, P. Klebert, E. Høy, R. E. Olsen, L. H. Stien et O. Folkedal (2012). Topical delousing in seacages – salmon behaviour, water movements and therapeutant mixing. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 50/74.
- Étude (avril 2010–mars 2011) conduite par Les Burridge (MPO), Monica Lyons (MPO), David Wong (MPO), Ken MacKeigan (MPO), Susan Waddy (MPO), Vicky Merritt-Carr (MPO), financé par le programme canadien de recherche sur la réglementation de l'aquaculture (PRRA) (en savoir plus)
- O. Samuelsen, A-L Agnalt, B.T. Lunestad, T. Tjensvoll, B. Holmelid, E. Grefsrud et E. Farestveit (2012). The effect of the antiparasitic drug teflubenzuron on non-target species. 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 23/74.
- M. Beattie, A. Bartsch, S.M.C. Robinson, F. Page (2012). Efficacy and viability of sea lice post treatment with hydrogen peroxide and filtered from well boat dischargen. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 23-24 sur 74 du PDF.
- Myron Roth, Randolph H. Richards, Christina Sommerville and Gordon Rae (2012). Toxicity and sub-lethal effe cts of chemotherapeutants to chalimus stages of the salmon louse, Lepeophtheirus salmonis. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 38/74.
- P.G. Jones, K.L. Hammell, G. Gettinby, C.W. Revie (2012). Resistance development against emamectin benzoate in different life stages of sea lice (Lepeophtheirus salmonis) on farmed Atlantic salmon (Salmo salar). Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 40-41/74.
- Pêches et Océans Canada (Gouvernement du Canada) Pou Du Poisson. Dans R et D en aquaculture au Canada de 2011, consulté le 31 octobre 2013. Voir le paragraphe intitulé « Effets des bassins de peroxyde d'hydrogène sur l'épithélium de la peau du saumon ».
- Tor Einar Horsberg (2012). Salmon lice: treatment and resistance. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 40/74.
- Marine Harvest (2009). Article intitulé : Sea Floor monitoring always a priority, 17 juillet 2009, consulté le 02 novembre 2013.
- Andrea M. Weise, Chris J. Cromey, Myriam D. Callier, Philippe Archambault, Jon Chamberlain, Christopher W. McKindsey (2009). Shellfish-DEPOMOD: Modelling the biodeposition from suspended shellfish aquaculture and assessing benthic effects. Dans Aquaculture, Volume 288, Issues 3–4, 20 March 2009, Pages 239–253 (résumé).
- Pêche et océan Canada (2007) rchived – DEPOMOD parameter setting and validation for finfish farms in BC (archives gouvernementale/internet).
- MPO Programme de recherche sur la réglementation de l'aquaculture (PRRA), novembre 2008 – mars 2012 ; Ministère de l'Environnement de la Colombie-Britannique (MOE C.-B.), Forum du saumon du Pacifique de la C.-B. (FSP), Association des pêcheurs de crevettes du Pacifique (PPFA), coordination : Michael Ikonomou (MPO – ISM), Jon Chamberlain (Ministère de l'agriculture et des terres de la C.-B. ), Eric McGreer (MOE C.-B.), Cory Dubetz (MPO – ISM), Chris Sporer (PPFA) (Aquaculture renouvelable au Canada)
- Erik Høy, Frode Oppedal, Pascal Klebert, Per Rundtop, Ole Folkedal (2012). Mixing of delousing agent in sea cages closed by tarpaulin. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 47/74.
- R. Stigum Olsen and J. G. McHenery (2012). Betamax stewardship – The science of best practice. Poster scientifique, 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 48-49/74.
- Par Mike Beattie (MAPA), Bruce Thorpe (MAPA), Kathy Brewer-Dalton (MAPA), Jiselle Bakker (MPO), Research and Productivity Council (CRP), CSMH, avec des travaux de recherche conduits en décembre 2010–mars 2011 et financés par le Ministère de l'Agriculture, de l'Aquaculture et des Pêches du Nouveau-Brunswick, Cooke Aquaculture Inc., Admiral Fish Farms, Northern Harvest Sea Farms et le Fonds de développement total du Nouveau-Brunswick.
- Frank Nilsen (2012). Emerging issues Novel experimental approaches to facilitate development of new control measure towards sea lice. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 58/74.
- M. Patricio, S. Rodrigo, M. Carlos, B.Catalina and T. Jaim. IMR Institute of Marine Research (2012). A new copepod-specific trypsin mutant as an antigen candidate for a vaccine against sea lice. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir p. 18/74 du PDF.
- L.C. Hastie, C. Wallace, M.A. Birkett, O. Jones, A.J. Mordue, G. Ritchie, J.A. Pickett, J.L. Webster and A.S. Bowman (2012). Effectiveness of a semiochemical for sea lice control: Results from small-scale trials. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 43-44/74.
- Kari Olli Helgesen, Tor E. Horsberg (2012). Single dose field bioassay for resistance testing in sea lice (Lepeophtheirussalmonis): Development of a rapid diagnostic tool. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 46/74.
- A. M. Lien, Z. Volent, E. Lien and L. M. Sunde (2012). Shielding skirt for prevention of sea lice infestation on salmon in cages - experimental study on mooring loads and net deformation. Exposé fait pour la 9e conférence internationale sur les poux des poissons, 21 au 23 mai 2012, à Bergen (Norvège), voir résumé p. 50-51/74.
- Bruk av « luseskjørt » for å redusere påslag av lakselus Lepeophtheirus salmonis (Krøyer) på oppdrettslaks, report, Vesterålen fiskehelsetjeneste. Lien, A. M., Volent, Z. (2012). Report: Deformasjon av not og Permaskjørt og krefter på fortøyning, SINTEF Fiskeri og Havbruk AS, (ISBN 978-82-14-05445-3) (en norvégien).
- Stien, L. H., Nilsson, J., Oppedal, F., Kristiansen, T. S., Lien, A. M., Folkedal, O. (2012). Skirt around a salmon sea cage to reduce infestation of salmon lice resulted in low oxygen levels. Dans Aquacultural Engineering, (51), 21-25, 2012.
- L.C. Gansel & al (2013). Effects of a shielding skirt for prevention of sea lice on the flow past stocked salmon fish cages. Dans Aquaculture Europe 13, EAS.
- Elektropuls mot lakselus, Virkemidler for regional FoU og innovasjon (VRI) ; VRI Rogaland, consulté le 11 juin 2013.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Références taxinomiques[modifier | modifier le code]
- (en) Référence Animal Diversity Web : Lepeophtheirus salmonis (consulté le )
- (en) Référence Fauna Europaea : Lepeophtheirus salmonis (Krøyer, 1838) (consulté le )
- (fr + en) Référence ITIS : Lepeophtheirus salmonis (Krøyer, 1837) (consulté le )
- (fr) Référence SeaLifeBase : (consulté le )
- (en) Référence WoRMS : espèce Lepeophtheirus salmonis (Krøyer, 1837) (consulté le )
Liens externes[modifier | modifier le code]
- (en) Les 9 différents stades de développement du parasite (par l'Université de Prince Edward)
- clé de détermination de nombreuses espèces de poux de mer, intitulé "Sea lice explorer" (avec illustrations en CC-BY-SA 3.0 (sauf mention contraire)
Bibliographie[modifier | modifier le code]
- (en) Jones S.R.M. and Hargreaves N.B. (2009). Infection threshold to estimate Lepeophtheirus salmonis - associated mortality among juvenile pink salmon. Dans Dis. Aquat. Org. 84: 131–137
- (en) Morton, A., Routledge, R., McConnell, A. and Krkosek, M. (2011). Sea lice dispersion and salmon survival in relation to salmon farm activity in the Broughton Archipelago. Dans ICES J. Marine Sci., 68: 144-156
- (en) Nendick, L., Sackville, M., Tang, S., Brauner, C.J. and Farrell, A.P. (2010). Sea lice infection of juvenile pink salmon (Oncorhynchus gorbuscha) : effects on swimming performance and post-exercise ion balance. Dans Can. J. Fish. Aquat. Sci. 68: 241-249
- (en) Krkosek, M., Ford, J.S., Morton, A., Lele, S., Mye rs, R.A. and Lewis, M.A. (2007). Declining wild salmon populations in relation to parasites from farm salmon. Dans Science 318: 1772-1775
- (en) IMR Institute of Marine Research (2012). 9e conférence internationale sur les poux des poissons, accueillie par “Institute of Marine Research”, “Norwegian Food Safety Authority” et le “Norwegian Seafood Research Fund” – FHF, 21 au , à Bergen (Norvège), PDF, 74 pages
- (en) Ben J.G. Sutherland, Stuart G. Jantzen, Dan S. Sanderson, Ben F. Koop, Simon R.M. Jones (2012). Differentiating size-dependent responses of juvenile pink salmon (Oncorhynchus gorbuscha) to sea lice (Lepeophtheirus salmonis) infections. Dans Comparative Biochemistry and Physiology, Part D: Genomics and Proteomics, Volume 6, Issue 2, June 2011, pp. 213-223 (résumé)
- (en) Bjarne Gjerde, Jørgen Ødegård et Ingunn Thorland (2011). Estimates of genetic variation in the susceptibility of Atlantic salmon (Salmo salar) to the salmon louse Lepeophtheirus salmonis. Dans Aquaculture, Volume 314, Issues 1–4, , pp. 66–72 (résumé)


