HPG80
hPG80 désigne la version extracellulaire et oncogénique de la progastrine. Ce nom apparaît pour la première fois en janvier 2020 dans une publication scientifique[1]. Jusqu’à cette date, les publications scientifiques font référence à la seule désignation de “progastrine”, sans nécessairement préciser explicitement s’il est question de progastrine intracellulaire (dans le cadre de la digestion) ou extracellulaire (circulante et détectable dans le plasma) dans le cadre pathologique tumoral.
Pour plus de clarté, la suite de cet article utilise exclusivement le nom hPG80 pour désigner la progastrine extracellulaire.
Le lien entre cette protéine et le cancer est connu depuis plus de 30 ans. hPG80 est impliquée dans la plupart des fonctions biologiques assurant l’existence de la tumeur[2]. Le peptide est sécrétée par les cellules tumorales et se retrouve dans le plasma de patients atteints d’un cancer dès les stades précoces[1]. Il possède alors des fonctions indépendantes de la digestion et totalement différentes de la progastrine et de son seul rôle de précurseur intracellulaire de la gastrine.
Terminologie[modifier | modifier le code]
Dans le nom hPG80, le "h" décrit l'espèce humaine : human ; "PG" est une écriture commune pour la protéine progastrine et le nombre 80 correspond à la taille de la protéine: 80 acides aminés.
Le nom hPG80 a donc été introduit dans la publication issue des travaux du Professeur Benoît You, Dominique Joubert et Alexandre Prieur afin de lever les ambiguïtés entre la version intracellulaire de la protéine (dans la fonction de la digestion) et sa version extracellulaire de la protéine (cas des patients cancéreux) qui n'est plus, malgré son nom, le précurseur de la gastrine[1].
De plus, l’existence d’un peptide phonétiquement identique, le Pro-Gastrin Releasing Peptide (proGRP), accentuait les confusions possibles autour du nom progastrine et le besoin d’un nom spécifique. Il est à noter qu’à ce jour, plus de la moitié des résultats découlant de la recherche du mot progastrine sur les moteurs de recherche concernent la proGRP et non la molécule de 80 acides aminés à laquelle font référence les noms progastrine et hPG80.
Chronologie des découvertes scientifiques sur hPG80[modifier | modifier le code]

Historique[modifier | modifier le code]
- 1996 – 1997 : hPG80 est identifiée comme étant nécessaire pour la prolifération et la tumorigenèse des cellules cancéreuses du côlon[6].
- 2000 – 2001 : Le gène GAST est une cible de la voie ß-caténine/Tcf4[7]. La présence de hPG80 est mise en évidence dans le plasma de patients atteints de cancer colorectal[8].
- 2003 : hPG80 est impliquée dans la régulation de la dissociation des jonctions adhérentes et serrées[2]. Src est le médiateur des effets de hPG80 sur la croissance cellulaire[9].
- 2005 : Les voies Ras et ß-caténine/Tcf4 induisent une activation synergique du gène GAST en contribuant à une éventuelle progression néoplasique[10].
- 2007 : L’inhibition de l’expression de hPG80 inhibe la voie Wnt/ß-caténine induisant une diminution de la croissance et une différenciation tumorale dans des modèles de tumeurs intestinales[11].
- 2012 : La mutation du gène p53 augmente la prolifération colique hPG80-dépendante et la formation du cancer[12].
- 2014 : hPG80 est identifiée comme nouveau facteur pro-angiogénique[13].
- 2016 : La sécrétion autocrine de hPG80 favorise la survie et l'auto-renouvellement des cellules souches dans le cancer du côlon[14].
- 2017 : L’utilisation d’anticorps dirigés contre hPG80 pour cibler la voie Wnt et les cellules souches cancéreuses représente une nouvelle piste thérapeutique du cancer[15].
- 2020 : hPG80 est detéctée dans le plasma de patients atteints de 11 différents types de cancers. Démonstration d’une association entre les variations longitudinales des taux de hPG80 et l'efficacité des traitements anticancéreux[1].
Rôle dans le cancer[modifier | modifier le code]
Par le biais de divers mécanismes qui sont tous cruciaux pour la croissance et la survie des tumeurs, les recherches ont démontré le rôle majeur exercé par hPG80 sur l’initiation et la progression tumorale en prenant généralement le cancer colorectal comme modèle. Bardram a été le premier à émettre l’hypothèse de la présence de hPG80 dans les stades précoces de la maladie[3]. Il a évalué la présence de hPG80 et de ses produits de maturation dans le sérum de patients atteints du syndrome de Zollinger-Ellison. Ces travaux ont montré que la mesure du taux de hPG80 reflétait de manière plus fidèle la production tumorale de gastrine que la mesure conventionnelle de la gastrine amidée. En effet, hPG80 est plus de 700 fois plus abondante que la gastrine amidée dans les tumeurs colorectales[16].
Dans le début des années 1990, il a été démontré que hPG80 n’était pas complètement maturée dans des lignées cellulaires humaines de cancer du côlon et, plus important encore, qu’elle était secrétée par ces cellules cultivées in vitro[5]. Ces observations ont mené à étudier la fonction autocrine et paracrine de hPG80 dans les cellules tumorales[17]. De manière générale, il a été démontré que hPG80 ne mature pas correctement dans les cellules cancéreuses, et tout particulièrement dans le cancer colorectal, car les enzymes de maturation sont soit absentes, soit non fonctionnelles[4],[5],[18],[19],[20],[16],[21].
Dès 1996, il a été démontré que l’expression du gène GAST est requise pour la tumorigenèse cellulaire du cancer du côlon humain[6]. 60 à 80% des cancers du côlon expriment le gène GAST.
À travers des configurations expérimentales différentes, l’altération du gène GAST ou la neutralisation de hPG80 entrainait chez des souris présentant une prédisposition tumorale (mutation sur le gène APC) une diminution du nombre de tumeurs. Inversement, il a été observé une augmentation significative de la formation tumorale chez des souris surexprimant la progastrine et traitées avec de l’azoxyméthane (AOM), un carcinogène chimique[7],[11],[15],[22],[23].
Facteur pro-angiogénique[modifier | modifier le code]
Lors du développement d’une tumeur, son besoin en oxygène et en nutriments provoque la création de nouveaux vaisseaux sanguins. Ce processus est appelé néo-angiogenèse. En 2015, hPG80 s’est avérée être un facteur pro-angiogénique[13]. hPG80 stimule la prolifération et la migration des cellules endothéliales et accroit leur capacité à former in vitro des structures similaires à des capillaires. Le blocage de la production de hPG80 (par shRNA) dans des cellules xénogreffées chez des souris nude, réduit la néovascularisation tumorale.
Facteur anti-apoptotique[modifier | modifier le code]
Le traitement de cellules épithéliales intestinales par hPG80 entraine une perte significative de l’activation des caspases 9 et 3, ainsi qu’une diminution de la fragmentation de l’ADN. Par conséquent, l’effet de hPG80 sur la survie cellulaire résulte à la fois d’une augmentation de la prolifération et d’une diminution de l’apoptose[24].
Régulation des jonctions cellulaires[modifier | modifier le code]
La migration des cellules repose sur leur capacité à devenir indépendante des cellules adjacentes. L'intégrité des contacts intercellulaires est essentielle pour la régulation de l'absorption des électrolytes ainsi que pour la prévention des métastases tumorales. En 2003, il a été démontré que le blocage de la sécrétion de hPG80 par une construction antisens dirigé contre l’ARNm de la progastrine permet le rétablissement de la localisation membranaire des protéines des jonctions constitutives des jonctions adhérentes et serrées dans une lignée cellulaire de carcinome colorectal humain DLD-1[2]. hPG80 joue donc un rôle sur l’intégrité des contacts cellulaires.
Rôle dans les cellules souches cancéreuses[modifier | modifier le code]
Les cellules souches cancéreuses (CSCs) représentent une faible proportion, comprise généralement entre 1 et 5%, de la tumeur. Mais elles sont essentielles à la survie de la tumeur car elles jouent le rôle de « réacteur ». Giraud et al. ont démontré le rôle majeur joué par hPG80 dans les CSCs. Ces auteurs ont montré que l’expression de hPG80 est fortement accrue dans des cellules cancéreuses colorectales cultivées dans des conditions où les CSCs sont enrichies[14]. Ils ont ensuite montré que hPG80 était capable de réguler la fréquence des CSCs (survie et auto-renouvellement) in vitro et in vivo. Par la suite, Prieur et al. ont démontré que lorqu’un anticorps neutralisant est ajouté à une culture cellulaire ou lorsque des souris greffées avec des cellules cancéreuses colorectales humaines sont traitées in vivo avec un tel anticorps, la fréquence des CSCs est diminuée dans les mêmes proportions[15]. Ces deux articles scientifiques montrent clairement que hPG80 est un facteur de survie des CSCs. De plus, l’inhibition de hPG80 induirait la différenciation des CSCs, ouvrant la possibilité d’une thérapie de différenciation plutôt qu’une thérapie anti-proliférative classique. Elle a pour principale fonction d’aider les CSCs à survivre et à se propager pour former des métastases, ce qui explique probablement pourquoi ce peptide peut être considéré comme un marqueur prédictif potentiel de la présence de métastase hépatique dans le cancer colorectal[25].
Le lien entre hPG80 et les voies de signalisation oncogéniques[modifier | modifier le code]
Wnt et K-Ras[modifier | modifier le code]
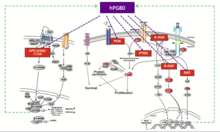
Le premier évènement conduisant au cancer du côlon est dans 80 à 90% des cas l’activation constitutive de la voie oncogénique Wnt/ß-caténine induite par les mutations du gène codant APC (Adenomatous polyposis coli) ou du gène codant la ß-caténine. L’introduction de ces mutations dans des cellules souches normales de l’intestin sont suffisantes pour déclencher la tumorigenèse[26]. Le gène GAST codant hPG80 est activé par la voie oncogénique Wnt. C’est une cible en aval de la voie de signalisation ß-caténine/Tcf-4[7].
La démonstration du lien entre hPG80 et une voie oncogénique a été décrite pour K-Ras. En effet, les lignées cellulaires et les tissus cancéreux du côlon présentant des mutations K-Ras avaient tous des taux d’ARNm du gène GAST significativement plus élevés que ceux de type K-Ras sauvage[27]. Les effets de K-Ras sur l’expression du gène GAST sont produits par l’activation de la voie de transduction du signal Raf-MEK-ERK, la dernière étape étant une activation du promoteur du gène GAST.
Sachant que K-Ras et la voie Wnt induisent tous deux l’expression du gène GAST, l’hypothèse d’une éventuelle coopération entre ces deux voies pour la régulation de l’expression de hPG80 a été étudiée[10]. Chakladar et al. ont trouvé une importante stimulation synergique du promoteur du gène GAST (par un facteur 25 à 40) par une combinaison de ß-caténine oncogénique et une surexpression de K-Ras. L’activation du promoteur du gène GAST a également été démontrée être dépendante d’autres signaux de signalisation : renforcée ou supprimée par la co-expression de SMAD4 sauvage ou par un mutant dominant négatif de SMAD4, respectivement, et abrogée par l’inhibition de la PI3K. Ainsi, l’activation constitutive de la voie Wnt, considérée comme étant au début de la tumorigenèse du côlon, et l’oncogène K-Ras, présents dans 50 % des tumeurs colorectales humaines, stimulent de manière synergique la production de hPG80, un promoteur de la tumorigenèse. La tumorigenèse induite par l’activation de la voie Wnt dépend en partie de hPG80.
SRC, PI3K/Akt, NF-kB et Jak/Stat[modifier | modifier le code]
L‘oncogène pp60 (c-Src) est activé dans les cellules cancéreuses du côlon et entraîne une augmentation des quantités de hPG80[9]. Ceci signifie que la production de hPG80, qui intervient lors de la tumorigenèse précoce, pourrait jouer un rôle dans cette activation, qui est connue comme un événement précoce de tumorigenèse du côlon[11],[28],[29]. La voie PI3K/Akt, particulièrement impliquée dans la prolifération, est également activée par hPG80[11],[30]. Le NF-kappaB est un autre messager de signalisation important régulé par hPG80. Son implication dans les mécanismes responsables de l’effet anti-apoptotique de hPG80 a été démontrée dans les cellules cancéreuses pancréatiques in vitro et in vivo chez les souris surexprimant le gène GAST[31],[32]. L’augmentation de JAK2 (Janus-activated kinase 2), STAT3 et de kinases régulées par des signaux extracellulaires a également été observée dans la muqueuse du côlon de souris hGAS[30].
NOTCH[modifier | modifier le code]
Il a été démontré que les cellules tumorales du côlon qui n’expriment pas hPG80 retournent à un état « normal ». Cela est dû au fait que lorsque la voie Wnt est inactivée, le gène JAG1 est réprimé, induisant l’inactivation de la voie Notch qui joue un rôle majeur dans l’acquisition d’un phénotype de cellule différenciée[33].
p-53[modifier | modifier le code]
En 2012, il a été démontré que la mutation génique p53 augmentait la prolifération des cellules du côlon dépendante de hPG80 et la formation du cancer du côlon chez la souris[12].
Récepteur de hPG80[modifier | modifier le code]
L’identification du récepteur de hPG80 a fait l’objet de plusieurs études ces dernières années. Cependant, l’identité de ce dernier demeure une véritable question au sein de la communauté scientifique. Le récepteur peut activer un certain nombre de voies de signalisation, directement ou indirectement, ce qui est plutôt inhabituel pour un récepteur. Cela pourrait indiquer une particularité de ce récepteur et la raison pour laquelle il est difficile de l’identifier. Le récepteur non identifié de hPG80 transduit un signal de la progastrine via divers intermédiaires intracellulaires connus pour leur implication dans la tumorigenèse.
Des sites de liaison à haute affinité ont été décrits pour la première fois dans des cellules épithéliales intestinales en utilisant de la progastrine humaine recombinante iodée[34]. L’affinité était de l’ordre de 0,5-1 nM, ce qui est compatible avec un récepteur. Lorsque la liaison de progastrine biotinylée a été évaluée par cytométrie de flux, une liaison forte et spécifique de la progastrine à certaines lignées cellulaires (IEC-6, IEC-18, HT-29, COLO320) a également été détectée[35]. La spécificité de la liaison a été confirmée par compétition avec de la hPG80 froide, non marquée, mais pas avec la gastrine possédant une glycine carboxy-terminale ou avec de la gastrine-17 amidée. La liaison n’a pas été influencée par la présence du récepteur CCK-2 classique. Il ressort clairement de ces deux études qu’il existe un site/récepteur de liaison de hPG80, distinct de la liaison à la gastrine-17 amidée et à la gastrine 17 possédant une glycine carboxy-terminale (G17-Gly). La séquence de hPG80 interagissant avec ce récepteur est probablement située dans les 26 derniers résidus acides aminés de l’extrémité carboxy-terminale de hPG80, qui se sont révélés suffisants pour sa fonction[36]. Toutefois, l’identité de ce récepteur putatif inconnue.
Un candidat est l’Annexine A2, identifiée comme étant capable de lier la progastrine et les peptides dérivés[37]. L’annexine A2 est un médiateur partiel de l’effet de la progastrine/gastrines. En particulier, l’Annexine A2 sert de médiateur dans la régulation à la hausse de NF-kappaB et de ß-caténine en réponse à la progastrine chez la souris et les cellules HEK-293[38]. En outre, l’annexine A2 pourrait être impliquée dans l’endocytose clathrine dépendante de la progastrine. Cependant, l’affinité de la progastrine pour l’Annexine A2 n’est pas celle qui serait attendue pour un récepteur spécifique. Et, bien que l’Annexine A2 joue un rôle dans les fonctions de la progastrine, ce ne sont pas celles d’un récepteur.
Un autre candidat est le récepteur 56 couplé aux protéines G (GPCR56), exprimé à la fois sur les cellules souches du côlon et les cellules cancéreuses[39]. En effet, alors que la hPG80 humaine recombinante favorise la croissance et la survie in vitro des organoïdes de côlon isssus de souris sauvages, ceux issus de souris déficientes pour le GPCR56 (GPCR56-/-) sont résistants à hPG80. Toutefois, bien qu’il ait été démontré que hPG80 se lie aux cellules exprimant le GPCR56, les auteurs n’ont pas fourni la preuve directe d’une liaison de hPG80 avec le GPCR56 lui-même. Le GPCR56 est un bon candidat, mais la preuve que ce soit le récepteur de hPG80 n’est pas encore établie.
Applications cliniques[modifier | modifier le code]
hPG80 par le biais de divers mécanismes qui sont tous cruciaux pour la croissance et la survie des tumeurs, peut être considérée comme un promoteur majeur de la tumorigenèse. hPG80 se trouve dans le plasma de patients cancéreux et sa neutralisation induit une réversion tumorale.
Dépistage[modifier | modifier le code]
Biomarqueur universel[modifier | modifier le code]
Le cancer colorectal n’est pas l’unique type de cancer à exprimer hPG80. Son expression a été démontrée également dans les cancers ovariens, dans les tumeurs hépatiques mais aussi dans les tumeurs pancréatiques[4],[40],[41]. Ainsi, plusieurs types de tumeurs expriment le peptide non maturé.
hPG80 peut être détectée et quantifiée dans le sang des patients atteints de cancers. Une première démonstration a été faite dans le cancer colorectal mettant en évidence une augmentation des taux plasmatiques de hPG80 et de gastrine non amidée chez ces patients par rapport à une série témoin[8]. De plus, il a été observé une augmentation de hPG80 chez des patients atteints de polypes adénomateux[15]. hPG80 est donc exprimée à tous les stades par la tumeur, des stades précoces aux métastases.
Détection multi-cancer[modifier | modifier le code]
hPG80 est retrouvée dans différents types de tumeurs et sécrétée in vitro par certaines cellules cancéreuses. Une étude a démontré sa présence dans le sang de patients atteints de 11 types différents de cancers: cancer du sein, cancer colorectal, cancer de l’estomac/œsophage, cancer du rein, cancer du foie, cancer du poumon non à petites cellules, mélanome de la peau, cancer de l’ovaire, cancer du pancréas, cancer de la prostate, cancer de l’utérus (endométrial/cervical)[1].
hPG80 dans la surveillance de la maladie résiduelle et la réponse aux traitements[modifier | modifier le code]
Des dosages de hPG80 dans le plasma de patients atteints de cancers colorectaux avant et après intervention chirurgicale montrent que la présence de hPG80 reflète la production tumorale[42].
Il a été observé que les concentrations de hPG80 sont augmentées chez les patients susceptibles de développer un carcinome colorectal[43]. De plus, il a été observé une augmentation de hPG80 dans les polypes hyperplastiques qui ont évolué vers un cancer[44],[45].
hPG80 pourrait également être un biomarqueur de la métastase hépatique dans le cancer colorectal[25].
En outre, You et al. ont observé une diminution de hPG80 après chirurgie dans une cohorte de patients souffrant de cancers gastro-intestinaux avec une atteinte péritonéale, traités par une chimiothérapie péri-opératoire et par une chirurgie cytoréductive[1].

De plus, la détection plus précoce de petites lésions et le suivi de la récidive peuvent être améliorées par la mesure des taux de hPG80, en tant que biomarqueur sanguin complémentaire dans une cohorte de patients atteints de carcinome hépatocellulaire, traités par des traitements locaux ou systémiques (Fig. 3)[1]. L’intérêt de mesurer hPG80 prend son sens chez les patients pour lesquels l’alpha-foetoprotéine (AFP) est en dessous du seuil établi en pratique clinique à 20ng/ml[46]. Suivant la prise en charge de la maladie, les patients en rémission présentent des taux de hPG80 plus faibles que ceux pour lesquels le cancer est toujours actif.
Cible pour combattre le cancer[modifier | modifier le code]
Thérapie par anticorps[modifier | modifier le code]
À ce jour, aucun médicament n’est capable de cibler les CSCs. L’utilisation d’anticorps anti-hPG80 humanisés, seuls ou en combinaison avec la chimiothérapie, semble être une approche prometteuse[15]. L’utilisation d’anticorps anti-hPG80 a également été évoquée dans le cadre d’un traitement potentiel chez des patients atteints d’un cancer colorectal et présentant une mutation au niveau du gène KRAS. Le ciblage de hPG80 avec l’anticorps humanisé anti-hPG80 a montré:
- une diminution de la capacité d'auto-renouvellement des CSCs de diverses origines ;
- une prolongation de la chimiosensibilité in vitro et in vivo ainsi qu’un retard de rechute après traitement des cellules T84 de souris xénogreffées ;
- une diminution de la charge tumorale et une augmentation de la différenciation cellulaire dans les tumeurs restantes, chez des souris transgéniques développant une néoplasie intestale induite par Wnt.
Ceci a été récemment confirmé pour les cancers de l’ovaire, du sein, de l’œsophage, du foie et de l’estomac faisant de cet anticorps thérapeutique un potentiel médicament multi-cancer[1].
Sensibilisation à la radiothérapie[modifier | modifier le code]
Il a été démontré que hPG80 est un facteur de radiorésistance qui peut être ciblé pour sensibiliser les cancers du rectum résistants aux radiations[47]. La diminution de l'expression de hPG80 augmente la sensibilité à l’irradiation dans des lignées de cellules de cancer colorectal entrainant une augmentation des dommages à l’ADN et de l’apoptose radio-induits. Dans la même lignée, le ciblage de hPG80 entraîne également l'inhibition des voies de survie, Akt et ERK, induites par l'irradiation.
Articles connexes[modifier | modifier le code]
Notes et références[modifier | modifier le code]
- Benoit You, Frédéric Mercier, Eric Assenat, Carole Langlois-Jacques, Olivier Glehen, Julien Soulé, Léa Payen, Vahan Kepenekian, Marie Dupuy, anny Belouin, Eric Morency, Véronique Saywell, Maud Flacelière, Philippe Elies, Pierre Liaud, Thibault Mazard, Delphine Maucort-Boulch, Winston Tan, Bérengère Vire, Laurent Villeneuve, Marc Ychou, Manish Kohli, Dominique Joubert et Alexandre Prieur, « The oncogenic and druggable hPG80 (Progastrin) is overexpressed in multiple cancers and detected in the blood of patients », EBioMedicine, vol. 51, , p. 102574 (ISSN 2352-3964, PMID 31877416, PMCID PMC6938867, DOI 10.1016/j.ebiom.2019.11.035, lire en ligne, consulté le )
- (en) Frédéric Hollande, Debra J. Lee, Armelle Choquet et Serge Roche, « Adherens junctions and tight junctions are regulated via different pathways by progastrin in epithelial cells », Journal of Cell Science, vol. 116, no 7, , p. 1187–1197 (ISSN 0021-9533 et 1477-9137, PMID 12615962, DOI 10.1242/jcs.00321, lire en ligne, consulté le )
- (en) L. Bardram, L. Hilsted et J. F. Rehfeld, « Progastrin expression in mammalian pancreas », Proceedings of the National Academy of Sciences, vol. 87, no 1, , p. 298–302 (ISSN 0027-8424 et 1091-6490, PMID 2296587, PMCID PMC53250, DOI 10.1073/pnas.87.1.298, lire en ligne, consulté le )
- W. W. van Solinge, L. Odum et J. F. Rehfeld, « Ovarian cancers express and process progastrin », Cancer Research, vol. 53, no 8, , p. 1823–1828 (ISSN 0008-5472, PMID 8467501, lire en ligne, consulté le )
- P. Singh, Z. Xu, B. Dai et S. Rajaraman, « Incomplete processing of progastrin expressed by human colon cancer cells: role of noncarboxyamidated gastrins », American Journal of Physiology-Gastrointestinal and Liver Physiology, vol. 266, no 3, , G459–G468 (ISSN 0193-1857, DOI 10.1152/ajpgi.1994.266.3.G459, lire en ligne, consulté le )
- P. Singh, A. Owlia, A. Varro et B. Dai, « Gastrin gene expression is required for the proliferation and tumorigenicity of human colon cancer cells », Cancer Research, vol. 56, no 18, , p. 4111–4115 (ISSN 0008-5472, PMID 8797575, lire en ligne, consulté le )
- (en) Theodore J Koh et Duan Chen, « Gastrin as a growth factor in the gastrointestinal tract », Regulatory Peptides, 20th Anniversary Celebratory Special Issue, vol. 93, no 1, , p. 37–44 (ISSN 0167-0115, DOI 10.1016/S0167-0115(00)00176-2, lire en ligne, consulté le )
- (en) R. K. Siddheshwar, J. C. Gray et S. B. Kelly, « Plasma levels of progastrin but not amidated gastrin or glycine extended gastrin are elevated in patients with colorectal carcinoma », Gut, vol. 48, no 1, , p. 47–52 (ISSN 0017-5749 et 1468-3288, PMID 11115822, PMCID PMC1728168, DOI 10.1136/gut.48.1.47, lire en ligne, consulté le )
- (en) D. Brown, U. Yallampalli, A. Owlia et P. Singh, « pp60c-Src Kinase Mediates Growth Effects of the Full-Length Precursor Progastrin1–80 Peptide on Rat Intestinal Epithelial Cells, in Vitro », Endocrinology, vol. 144, no 1, , p. 201–211 (ISSN 0013-7227, DOI 10.1210/en.2002-220501, lire en ligne, consulté le )
- (en) Abhijit Chakladar, Alexander Dubeykovskiy, Lindsay J. Wojtukiewicz et Jitesh Pratap, « Synergistic activation of the murine gastrin promoter by oncogenic Ras and β-catenin involves SMAD recruitment », Biochemical and Biophysical Research Communications, vol. 336, no 1, , p. 190–196 (ISSN 0006-291X, DOI 10.1016/j.bbrc.2005.08.061, lire en ligne, consulté le )
- Julie Pannequin, Nathalie Delaunay, Michael Buchert, Fanny Surrel, Jean-François Bourgaux, Joanne Ryan, Stéphanie Boireau, Jessica Coelho, André Pélegrin, Pomila Singh, Arthur Shulkes, Mildred Yim, Graham S Baldwin, Christine Pignodel, Gérard Lambeau, Philippe Jay, Dominique Joubert et Frédéric Hollande, « β-Catenin/Tcf-4 Inhibition After Progastrin Targeting Reduces Growth and Drives Differentiation of Intestinal Tumors », Gastroenterology, vol. 133, no 5, , p. 1554–1568 (ISSN 0016-5085, DOI 10.1053/j.gastro.2007.08.023, lire en ligne, consulté le )
- Vigneshwaran Ramanathan, Guangchun Jin, Christoph Benedikt Westphalen et Ashley Whelan, « P53 Gene Mutation Increases Progastrin Dependent Colonic Proliferation and Colon Cancer Formation in Mice », Cancer Investigation, vol. 30, no 4, , p. 275–286 (ISSN 0735-7907, PMID 22480191, PMCID PMC3697930, DOI 10.3109/07357907.2012.657814, lire en ligne, consulté le )
- (en) S. Najib, A. Kowalski-Chauvel, C. Do et S. Roche, « Progastrin a new pro-angiogenic factor in colorectal cancer », Oncogene, vol. 34, no 24, , p. 3120–3130 (ISSN 1476-5594, DOI 10.1038/onc.2014.255, lire en ligne, consulté le )
- (en) Julie Giraud, Laura M. Failla, Jean-Marc Pascussi, Ebba L. Lagerqvist, Jérémy Ollier, Pascal Finetti, François Bertucci, Chu Ya, Imène Gasmi, Jean-François Bourgaux, Michel Prudhomme, Thibault Mazard, Imade Ait-Arsa, Leila Houhou, Daniel Birnbaum, André Pélegrin, Charles Vincent, James G Ryall, Dominique Joubert, Julie Pannequin et Frédéric Hollande, « Autocrine Secretion of Progastrin Promotes the Survival and Self-Renewal of Colon Cancer Stem–like Cells », Cancer Research, vol. 76, no 12, , p. 3618–3628 (ISSN 0008-5472 et 1538-7445, PMID 27197176, DOI 10.1158/0008-5472.CAN-15-1497, lire en ligne, consulté le )
- (en) Alexandre Prieur, Monica Cappellini, Guillaume Habif, Marie-Paule Lefranc, Thibault Mazard, Eric Morency, Jean-Marc Pascussi, Nathalie Cahuzac, Berengere Vire, Benjamin Dubuc, Amandine Durochat, Pierre Liaud, Jeremy Ollier, Caroline Pfeiffer, Sophie Poupeau, Veronique Saywell, Chris Planque, Eric Assenat, Frederic Bibeau, Jean-François Bourgaux, Pascal Pujol, Alain Sezeur, Marc Ychou et Dominique Joubert, « Targeting the Wnt Pathway and Cancer Stem Cells with Anti-progastrin Humanized Antibodies as a Potential Treatment for K-RAS-Mutated Colorectal Cancer », Clinical Cancer Research, vol. 23, no 17, , p. 5267–5280 (ISSN 1078-0432 et 1557-3265, PMID 28600477, DOI 10.1158/1078-0432.CCR-17-0533, lire en ligne, consulté le )
- (en) Michael Lee Kochman, John DelValle, Chris John Dickinson et C. Richard Boland, « Post-translational processing of gastrin in neoplastic human colonic tissues », Biochemical and Biophysical Research Communications, vol. 189, no 2, , p. 1165–1169 (ISSN 0006-291X, DOI 10.1016/0006-291X(92)92326-S, lire en ligne, consulté le )
- (en) Wouter W. Van Solinge, Finn C. Nielsen, Lennart Friis-Hansen et Ursula G. Falkmer, « Expression but incomplete maturation of progastrin in colorectal carcinomas », Gastroenterology, vol. 104, no 4, , p. 1099–1107 (DOI 10.1016/0016-5085(93)90279-L, lire en ligne, consulté le )
- Giuseppe D. Ciccotosto, Andrew McLeish, Kenneth J. Hardy et Arthur Shulkes, « Expression, processing, and secretion of gastrin in patients with colorectal carcinoma », Gastroenterology, vol. 109, no 4, , p. 1142–1153 (ISSN 0016-5085, DOI 10.1016/0016-5085(95)90572-3, lire en ligne, consulté le )
- G. G. Finley, R. A. Koski, M. F. Melhem et J. M. Pipas, « Expression of the gastrin gene in the normal human colon and colorectal adenocarcinoma », Cancer Research, vol. 53, no 12, , p. 2919–2926 (ISSN 0008-5472, PMID 8504433, lire en ligne, consulté le )
- (en) A. Imdahl, T. Mantamadiotis, S. Eggstein et E. H. Farthmann, « Expression of gastrin, gastrin/CCK-B and gastrin/CCK-C receptors in human colorectal carcinomas », Journal of Cancer Research and Clinical Oncology, vol. 121, no 11, , p. 661–666 (ISSN 1432-1335, DOI 10.1007/BF01218524, lire en ligne, consulté le )
- (en) J. Nemeth, B. Taylor, S. Pauwels et A. Varro, « Identification of progastrin derived peptides in colorectal carcinoma extracts. », Gut, vol. 34, no 1, , p. 90–95 (ISSN 0017-5749 et 1468-3288, PMID 8432459, PMCID PMC1374107, DOI 10.1136/gut.34.1.90, lire en ligne, consulté le )
- (en) Stephanie Cobb, Thomas Wood, Jeffrey Ceci et Andrea Varro, « Intestinal expression of mutant and wild-type progastrin significantly increases colon carcinogenesis in response to azoxymethane in transgenic mice », Cancer, vol. 100, no 6, , p. 1311–1323 (ISSN 1097-0142, DOI 10.1002/cncr.20094, lire en ligne, consulté le )
- P. Singh, M. Velasco, R. Given et M. Wargovich, « Mice overexpressing progastrin are predisposed for developing aberrant colonic crypt foci in response to AOM », American Journal of Physiology. Gastrointestinal and Liver Physiology, vol. 278, no 3, , G390–399 (ISSN 0193-1857, PMID 10712258, DOI 10.1152/ajpgi.2000.278.3.G390, lire en ligne, consulté le )
- Hai Wu, Azarmidokht Owlia et Pomila Singh, « Precursor peptide progastrin1-80 reduces apoptosis of intestinal epithelial cells and upregulates cytochrome c oxidase Vb levels and synthesis of ATP », American Journal of Physiology-Gastrointestinal and Liver Physiology, vol. 285, no 6, , G1097–G1110 (ISSN 0193-1857, DOI 10.1152/ajpgi.00216.2003, lire en ligne, consulté le )
- (en) David A. Westwood, Oneel Patel, Christopher Christophi et Arthur Shulkes, « Progastrin: a potential predictive marker of liver metastasis in colorectal cancer », International Journal of Colorectal Disease, vol. 32, no 7, , p. 1061–1064 (ISSN 1432-1262, DOI 10.1007/s00384-017-2822-8, lire en ligne, consulté le )
- (en) D. J. Huels et O. J. Sansom, « Stem vs non-stem cell origin of colorectal cancer », British Journal of Cancer, vol. 113, no 1, , p. 1–5 (ISSN 1532-1827, PMID 26110974, PMCID PMC4647531, DOI 10.1038/bjc.2015.214, lire en ligne, consulté le )
- H NAKATA, S WANG, D CHUNG et J WESTWICK, « Oncogenic ras induces gastrin gene expression in colon cancer », Gastroenterology, vol. 115, no 5, , p. 1144–1153 (ISSN 0016-5085, DOI 10.1016/s0016-5085(98)70085-x, lire en ligne, consulté le )
- (en) C. A. Cartwright, A. I. Meisler et W. Eckhart, « Activation of the pp60c-src protein kinase is an early event in colonic carcinogenesis », Proceedings of the National Academy of Sciences, vol. 87, no 2, , p. 558–562 (ISSN 0027-8424 et 1091-6490, PMID 2105487, PMCID PMC53304, DOI 10.1073/pnas.87.2.558, lire en ligne, consulté le )
- S. Iravani, W. Mao, L. Fu et R. Karl, « Elevated c-Src protein expression is an early event in colonic neoplasia », Laboratory Investigation; a Journal of Technical Methods and Pathology, vol. 78, no 3, , p. 365–371 (ISSN 0023-6837, PMID 9520949, lire en ligne, consulté le )
- (en) Audrey Ferrand, Claudine Bertrand, Ghislaine Portolan et Guanglin Cui, « Signaling Pathways Associated with Colonic Mucosa Hyperproliferation in Mice Overexpressing Gastrin Precursors », Cancer Research, vol. 65, no 7, , p. 2770–2777 (ISSN 0008-5472 et 1538-7445, PMID 15805277, DOI 10.1158/0008-5472.CAN-04-0978, lire en ligne, consulté le )
- (en) William Rengifo-Cam, Shahid Umar, Shubhashish Sarkar et Pomila Singh, « Antiapoptotic Effects of Progastrin on Pancreatic Cancer Cells Are Mediated by Sustained Activation of Nuclear Factor-κB », Cancer Research, vol. 67, no 15, , p. 7266–7274 (ISSN 0008-5472 et 1538-7445, PMID 17671195, DOI 10.1158/0008-5472.CAN-07-1206, lire en ligne, consulté le )
- (en) S. Umar, S. Sarkar, S. Cowey et P. Singh, « Activation of NF-κB is required for mediating proliferative and antiapoptotic effects of progastrin on proximal colonic crypts of mice, in vivo », Oncogene, vol. 27, no 42, , p. 5599–5611 (ISSN 1476-5594, PMID 18521082, PMCID PMC2891442, DOI 10.1038/onc.2008.169, lire en ligne, consulté le )
- (en) Julie Pannequin, Caroline Bonnans, Nathalie Delaunay, Joanne Ryan, Jean-François Bourgaux, Dominique Joubert et Frédéric Hollande, « The Wnt Target Jagged-1 Mediates the Activation of Notch Signaling by Progastrin in Human Colorectal Cancer Cells », Cancer Research, vol. 69, no 15, , p. 6065–6073 (ISSN 0008-5472 et 1538-7445, PMID 19622776, DOI 10.1158/0008-5472.CAN-08-2409, lire en ligne, consulté le )
- P. Singh, X. Lu, S. Cobb et B. T. Miller, « Progastrin1–80 stimulates growth of intestinal epithelial cells in vitro via high-affinity binding sites », American Journal of Physiology-Gastrointestinal and Liver Physiology, vol. 284, no 2, , G328–G339 (ISSN 0193-1857, DOI 10.1152/ajpgi.00351.2002, lire en ligne, consulté le )
- (en) Alexander Dubeykovskiy, Thomas Nguyen, Zinaida Dubeykovskaya et Shi Lei, « Flow cytometric detection of progastrin interaction with gastrointestinal cells », Regulatory Peptides, vol. 151, no 1, , p. 106–114 (ISSN 0167-0115, PMID 18674570, PMCID PMC2630224, DOI 10.1016/j.regpep.2008.07.001, lire en ligne, consulté le )
- P. D. Ottewell, A. Varro, G. J. Dockray et C. M. Kirton, « COOH-terminal 26-amino acid residues of progastrin are sufficient for stimulation of mitosis in murine colonic epithelium in vivo », American Journal of Physiology-Gastrointestinal and Liver Physiology, vol. 288, no 3, , G541–G549 (ISSN 0193-1857, DOI 10.1152/ajpgi.00268.2004, lire en ligne, consulté le )
- (en) P. Singh, H. Wu, C. Clark et A. Owlia, « Annexin II binds progastrin and gastrin-like peptides, and mediates growth factor effects of autocrine and exogenous gastrins on colon cancer and intestinal epithelial cells », Oncogene, vol. 26, no 3, , p. 425–440 (ISSN 1476-5594, DOI 10.1038/sj.onc.1209798, lire en ligne, consulté le )
- Shubhashish Sarkar, Rafal Swiercz, Carla Kantara et Katherine A. Hajjar, « Annexin A2 Mediates Up-regulation of NF-κB, β-catenin, and Stem Cell in Response to Progastrin in Mice and HEK-293 Cells », Gastroenterology, vol. 140, no 2, , p. 583–595.e4 (ISSN 0016-5085, PMID 20826156, PMCID PMC3031715, DOI 10.1053/j.gastro.2010.08.054, lire en ligne, consulté le )
- Guangchun Jin, Kosuke Sakitani, Hongshan Wang et Ying Jin, « The G-protein coupled receptor 56, expressed in colonic stem and cancer cells, binds progastrin to promote proliferation and carcinogenesis », Oncotarget, vol. 8, no 25, , p. 40606–40619 (ISSN 1949-2553, PMID 28380450, PMCID PMC5522213, DOI 10.18632/oncotarget.16506, lire en ligne, consulté le )
- Martyn Caplin, Kosser Khan, Kay Savage et Jurgen Rode, « Expression and processing of gastrin in hepatocellular carcinoma, fibrolamellar carcinoma and cholangiocarcinoma », Journal of Hepatology, vol. 30, no 3, , p. 519–526 (ISSN 0168-8278, DOI 10.1016/s0168-8278(99)80114-7, lire en ligne, consulté le )
- (en) M. Caplin, K. Savage, K. Khan et B. Brett, « Expression and processing of gastrin in pancreatic adenocarcinoma », BJS (British Journal of Surgery), vol. 87, no 8, , p. 1035–1040 (ISSN 1365-2168, DOI 10.1046/j.1365-2168.2000.01488.x, lire en ligne, consulté le )
- (en) Peter C. Konturek, Władysław Bielanski, Stanislaw J. Konturek et Artur Hartwich, « Progastrin and Cyclooxygenase-2 in Colorectal Cancer », Digestive Diseases and Sciences, vol. 47, no 9, , p. 1984–1991 (ISSN 1573-2568, DOI 10.1023/A:1019652224424, lire en ligne, consulté le )
- (en) Adrienne C. Paterson, Finlay A. Macrae, Cathy Pizzey et Graham S. Baldwin, « Circulating gastrin concentrations in patients at increased risk of developing colorectal carcinoma », Journal of Gastroenterology and Hepatology, vol. 29, no 3, , p. 480–486 (ISSN 1440-1746, DOI 10.1111/jgh.12417, lire en ligne, consulté le )
- (en) Catherine Do, Claudine Bertrand, Julien Palasse et Marie-Bernadette Delisle, « A New Biomarker That Predicts Colonic Neoplasia Outcome in Patients with Hyperplastic Colonic Polyps », Cancer Prevention Research, vol. 5, no 4, , p. 675–684 (ISSN 1940-6207 et 1940-6215, PMID 22366915, DOI 10.1158/1940-6207.CAPR-11-0408, lire en ligne, consulté le )
- Catherine Do, Claudine Bertrand, Julien Palasse et Marie-Bernadette Delisle, « Activation of pro-oncogenic pathways in colorectal hyperplastic polyps », BMC Cancer, vol. 13, no 1, , p. 531 (ISSN 1471-2407, PMID 24209454, PMCID PMC3829387, DOI 10.1186/1471-2407-13-531, lire en ligne, consulté le )
- Shahid Sarwar, Anwaar Ahmad Khan et Shandana Tarique, « Validity of alpha fetoprotein for diagnosis of hepatocellular carcinoma in cirrhosis », Journal of the College of Physicians and Surgeons--Pakistan: JCPSP, vol. 24, no 1, , p. 18–22 (ISSN 1681-7168, PMID 24411536, lire en ligne, consulté le )
- Aline Kowalski-Chauvel, Valerie Gouaze-Andersson, Alix Vignolle-Vidoni et Caroline Delmas, « Targeting progastrin enhances radiosensitization of colorectal cancer cells », Oncotarget, vol. 8, no 35, , p. 58587–58600 (ISSN 1949-2553, PMID 28938581, PMCID PMC5601677, DOI 10.18632/oncotarget.17274, lire en ligne, consulté le )

