Fluorométhane
| Fluorométhane | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | fluorométhane | |
| Synonymes |
flurorure de méthyle |
|
| No CAS | ||
| No ECHA | 100.008.907 | |
| No CE | 209-796-6 | |
| PubChem | 11638 | |
| ChEBI | 28826 | |
| SMILES | ||
| InChI | ||
| Apparence | Gaz incolore, inodore | |
| Propriétés chimiques | ||
| Formule | CH3F [Isomères] |
|
| Masse molaire[1] | 34,032 9 ± 0,001 g/mol C 35,29 %, H 8,88 %, F 55,82 %, |
|
| Propriétés physiques | ||
| T° fusion | −137,8 °C [2] | |
| T° ébullition | −78,4 °C [2] | |
| Solubilité | 22,7 g·l-1 (eau,20 °C) [3] | |
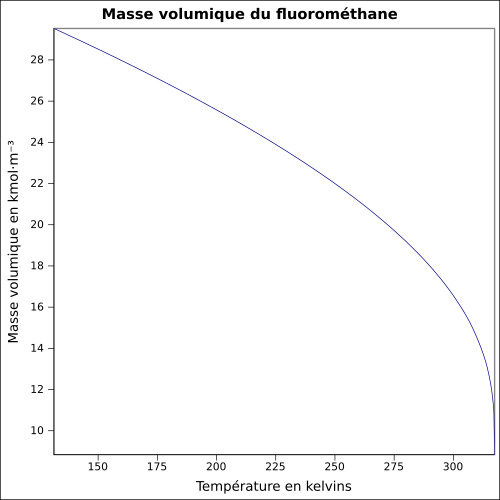
| Masse volumique | 1,536 7 g·cm-3 (0 °C,1,013 mbar) [2]
|
|
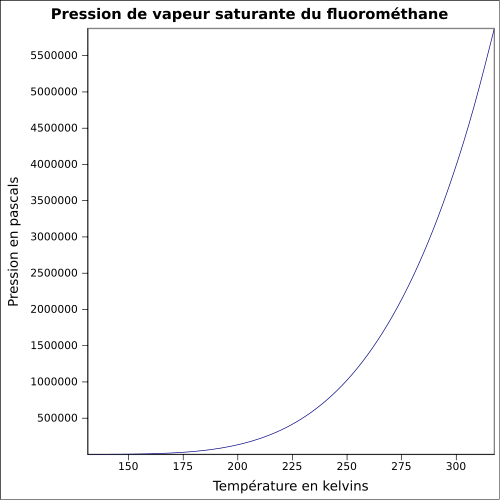
| Pression de vapeur saturante | 33 bar à 20 °C 43,9 bar à 30 °C 54,3 bar à 40 °C [2] |
|
| Point critique | 44,55 °C, 58,742 bar, 0,30 g·cm-3 [2] | |
| Point triple | −137,8 °C [2] | |
| Thermochimie | ||
| S0gaz, 1 bar | 222,84 J·K-1·mol-1 [5] | |
| ΔfH0gaz | −234,3 kJ·mol-1 [5] | |
| Cp | 38.171 J.mol-1.K-1 à 25 °C
|
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,47 ± 0,02 eV (gaz)[7] | |
| Précautions | ||
| SIMDUT[8] | ||
 A, |
||
| Directive 67/548/EEC[2] | ||
| Transport[2] | ||
| Écotoxicologie | ||
| LogP | 0,51 [2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le fluorométhane, connu aussi sous le nom de fluorure de méthyle, de Fréon 41, ou de HFC-41, est un hydrofluorocarbure gazeux, liquéfiable, et extrêmement inflammable aux conditions normales de température et de pression.
Propriétés physico-chimiques[modifier | modifier le code]
Le fluorométhane, en raison de la forte électronégativité du fluor, est une molécule fortement polaire, ce qui le rend assez soluble dans l'eau (22,7 g·L-1 à 20 °C).
L'énergie de liaison C-F est de 552 kJ·mol-1 et sa longueur de 0,139 nm (typiquement 0,14 nm).
Le potentiel de réchauffement global de fluorométhane est de 150.
Utilisation[modifier | modifier le code]
Il est utilisé dans la fabrication de semiconducteurs et de composés électroniques. Il est notamment utilisé comme source d'ions fluor dans la gravure ionique réactive (RIE) du silicium. Il a aussi été utilisé comme fluide frigorigène.
Sécurité[modifier | modifier le code]
Le fluorométhane forme avec l'air un mélange explosif. À moins d'une forte proportion dans l'air, son odeur n'est pas perceptible. Ses éventuels effets toxiques ne sont pas connus. Sa combustion entraîne la formation du très toxique fluorure d'hydrogène. Comme d'autres composés du fluor, on le soupçonne d'avoir des effets narcotiques.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Fluoromethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 février 2010 (JavaScript nécessaire)
- (en) « Fluorométhane », sur ChemIDplus, consulté le
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Methyl fluoride », sur NIST/WebBook, consulté le
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Fluorure de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Liens externes[modifier | modifier le code]
- (en) National Pollutant Inventory - Fluoride and compounds fact sheet
- MSDS at Oxford University
- Data at Airliquide Encyclopedia
- Termochemical data at chemnet.ru