Squalène
| Squalène | ||
 | ||
| Structure du Squalène, un terpène. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (6E,10E,14E,18E)-2,6,10,15,19,23-hexaméthyltétracosahexa-2,6,10,14,18,22-ène | |
| No CAS | ||
| No ECHA | 100.003.479 | |
| No CE | 203-826-1 | |
| No RTECS | XB6010000 | |
| PubChem | 638072 | |
| ChEBI | 15440 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide huileux incolore avec une petite odeur[1] | |
| Propriétés chimiques | ||
| Formule | C30H50 [Isomères] |
|
| Masse molaire[2] | 410,718 ± 0,027 5 g/mol C 87,73 %, H 12,27 %, |
|
| Propriétés physiques | ||
| T° fusion | −5 °C[3] | |
| T° ébullition | 275 °C à 20 hPa[1] | |
| Masse volumique | 0,86 g·cm-3[1] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,4990 à 20 °C[4] | |
| Précautions | ||
| SGH[5],[6] | ||
| H304, P331, P301+P310, P405 et P501 |
||
| Écotoxicologie | ||
| DL50 | 5000 mg/kg (souris, oral)[5] 1800 mg/kg (souris, i.v.)[5] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le squalène (SQ) parfois appelé aussi spinacène ou supraène[5] est un triterpène, isoprénoïde composé de trente atomes de carbone et de cinquante atomes d'hydrogène, de nom : (E) 2,6,10,15,19,23-Hexaméthyl-2,6,10,14,18,22-tétracosahexène.
Ses six unités d'isoprène sont toutes en configuration trans.
C'est un lipide de composition hydrocarbonée naturellement produit par tous les organismes supérieurs y compris les humains (Il est notamment retrouvé dans le sébum humain) et c'est un intermédiaire essentiel dans la biosynthèse du cholestérol, des hormones stéroïdes et de la vitamine D chez l'humain[7].
Il est présent en grande quantité dans l'huile du foie des requins d'où son nom, ainsi que dans l'huile d'amarante (6,5%[8]) et en moindre quantité (0,1 à 0,7 %) dans l'huile d'olive et dans d'autres huiles céréalières, des semences, du son de riz, de germes de blé… Le squalène commercialisé est principalement extrait de foies de requins. Il est utilisé dans des produits de beauté, comme cosmétique et dans certains vaccins, ce qui a suscité des controverses quant à l'innocuité de ces vaccins.
Origine du nom
Le nom du composé provient du fait qu'il ait été isolé pour la première fois en 1916, dans le foie de requins, dont l'Aiguillat épinette (Squalus mitsukurii). Le squalène a ensuite été identifié dans plusieurs plantes[9],[10].
Propriétés
Interactions avec l'oxygène
Le squalène a la propriété d'absorber le dioxygène. Cependant, la quantité de dioxygène absorbée n'est physiologiquement significative que chez le requin.
Biosynthèse dans l'organisme
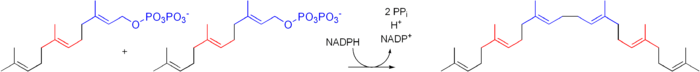
- Deux molécules de farnésyl-pyrophosphate se condensent après réduction par le NADPH pour former du squalène - sous l'action de la squalène synthétase.
Rôle dans la synthèse des stéroïdes

Le squalène est le précurseur biochimique de toute la famille des stéroïdes[11] : c'est l'oxydation (via une enzyme, la monooxygénase squalène) de l'une des extrémités de la molécule de squalène qui produit par cyclisation, catalysée par des enzymes, le lanostérol, lequel sera transformé en cholestérol et en d'autres stéroïdes.
Squalène de requin
C'est un composé de faible densité (densité de 0,855, ce qui en fait un composé moins dense que l'eau) qu'on trouve souvent essentiellement stocké dans le foie des poissons cartilagineux tels que les requins qui n'ont pas de vessie natatoire et qui doivent donc réduire leur densité corporelle avec des graisses et des huiles.
Il est une des causes de surpêche du requin, qui est chassé pour ses ailerons, mais dont les foies sont utilisés pour en extraire l'huile de foie de requin notamment vendue pour produire des gélules supposées bonnes pour la santé. Des préoccupations environnementales (forte régression des requins) et sanitaires (le foie des poissons stocke aussi des toxines préoccupantes pour la santé) ont motivé son extraction à partir de végétaux[12].
Usage en complément alimentaire
Le squalène est vendu comme un complément alimentaire, généralement sous forme de capsules ou d’huile (comme l'huile d'olive). Par voie orale il est considéré comme sûr, mais le squalène injecté avec certains vaccins fait l’objet de controverses (voir plus bas) Le squalène naturel et de haute qualité, exempt de traces de métaux, notamment de mercure, et d'autres toxines est considéré comme un antioxydant puissant, et supposé être bénéfique pour la santé[réf. nécessaire].
Une étude japonaise sur le rat a montré que le squalane est mal absorbé par le tractus gastro-intestinal et qu'un traitement de 3 mois n'a pas eu d'effet secondaire. Les mêmes auteurs ont ensuite étudié la distribution, l'excrétion et la toxicité subaiguë du squalane chez le chien beagle (mâle)[13]. Dans les 48 heures suivant l'administration d'une dose orale unique de 1 200 mg/kg, environ 83 % de la dose ingérée a été éliminée dans les excréments. Au jour 3, le squalane absorbé était principalement distribué dans les poils et la peau, mais les concentrations dans ces tissus ont ensuite diminué au jour 6. Les poils et le sébum semblent être deux voies d'élimination à court ou moyen-terme[13]. Mais du squalane est aussi distribué dans le foie et, là, éliminé bien plus lentement. Un apport oral de 400 mg/kg/jour ou de 1 200 mg/kg/jour de squalane durant 13 semaines chez des beagles mâles et femelles se traduit respectivement par un niveau d'environ 3 % (400 mg/kg) et 6 % (1 200 mg/kg) de la dose quotidienne, essentiellement dans le foie, mais sans signe toxique relevés par les tests biochimiques sériques et le test fonctionnel hépatique pour les groupes squalane[13].
Un apport de 1 200 mg/kg/jour chez le chien durant 2 semaine a ensuite montré que l'excrétion fécale quotidienne de squalane était de 65 à 90 % de la dose quotidienne[14]. En fin de traitement (le jour 14), les taux de squalane dans le sang et les poils étaient respectivement d'environ 30 ppm et 14 640 ppm. Au jour 56 après le premier dosage, le squalane n'était plus retrouvé dans le sang et au jour 70, les poils ne contenaient plus que 1 % environ de ce qu'ils contenaient au jour 14 [14]. Au jour 70, la peau, le foie, le tissu adipeux et l'intestin grêle en contenaient moins qu'au jour 42. Les fèces en ont exporté du jour 15 au jour 70. Chez le chien, le squalane absorbé est donc peu à peu excrété par les fèces, la peau et les phanères[14].
Usage cosmétique
Cette molécule est utilisée en cosmétologie dans les crèmes hydratantes comme agent pénétrant rapidement la peau sans laisser de traces ou sensations grasses sur la peau et se mélangeant bien avec d'autres huiles et vitamines.
Le squalane est la forme saturée hydrogénée de squalène dans lesquels les doubles liaisons chimiques ont été éliminées par hydrogénation. Moins sensible à l'oxydation, et résistant aux haute températures il est plus communément utilisé dans les produits de beauté que le squalène.
Les études toxicologiques ont au début des années 1980 montré qu’aux taux utilisés dans les cosmétiques, le squalène et le squalane ont tous deux une toxicité aiguë faible, et ne sont ni irritants ni sensibilisants pour la peau humaine[15], ou du chien et du rat utilisés comme modèle animal (selon une étude japonaise de 1989)[16].
Usage médical
Facilitation de l'excrétion de certains toxiques ?
On a montré au Japon chez le rat, que l'ingestion de squalane peut stimuler l'excrétion fécale du 2,3,4,7,8-pentachlorodibenzofurane (cause la plus fréquente de maladie de Yushō parmi les congénères PCB et PCDF, liposolubles et donc contaminant fréquent d'huiles alimentaires[13]
Adjuvant de vaccin
Les adjuvants sont des substances, administrées conjointement avec un vaccin, qui stimulent le système immunitaire et augmentent la réponse au vaccin. Le squalène est l’un de ces adjuvants[17].
Sous la forme d'une émulsion ajoutée à la substance vaccinante pour rendre le vaccin plus immunogène[18], du squalène a été utilisé depuis 1997 dans un vaccin antigrippal (FLUAD, de Chiron, contre la grippe saisonnière) à raison d'environ 10 mg de squalène par dose. Ce vaccin a été approuvé par les agences de santé de plusieurs pays européens, mais non par la FDA (Food and Drug Administration) américaine qui n'a pas autorisé son utilisation aux États-Unis[19]. Comme tous les vaccins contenant du squalène, ces émulsions ont un aspect blanc laiteux.
Le squalène est utilisé comme adjuvant vaccinal, notamment des vaccins expérimentaux, substances antipaludéennes (le vaccin antipaludéen n'existe pas), ou vaccin anti-grippe ciblant les virus émergents H5N1 puis en 2009 H1N1[20], en tant que :
- constituant breveté du système adjuvant AS03[21] utilisé par GlaxoSmithKline dans le vaccin contre la pandémie grippale 2009 Pandemrix et « Arepanrix »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ).
- constituant breveté du système adjuvant MF59[22] utilisé par Novartis.
Il a été développé dans les années 1990 par Ciba-Geigy (société intégrée dans le patrimoine de Novartis) et Chiron, acquis par Novartis en 2006[23]. Il a été ajouté aux vaccins antigrippaux pour stimuler la réponse immunitaire du corps humain à travers la production de cellules CD4 à mémoire. C’est le premier adjuvant huile-dans-l’eau pour vaccin contre la grippe à avoir été commercialisé en association avec les antigènes du virus de la grippe saisonnière.
Controverse à propos de son impact sur la santé
Le squalène est utilisé comme cosmétique, mais aussi comme adjuvant immunologique de vaccins.
Une controverse est apparue sur les avantages et les dangers du squalène (extrait d'huile de foie de requin) utilisé comme adjuvant vaccinal[24],[25], en particulier quand il est injecté[26],[27],[28]. Ces doutes ont été relayés par la presse nord américaine[29] et ont resurgi en Europe à l'occasion de son utilisation dans certains vaccins antigrippaux. Il y a eu des associations faites entre squalène et syndrome de la guerre du Golfe, reposant sur le fait qu'on supposait que du squalène était présent dans les vaccins contre le charbon administrés à certains militaires lors de la guerre du Golfe en 1991[30]. Une étude avait retrouvé chez 95 % des patients atteints d'un syndrome de la guerre du golfe des anticorps anti-squalène, alors qu'aucun vétéran asymptomatique n'avait ces anticorps[31],[32]. Mais l'armée américaine, relayée par l'OMS a affirmé que les vaccins soupçonnés ne contenaient pas de squalène, que le rapport initial comportait des faiblesses techniques, et qu'il se pourrait que la plupart des adultes, qu'ils aient reçu ou pas des vaccins contenant du squalène, possèdent des anticorps contre cette substance[33].
Après avoir répondu à tous ces doutes en s'appuyant sur des études, l'OMS affirme que le squalène utilisé dans les vaccins ne fait pas courir de risque significatif, même si une surveillance reste nécessaire, notamment dans certaines tranches d'âge[33] et en fonction de la concentration, de la dose et des voies d’administration entre autres facteurs[34],[35].
L’OMS et le Département de la Défense des États-Unis ont tous deux publié des rapports détaillés soulignant que le squalène est aussi produit naturellement par le corps humain, par exemple présent dans les lipides retrouvés dans les empreintes digitales de l'homme[18],[36].
Les suspensions huile dans l’eau, y compris le MF59, ont été suspectées d’induire des anticorps contre le lupus chez les souris indemnes de maladies auto-immunes[37]. Dans une étude, le squalène endogène est lié à l'arthrite auto-immune chez le rat[38]. L'analyse épidémiologique des données de sécurité sur les vaccins contre la grippe saisonnière et pandémique contenant du MF59 n’a mis en évidence aucun risque accru d'effets indésirables des vaccins potentiellement à l’origine de maladie auto-immune[39].
Notes et références
- « Fiche Squalene », Merck [PDF] (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- J. Ernst, J.-H. Fuhrhop, Die Kristallstruktur des Squalens., Liebigs Annalen der Chemie, 1979, vol. 11, pp. 1635–1642. DOI 10.1002/jlac.197919791102.
- David R. Lide, CRC Handbook of Chemistry and Physics, 90e Ed. (Internet-Version: 2010), CRC Press/Taylor, et Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-462.
- PubChem CID 638072.
- (en) « Squalene », sur nih.gov (consulté le ).
- Source
- (en) Manuel León-Camacho, Diego L. García-González et Ramón Aparicio, « A detailed and comprehensive study of amaranth (Amaranthus cruentus L.) oil fatty profile », European Food Research and Technology, vol. 213, nos 4-5, , p. 349–355 (ISSN 1438-2377 et 1438-2385, DOI 10.1007/s002170100340, lire en ligne, consulté le )
- Mitsumaru. Tsujimoto, « A HIGHLY UNSATURATED HYDROCARBON IN SHARK LIVER OIL », Journal of Industrial & Engineering Chemistry, vol. 8, no 10, , p. 889–896 (ISSN 0095-9014, DOI 10.1021/i500010a005, lire en ligne, consulté le )
- L. Harivardhan Reddy et Patrick Couvreur, « Squalene: A natural triterpene for use in disease management and therapy », Advanced Drug Delivery Reviews, vol. 61, no 15, , p. 1412–1426 (ISSN 1872-8294, PMID 19804806, DOI 10.1016/j.addr.2009.09.005, lire en ligne, consulté le )
- (en) Konrad E Bloch, « Sterol structure and membrane function », CRC Crit. Rev. 1983;14(1):47-92.
- EWG: Unilever takes a bite out of your face cream
- H. Kamimura, K. Fuchigami, H. Inoue et R. Kodama, « [Studies on distribution and excretion of squalane in dogs administered for 2 weeks] », Fukuoka Igaku Zasshi = Hukuoka Acta Medica, vol. 82, no 5, , p. 300–304 (ISSN 0016-254X, PMID 1916603, lire en ligne, consulté le )
- H. Kamimura, K. Fuchigami, H. Inoue et R. Kodama, « [Studies on distribution and excretion of squalane in dogs administered for 2 weeks] », Fukuoka Igaku Zasshi = Hukuoka Acta Medica, vol. 82, no 5, , p. 300–304 (ISSN 0016-254X, PMID 1916603, lire en ligne, consulté le )
- (en) « Final report on the safety assessment of squalane and squalene », Journal of the American College of Toxicology, vol. 1, no 2, , p. 37–56 (DOI 10.3109/10915818209013146, lire en ligne)
- H. Kamimura, N. Koga, K. Oguri et H. Yoshimura, « [Studies on distribution, excretion and subacute toxicity of squalane in dogs] », Fukuoka Igaku Zasshi = Hukuoka Acta Medica, vol. 80, no 5, , p. 269–280 (ISSN 0016-254X, PMID 2744688, lire en ligne, consulté le )
- Andrew Pollack. Benefit and Doubt in Vaccine Additive, The New York Times, September 21, 2009.
- Squalene-based adjuvants in vaccines,Comité consultatif mondial pour la sécurité des vaccins, OMS
- Article du Washington Post
- « GSK - Pandemic (H1N1) 2009 Influenza Update »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- [1]GlaxoSmithKline - Prepandrix: le 1er vaccin adjuvanté (H5N1) pré-pandémique
- http://www.who.int/vaccine_safety/topics/adjuvants/squalene/questions_and_answers/fr/index.html
- « http://www.novartis.com/downloads/newsroom/MF59-Adj-fact-sheet.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- http://www.sciencebasedmedicine.org/?p=851
- SÖFW Journal: Cell Toxicity of UV-A Irradiated Squalene
- New Engl J Med 360:1192
- Review of Asa, Cao & Garry (2000) (page 17)
- The Endogenous Adjuvant Squalene Can Induce a Chronic T-Cell-Mediated Arthritis in Rats, American Journal of Pathology. 2000;156:2057-2065.
- Benefit and Doubt in Vaccine Additive, Andrew Pollack, New York Times, September 21, 2009
- Antibodies to Squalene in Recipients of Anthrax Vaccine, Experimental and Molecular Pathology 73, 19–27, 2002
- (en) Asa, P. B., Cao, Y. & Garry, R. F., « Antibodies to squalene in Gulf War Syndrome », Experimental and Molecular Pathology, vol. 68, no 1, , p. 55–64 (PMID 10640454, DOI 10.1006/exmp.1999.2295, lire en ligne)
- Antibodies to squalene in Gulf War syndrome, Department of Microbiology, Tulane Medical School
- Adjuvants à base de squalène dans les vaccins sur le site de l'OMS.
- Benisek et al, 2004
- http://www.anthrax.osd.mil/resource/qna/qaAll.asp?cID=319#1107
- Asano KG, Bayne CK, Horsman KM, Buchanan MV, « Chemical composition of fingerprints for gender determination », Journal of Forensic Science, vol. 47, , p. 805–807
- M. Satoh et.al.: Induction of lupus autoantibodies by adjuvants. J Autoimmun. 2003 21(1):1-9.
- Barbro C. Carlson, Åsa M. Jansson, Anders Larsson, Anders Bucht and Johnny C. Lorentzen: The Endogenous Adjuvant Squalene Can Induce a Chronic T-Cell-Mediated Arthritis in Rats. In: American Journal of Pathology. 2000;156:2057-2065.
- Pellegrini et al, 2009 http://preview.ncbi.nlm.nih.gov/pubmed/19751689
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Squalene » (voir la liste des auteurs).
Voir aussi
Articles connexes
Liens externes
Bibliographie
- Bikul Das, The Science Behind Squalene (The Human Antioxidant), ICBR; 1ST edition, , 187 p. (ISBN 1890412953)