« Chimie minérale » : différence entre les versions
| Ligne 81 : | Ligne 81 : | ||
|consulté le=19 mars 2013 |
|consulté le=19 mars 2013 |
||
|id=connelly |
|id=connelly |
||
}}.</ref>. Aucun des éléments du groupe n'existe à l'état d'élément pur dans la nature, on ne les retrouve que sous la forme de [[composé chimique|composés]]<ref>{{ouvrage |
|||
| ⚫ | }}.</ref>. |
||
|langue=en |
|||
|prénom1=M. |
|||
|nom1=Halka |
|||
|prénom2=B. |
|||
|nom2=Nordstrom |
|||
|titre=Alkali and alkaline earth metals |
|||
|collection=Periodic Table of the Elements Set |
|||
|éditeur=Infobase Publishing |
|||
|lieu=New York (États-Unis) |
|||
|année=2010 |
|||
|pages totales=192 |
|||
|isbn=9780816073696 |
|||
|passage=xvi |
|||
|présentation en ligne=http://www.infobasepublishing.com/Bookdetail.aspx?ISBN=0816073694 |
|||
|consulté le=20 mars 2013 |
|||
|id=halka |
|||
}}.</ref>. |
|||
| ⚫ | De tous les [[Groupe du tableau périodique|groupes du tableau périodique]], les alcalins montrent de façon claire l'effet de l'augmentation de la taille et de la masse sur les propriétés chimiques et physiques<ref>{{ harvsp| Cotton | Wilkinson | 1999 | loc=chap. 3 (« The group 1 elements: Li, Na, K, Rb, Cs, Fr »), p= 92 | id=cotton }}.</ref>. Ainsi la réactivité des métaux alcalins augmente avec le [[numéro atomique]] (Z). Ceci est principalement relié au fait qu'ils peuvent facilement perdre leur unique électron situé sur la [[couche de valence]] et former ainsi des [[cations]] chargés +1, la [[configuration électronique]] du cation rejoignant celle des [[gaz rares]]<ref name=greenwood>{{ouvrage |
||
|langue=en |
|langue=en |
||
|prénom1=N. N. |
|prénom1=N. N. |
||
| Ligne 99 : | Ligne 118 : | ||
|consulté le=19 mars 2013 |
|consulté le=19 mars 2013 |
||
|id=greenwood |
|id=greenwood |
||
}}.</ref>. L'[[énergie d'ionisation]] diminue lorsque l'on descend dans le groupe, et il est donc de plus en plus facile d'éliminer l'électron de valence quand Z augmente, cet électron pouvant participer à des réactions chimiques. |
|||
Les métaux alcalins ont tendance à former presque exclusivement des [[liaisons ioniques]] avec des éléments [[Non-métal|non-métalliques]] et [[halogènes]]. On les retrouve donc principalement sous forme de [[Sel (chimie)|sels]] ou d'[[oxydes]]<ref>{{ harvsp| Halka | Nordstrom | 2010 | p= xvii | id=halka }}.</ref>. Un grand nombre de composés organo-alcalins ont pu être préparé en combinant des métaux alcalins avec divers [[Non-métal|non-métaux]]<ref name=ruhlandt>{{ouvrage |
|||
|langue=en |
|||
|prénom1=K. |
|||
|nom1=Ruhlandt-Senge |
|||
|prénom2=K. W. |
|||
|nom2=Henderson |
|||
|et al.=oui |
|||
|titre=Alkali Metal Organometallics - Structure and Bonding |
|||
|numéro d'édition=3 |
|||
|collection=Comprehensive Organometallic Chemistry |
|||
|numéro dans collection=2 |
|||
|lien éditeur=Elsevier Science |
|||
|éditeur=Elsevier Science |
|||
|année=2006 |
|||
|titre volume=Compounds of groups 1-2 and 11-12 |
|||
|pages totales=498 |
|||
|isbn=9780080445922 |
|||
|passage=1-65 |
|||
|présentation en ligne=http://www.elsevier.com/books/comprehensive-organometallic-chemistry-iii/meyer/978-0-08-044592-2 |
|||
|consulté le=20 mars 2013 |
|||
}}.</ref>. Ces composés sont des [[Base forte|bases fortes]], et ont d'importantes applications en chimie de synthèse, notamment pour la préparation de [[Composé organométallique|composés organométalliques]]<ref name=ruhlandt />{{,}}<ref name=dunitz>{{ouvrage |
|||
|langue=en |
|||
|prénom1=J. D. |
|||
|nom1=Dunitz |
|||
|directeur1=oui |
|||
|prénom2=P. |
|||
|nom2=Hemmerich |
|||
|directeur2=oui |
|||
|et al.=oui |
|||
|titre=Alkali metal complexes with organic ligands |
|||
|collection=Structure and Bonding |
|||
|numéro dans collection=16 |
|||
|lien éditeur=Springer Science+Business Media |
|||
|éditeur=Springer |
|||
|année=1973 |
|||
|pages totales=189 |
|||
|isbn=9783540064237 |
|||
|présentation en ligne=http://dx.doi.org/10.1007/BFb0004363 |
|||
|consulté le=20 mars 2013 |
|||
}}.</ref>. |
}}.</ref>. |
||
Version du 20 mars 2013 à 16:36
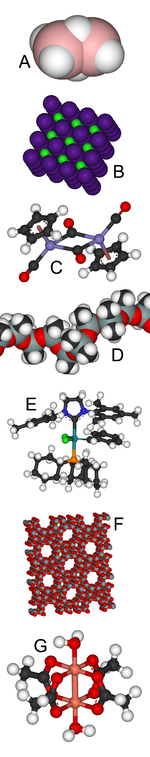
A : Le borane B2H6 est déficient en électrons.
B : Le chlorure de césium a une structure cristalline archétypique.
C : Les ferrocènes sont des complexes organométalliques.
D : Le silicone a de nombreuses utilisations dont les implants mammaires.
E : Le catalyseur de Grubbs a valu le prix Nobel de chimie à son découvreur.
F : Les zéolithes ont des structures poreuses et servent de tamis moléculaires.
G : L'acétate de cuivre (II) a surpris les théoriciens avec son diamagnétisme.
La chimie inorganique est la subdivision de la chimie qui s'intéresse à tous les composés inorganiques qui ne font pas partie par certains aspects ni de la chimie organique qui s'occupe des composés organiques, ni de la chimie minérale qui s'intéresse aux minéraux et aux métaux et leurs alliages. En particulier, les composés inorganiques peuvent être aussi moléculaires comme les objets de la chimie organique et aussi souvent comportent des atomes de non-métaux et/ou des métaux typiques de la chimie minérale. L'étude de leurs propriétés fait souvent appel à une large gamme de méthodes de physico-chimie car ils peuvent allier des propriétés typiques de la chimie organique (léger, isolant, etc.) avec des propriétés physiques habituellement liées à des composés minéraux comme conducteur, magnétique, optiquement actifs, catalyseur et même avec des composés biologiques appelés bioinorganiques, par exemple, les cœurs de l'hémoglobine, la chlorophylle, la vitamine B12 et beaucoup d'enzymes qui sont, de fait, inorganiques.
Histoire
En 1690, dans son Cours de chimie, Nicolas Lémery introduisit la distinction entre la « chimie minérale », qui ne faisait intervenir à l'époque que des composés inertes, et la chimie organique, dont les substances sont issues des animaux et des végétaux. Cette distinction, soutenue par la théorie de la force vitale, persista jusqu'au milieu du XIXe siècle. En 1828, l'expérience réalisée par le chimiste Friedrich Wöhler mit fin à cette démarcation en transformant du cyanate d'ammonium (supposé minéral), en une substance organique, l'urée.
Principes
Structure atomique
Symétrie moléculaire
Liaisons moléculaires
Composés ioniques
Liaison covalente
Acides et bases
Oxydation et réduction
Caractérisation des composés inorganiques
Chimie descriptive des éléments
Eléments du groupe principal
Hydrogène
Métaux alcalins
Les métaux alcalins sont composés des éléments chimiques de la première colonne du tableau périodique des éléments[1]. Le lithium (Li), le sodium (Na), le potassium (K), le rubidium (Rb), le césium (Cs) et le francium (Fr) font donc partie de cette famille, à l'exception notable de l'hydrogène[2]. Aucun des éléments du groupe n'existe à l'état d'élément pur dans la nature, on ne les retrouve que sous la forme de composés[3].
De tous les groupes du tableau périodique, les alcalins montrent de façon claire l'effet de l'augmentation de la taille et de la masse sur les propriétés chimiques et physiques[4]. Ainsi la réactivité des métaux alcalins augmente avec le numéro atomique (Z). Ceci est principalement relié au fait qu'ils peuvent facilement perdre leur unique électron situé sur la couche de valence et former ainsi des cations chargés +1, la configuration électronique du cation rejoignant celle des gaz rares[5]. L'énergie d'ionisation diminue lorsque l'on descend dans le groupe, et il est donc de plus en plus facile d'éliminer l'électron de valence quand Z augmente, cet électron pouvant participer à des réactions chimiques.
Les métaux alcalins ont tendance à former presque exclusivement des liaisons ioniques avec des éléments non-métalliques et halogènes. On les retrouve donc principalement sous forme de sels ou d'oxydes[6]. Un grand nombre de composés organo-alcalins ont pu être préparé en combinant des métaux alcalins avec divers non-métaux[7]. Ces composés sont des bases fortes, et ont d'importantes applications en chimie de synthèse, notamment pour la préparation de composés organométalliques[7],[8].
Métaux alcalino-terreux
Groupe 13
Groupe 14
Groupe 15
Chalcogènes
Halogènes
Gaz nobles
Métaux de transition
Première série
Deuxième et troisième séries
Lanthanides
Actinides
Catalyse
Chimie du solide et des matériaux
Nanomatériaux, nanoscience et nanotechnologie
Chimie inorganique industrielle
Chimie inorganique des systèmes biologiques
Pollution et environnement
Littérature en chimie inorganique
Livres de référence
- (en) P. W. Atkins, T. Overton et al., Inorganic chemistry, New York (États-Unis), W. H. Freeman and Company, , 5e éd., 830 p. (ISBN 9780199236176, présentation en ligne).
- (en) C. E. Housecroft et A. G. Sharpe, Inorganic chemistry, Harlow (Royaume-Uni), Prentice Hall, , 2e éd., 992 p. (ISBN 9780130399137, présentation en ligne).
- (en) P. A. Cox, Inorganic chemistry, BIOS Scientific Publishers, , 2e éd., 359 p. (ISBN 9781859962893, présentation en ligne).
- (en) K. H. Büchel, H.-H. Moretto et al., Industrial inorganic chemistry, Weinheim (Allemagne), Wiley-VCH, , 2e éd., 667 p. (ISBN 9783527298495, présentation en ligne).
- (en) F. A. Cotton, G. Wilkinson et al., Advanced inorganic chemistry, John Wiley & Sons, , 6e éd., 1376 p. (ISBN 9780471199571, présentation en ligne).
- J. E. Huheey, E. A. Keiter et al. (trad. André Pousse et Jean Fischer), Chimie inorganique [« Inorganic chemistry: Principles of structure and reactivity »], De Boeck Université, , 964 p. (ISBN 9782804121129, présentation en ligne, lire en ligne).
Publications scientifiques
Les sources primaires en chimie inorganique se résument à une quarantaine de revues scientifiques selon le Journal Citation Reports[9], auxquelles il faut ajouter une dizaine de revues généralistes en chimie, comme Angewandte Chemie, Chemical Communications, Chemical Society Reviews, Journal of the American Chemical Society ou Chemical Reviews. Quelques articles paraissent aussi chaque année dans les revues scientifiques généralistes Nature et Science. Le tableau suivant présente les principales revues scientifiques internationales spécialisées en chimie inorganique. Certaines de ces publications présentent dans chaque numéro des articles de revue, le journal Coordination Chemistry Reviews étant pour sa part entièrement consacré à ce type d'articles.
| Titre | Éditeur | Année de création | Facteur d'impact (2011) |
|---|---|---|---|
| Applied Organometallic Chemistry | John Wiley & Sons | 1987 | 2,061 |
| Coordination Chemistry Reviews | Elsevier Science | 1973 | 12,110 |
| Dalton Transactions | Royal Society of Chemistry | 1966 | 3,838 |
| European Journal of Inorganic Chemistry | John Wiley & Sons | 1998 | 3,049 |
| Inorganic Chemistry | American Chemical Society | 1962 | 4,601 |
| Inorganic Chemistry Communications | Elsevier Science | 1998 | 1,972 |
| Inorganica Chimica Acta | Elsevier Science | 1967 | 1,846 |
| Journal of Biological Inorganic Chemistry | Springer Verlag | 1996 | 3,289 |
| Journal of Inorganic Biochemistry | Elsevier Science | 1971 | 3,354 |
| Journal of Organometallic Chemistry | Elsevier Science | 1963 | 2,384 |
| Journal of Solid State Chemistry | Elsevier Science | 1969 | 2,159 |
| Organometallics | American Chemical Society | 1982 | 3,963 |
| Polyhedron | Elsevier Science | 1955 | 2,057 |
| Zeitschrift für Anorganische und Allgemeine Chemie | John Wiley & Sons | 1892 | 1,249 |
Notes et références
- (en) F. A. Cotton, G. Wilkinson et al., Advanced inorganic chemistry, John Wiley & Sons, , 6e éd., 1376 p. (ISBN 9780471199571, présentation en ligne), chap. 3 (« The group 1 elements: Li, Na, K, Rb, Cs, Fr »), p. 92.
- (en) N. G. Connelly, R. M. Hartshorn et al., Nomenclature of inorganic chemistry: IUPAC recommendations, Cambridge (Royaume-Uni), International Union of Pure and Applied Chemistry, , 377 p. (ISBN 0854044388, présentation en ligne, lire en ligne), chap. 3 (« Elements »), p. 51.
- (en) M. Halka et B. Nordstrom, Alkali and alkaline earth metals, New York (États-Unis), Infobase Publishing, coll. « Periodic Table of the Elements Set », , 192 p. (ISBN 9780816073696, présentation en ligne), xvi.
- Cotton et Wilkinson 1999, chap. 3 (« The group 1 elements: Li, Na, K, Rb, Cs, Fr »), p= 92.
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the elements, Butterworth-Heinemann, , 2e éd., 1359 p. (ISBN 9780750633659, présentation en ligne), chap. 4 (« Lithium, Sodium, Potassium, Rubidium, Caesium and Francium »), p. 76.
- Halka et Nordstrom 2010, p. xvii.
- (en) K. Ruhlandt-Senge, K. W. Henderson et al., Alkali Metal Organometallics - Structure and Bonding, Compounds of groups 1-2 and 11-12, Elsevier Science, coll. « Comprehensive Organometallic Chemistry » (no 2), , 3e éd., 498 p. (ISBN 9780080445922, présentation en ligne), p. 1-65.
- (en) J. D. Dunitz (dir.), P. Hemmerich (dir.) et al., Alkali metal complexes with organic ligands, Springer, coll. « Structure and Bonding » (no 16), , 189 p. (ISBN 9783540064237, présentation en ligne).
- « Journal Citation Reports », sur le site Thomson Reuters (consulté le ).
