« Récepteur Fc » : différence entre les versions
→Mode de fonctionnement des récepteurs : ajout info + source |
|||
| Ligne 201 : | Ligne 201 : | ||
== Mode de fonctionnement des récepteurs == |
== Mode de fonctionnement des récepteurs == |
||
Les récepteurs d'immunoglobuline Fc (FcR) sont des molécules membranaires exprimées par plusieurs cellules hématopoïétiques qui reconnaissent la région Fc de plusieurs classes et sous-classes d'immunoglobulines (Ig). On distingue le FcR pour IgG (FcγRI / CD64, FcγRII / CD32 et FcγRIII / CD16), IgE (FcϵRI), IgA (FcαRI / CD89), IgM (FcμR) et IgA / IgM (Fcα / μR). Plusieurs autres récepteurs exprimés sur différents types de cellules se lient également aux molécules d'Ig: FcR néonatal pour IgG (FcRn) sur l'épithélium intestinal, le placenta et l'endothélium, FcϵR de faible affinité (FcϵRII / CD23) sur les cellules B et les macrophages, et récepteur d'Ig polymère (pIgR) sur l'épithélium muqueux <ref>{{Article |langue=en |prénom1=Andrew |nom1=Pincetic |prénom2=Stylianos |nom2=Bournazos |prénom3=David J |nom3=DiLillo |prénom4=Jad |nom4=Maamary |titre=Type I and type II Fc receptors regulate innate and adaptive immunity |périodique=Nature Immunology |volume=15 |numéro=8 |date=2014-08 |issn=1529-2908 |issn2=1529-2916 |doi=10.1038/ni.2939 |lire en ligne=http://www.nature.com/articles/ni.2939 |consulté le=2020-05-09 |pages=707–716 }}</ref> <ref>{{Article |langue=en |prénom1=Pierre |nom1=Bruhns |prénom2=Friederike |nom2=Jönsson |titre=Mouse and human FcR effector functions |périodique=Immunological Reviews |volume=268 |numéro=1 |date=2015-11 |doi=10.1111/imr.12350 |lire en ligne=http://doi.wiley.com/10.1111/imr.12350 |consulté le=2020-05-09 |pages=25–51 }}</ref>.<ref>{{Chapitre|prénom1=Hiromi|nom1=Kubagawa|prénom2=Yoshiki|nom2=Kubagawa|prénom3=Dewitt|nom3=Jones|prénom4=Tahseen H.|nom4=Nasti|titre chapitre=The Old but New IgM Fc Receptor (FcμR)|titre ouvrage=Fc Receptors|volume=382|éditeur=Springer International Publishing|date=2014|isbn=978-3-319-07910-3|doi=10.1007/978-3-319-07911-0_1|lire en ligne=http://link.springer.com/10.1007/978-3-319-07911-0_1|consulté le=2020-05-09|passage=3–28}}</ref>La fonction des anticorps dépend d'une part de leur capacité à reconnaître les épitopes antigéniques et, d'autre part, de leur flexibilité dynamique et de leur capacité à interagir avec leurs FcR apparentés. L'engagement des FcR exprimés par les leucocytes déclenche un certain nombre de fonctions pro-inflammatoires, anti-inflammatoires et immunomodulatrices dans les réponses immunitaires adaptatives de l'hôte conduisant à une protection mais parfois aussi à une maladie.<br /> |
|||
<br /> |
|||
=== Des immunoglobulines G === |
=== Des immunoglobulines G === |
||
Version du 9 mai 2020 à 03:06
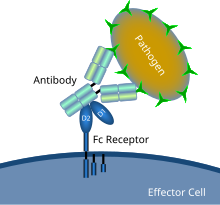
Un récepteur Fc est une protéine transmembranaire présente à la surface de certaines cellules —dont les lymphocytes B, les cellules dendritiques folliculaires, les lymphocytes NK, les macrophages, les neutrophiles, les éosinophiles, les basophiles, les thrombocytes et les mastocytes — qui contribuent aux fonctions protectrices du système immunitaire.
Son nom est dérivé de sa liaison spécifique à une partie des anticorps connue sous le nom de région Fc (Fragment cristallisable). Les récepteurs Fc se lient aux anticorps qui sont attachés aux cellules infectées ou aux pathogènes les envahissant.
Les récepteurs Fc (FcR) appartiennent à la famille des récepteurs immuns basé sur la tyrosine (ITAM) et agissent en modulant l'activité du motif ITAM pour inhiber ou activer les réponses immunitaires en fonction de leur ciblage par des immunoglobulines solubles monomères / dimères ou par des complexes immuns. Cette dualité ITAM a été récemment défini comme ITAM inhibitrice ou activatrice (ITAMi ou ITAMa) qui sont contrôlée par les kinases de la famille Src[1]
Certains virus tels que les flavivirus utilisent les récepteurs Fc pour infecter les cellules, par un mécanisme connu sous le nom de facilitation dépendante des anticorps[2].
Classes
Il existe plusieurs types de récepteurs Fc (en abrégé FcR), qui sont classés en fonction du type d'anticorps qu'ils reconnaissent. La lettre latine utilisée pour identifier un type d'anticorps est remplacée par la lettre grecque correspondante, après " Fc " pour former le nom du récepteur. Par exemple, ceux qui se lient le plus communément à la classe des anticorps IgG, sont appelés récepteurs Fc-gamma (FcyR) ; ceux qui se lient à IgA sont appelés récepteurs Fc-alpha (FcαR) et ceux qui se lient à IgE sont appelés récepteurs Fc-epsilon (FcεR). On distingue aussi les classes de FcR en fonction des cellules qui les expriment (macrophages, granulocytes, lymphocytes NK, lymphocytes B, cellules T et B) et des propriétés de signalisation de chaque récepteur[3].
On distingue aussi les classes de FcR en fonction des cellules qui les expriment (macrophages, granulocytes, lymphocytes NK, lymphocytes B, cellules T et B) et des propriétés de signalisation de chaque récepteur[4].
Récepteurs Fc-gamma
L'ensemble des récepteurs Fcγ (FcγR) appartiennent à la superfamille des immunoglobulines et les plus importants sont les récepteurs Fc induisant la phagocytose de microbes opsonisés (marqués)[5]. Cette famille comprend plusieurs membres, FcγRI (CD64), FcγRIIA (CD32), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b), qui diffèrent dans leurs affinités anticorps en raison de leur différente structure moléculaire[6]. Par exemple, FcyRI se lie à IgG plus fortement que FcγRII ou FcγRIII. FcγRI a aussi une partie extracellulaire composé de trois domaines de type immunoglobuline (Ig), soit un de plus que FcγRII ou FcγRIII. Cette propriété permet à FcγRI de se lier à une molécule isolée d'IgG (ou monomère), mais tous les récepteurs Fcγ doivent se lier à plusieurs molécules d'IgG au sein d'un complexe immunitaire pour être activés[7].
Les récepteurs Fc-gamma se distinguent par leur affinité pour les IgG et de la même manière que les différentes sous-classes d'IgG ont des affinités pour chacun des récepteurs Fc gamma. Ces interactions sont de plus régulées par le glycane (oligosaccharides) présent à la position CH2-84.4 des IgG. Par exemple, en créant un encombrement stérique, la fucose contenant des glycanes CH2-84.4 réduit l'affinité des IgG pour FcγRIIIA. En revanche, les glycanes G0, qui manquent de galactose et se terminent par des groupements GlcNAc, ont une affinité accrue pour FcγRIIIA.
Le récepteur Fcγ couvre une région chevauchant partiellement le domaine de liaison du facteur de complément C1q. Pour toutes les interactions du récepteur Fcγ, l'étirement des acides aminés comprenant l'extrémité N-terminale des domaines et des brins CH2 adjacents dans le repli d'immunoglobuline tridimensionnelle est important pour la liaison. En général, cela englobe les acides aminés 234-239, 265-269, 297-299 et 327-330 [8],[9] Cependant, chacune des sous-classes d'IgG a un profil de liaison unique à chaque récepteur Fcγ [10], et leurs profils d'expression sont très variables entre les différentes cellules immunitaires d'origine myéloïde et NK [11]. Une distinction majeure peut être faite entre les IgG1 / IgG3 qui interagissent efficacement avec la plupart des récepteur Fcγ et les IgG2 / IgG4, qui montrent une affinité réduite pour un certain nombre de récepteur Fcγ. De plus, l'IgG3 monomère se lie plus efficacement que l'IgG1 monomère à FcγRIIa, FcγRIIIa et FcγRIIIb, et l'efficacité de liaison de l'IgG3 à tous les récepteur néonatals Fcγ s dépasse celle de l'IgG1 [10]. Les déterminants structurels responsables des différences entre IgG1 et IgG3 sont encore inconnus.
Les IgG peuvent être divisées en quatre sous-classes, nommées, par ordre décroissant d'abondance IgG1, IgG2, IgG3 et IgG4 [12]
Récepteur Fc-gamma I (FcγRI)
Bien que FcγRI soit souvent considéré comme une seule entité, FcγRI se compose de trois gènes homologues sur le bras court du chromosome un [13], et plusieurs variantes d'épissage alternatives ont été décrites [14]. Cependant, seul le FcγRIa constitué de trois domaines extracellulaires a été étudiée en détail. Le gène codant pour le variant potentiel de FcγRIb, consiste potentiellement en un récepteur presque identique avec seulement les deux domaines extracellulaires Ig N-terminaux, mais conservant la partie cytoplasmique intracellulaire, tandis que FcγRIc n'aurait pas non plus de partie cytoplasmique et de région transmembranaire, et serait, par conséquent, il devrait être prévu de représenter une forme sécrétée. Le récepteur FcγRIa se lie à toutes les sous-classes d'IgG humaines à l'exception d'IgG2, et contrairement aux autres FcγR, contient son troisième domaine d'immunoglobuline membranaire proximal unique qui est également responsable de sa plus grande affinité pour les IgG [15].
Récepteur Fc-gamma IIa (FcγRIIa)
Le FcγRIIa est le FcγR le plus largement exprimé sur les cellules myéloïdes et a été décrit comme le seul FcγR avec une liaison significative aux IgG2 [16].[17],[18],[19] La liaison est plus efficace pour la variante 131H («faible réponse», LR) que la variante 131R («haute réponse», HR) [17] . L'affinité de liaison varie selon les sous-classes comme suit: IgG3> IgG1> IgG4 = IgG2.
Récepteur Fc-gamma IIb/IIc (FcγRIIb/IIc)
Le domaine extracellulaire du FcγRIIb inhibiteur est identique au FcγRIIc activateur qui est exprimé chez ~ 11% des individus [20],[21]. La liaison au récepteur inhibiteur FcyRIIb ou IIc est faible pour toutes les sous-classes, préférant généralement IgG3 = IgG1 = IgG4> IgG2. Fait intéressant, les constantes de dissociation pour la liaison des IgG1 et IgG3 monomères sont similaires, mais les complexes immuns des IgG3 semblent se lier plus efficacement par rapport aux IgG1 [17] . La liaison à la plupart des FcRns activateurs est plus faible pour l'IgG4 que pour l'IgG1, mais ce n'est pas le cas pour le récepteur inhibiteur FcγRIIb. Cet équilibre modifié entre la liaison aux récepteurs activateurs par rapport aux récepteurs inhibiteurs peut être une caractéristique importante de l'IgG4 qui contribue à sa faible capacité pro-inflammatoire.
Récepteur Fc-gamma IIIa (FcγRIIIa)
Il existe deux variantes allotypiques de FcγRIIIa: F158 et V158. La variante V158 a une plus grande affinité pour toutes les sous-classes, et pour l'IgG3, l'efficacité de liaison approche celle de FcyRIa[17], avec des affinités générales suivant IgG3> IgG1>> IgG4> IgG2. En plus de changer les acides aminés 233–236 d'IgG1 en équivalents d'IgG2, A327G (Alanine présent dans IgG1 et IgG3, Glycine dans IgG2 et IgG4) entraîne également une diminution de la liaison [22].
Récepteur Fc-gamma IIIb (FcγRIIIb)
Il existe des variations allotypiques fonctionnelles des FcγRIIIb des neutrophiles , appelés antigène 1 des neutrophiles humains (NA1 / HNA1a) et (NA2 / HNA1b) (162). La forme FcγRIIIb-NA1 est capable de mieux ingérer des particules opsonisées IgG1 ou IgG3 que RIIIb-NA2 [23]. Le FcγRIIIb se lie généralement aux IgG1 et IgG3 mais pas aux IgG2 et IgG4, les IgG3 se liant mieux que les IgG1 [17]. Une structure cristalline du complexe d'IgG1 Fc avec FcγRIIIb révèle que les acides aminés 234-238 sont d'importants résidus de contact, et la variation spécifique à la sous-classe dans ce domaine peut à nouveau expliquer le manque de liaison des IgG2 et IgG4 à ce récepteur [24],[25]
Récepteur Fc-gamma néonatal (FcγRn)
Dans les années 1960, l'existence d'un récepteur responsable de la demi-vie inhabituellement longue des IgG (3 semaines) et d'un transport efficace de ces IgG de la mère à l'enfant a d'abord été proposée[26].[27] Cela a été confirmé par la suite par divers groupes et finalement cloné et identifié comme le FcRn néonatal[28] [29].
Le FcRn est étonnamment similaire aux molécules du CMH de classe I[30],[31]. Comme le MHC classe I et d'autres molécules de type MCH classe I, le FcRn est co-exprimé avec la microglobuline non glycosylée β2 12 kD, codée sur le chromosome 15. La chaîne α du FcRn humain, une chaîne polypeptidique de 45 kD, est codé sur le chromosome 19 à un locus hébergeant divers autres récepteurs immunitaires (par exemple, KIR, LAIR-1, CD89, CEACAM). Le FcRn humain n'a qu'un seul site de glycosylation potentiel (N102). Il est situé sur la face opposée au site de liaison aux IgG et est également partagé avec celui de toutes les séquences connues de FcRn . FcRn ne lie pas son ligand à pH physiologique (7,4). Ce n'est que dans l'environnement acide des vacuoles endocytaires (pH ≤ 6,5) [32]. [33] [34]Les résidus d'histidine dans la partie Fc des IgG (interface CH2-CH3) sont essentiels pour la liaison de haute affinité aux résidus dans la chaîne α β2M et FcRn [35].[36] H435 se trouve au cœur de cette interface. Par conséquent, l'IgG3 a une demi-vie normale de 3 semaines et est transportée efficacement à travers le placenta chez les individus contenant des allotypes d'IgG3 contenant H435 [37],[38].
Le fait que le FcRn protège les IgG de la dégradation a été confirmé par des modèles murins : la demi-vie des IgG est diminuée chez les souris déficientes en FcRn ou en β2-microglobuline[39],[40],[41],[42]. Le recyclage induit par le FcRn permet de conserver quatre fois plus d'IgG que ce qui est produit[43]. Bien qu'il ait été initialement proposé que l'expression de FcRn sur les cellules endothéliales soit responsable du recyclage des IgG [44], des études ultérieures ont montré que la forte expression de FcRn sur les cellules myéloïdes contribue également à l'extension de la demi-vie chez la souris[45]. De même, la surexpression de FcRn chez les animaux transgéniques entraîne des taux sériques d'IgG plus élevés [46].
Cependant, le FcRn commence sa fonction tôt dans la vie par le transport des IgG - et donc l'immunité humorale - à travers le placenta de la mère à l'enfant [41],[47],[48] [49] et chez les rongeurs également après la naissance par le transport du lait maternel dans l'intestin des nouveaux-nés allaités. Chez le rat, cette expression de FcRn est régulée à la baisse dans l'intestin grêle, ce qui est en corrélation avec la dégradation des IgG dans ces cellules[50].
Rôle des récepteurs Fc-gamma néonatals chez l'adulte
Chez l'adulte, le FcRn est exprimé sur de nombreuses cellules épithéliales et continue de fonctionner dans le transport des IgG à travers les barrières épithéliales d'expression du FcRn [51]. Le FcRn est capable (chez toutes les espèces) de transiter de façon bidirectionnelle à travers les cellules polarisées (épithéliales et endothéliales), mais la direction du transport net dépend du tissu [52],[53],[54].Les complexes d'immunoglobulines G ou d'IgG-antigènes sont transportés à travers les surfaces muqueuses, telles que la cavité intestinale ou l'épithélium respiratoire, et fonctionnaient ainsi dans la surveillance immunitaire [47],[51],[55]. Avec ce rôle dans l'immunité muqueuse, il complète sIgA dans la fonction immunorégulatrice [56].
Comme les IgG peuvent transporter des protéines fonctionnelles à travers les barrières épithéliales, cela offre de nouvelles possibilités au FcRn en tant que récepteur endogène pour transporter les protéines ou les antigènes vaccinaux à travers des surfaces épithéliales[51].
Sur les cellules muqueuses, le FcRn s'est révélé transporter les IgG et être impliqué dans l'échantillonnage des antigènes [47],[51],[55]), et son expression sur les cellules phagocytaires [57] s'est récemment révélée améliorer la capacité de phagocytose des particules opsonisées par les IgG [58],[59]. Sur les cellules présentant l'antigène, cette ingestion de complexes IgG peut conduire à une présentation améliorée [60],[61],[62]. Semblable aux réponses de phagocytose, la présentation améliorée nécessite probablement la détection externe et l'activation cellulaire via le FcγR et les récepteurs de reconnaissance de formes, reconnaissant le complexe d'IgG-antigène au FcRn à faible pH [59],[60],[63]. Ainsi, les activités d'immunoglobulines, y compris la demi-vie prolongée, le transport et l'échantillonnage des antigènes, semblent être orchestrées via un seul récepteur, le FcRn de type I du CMH. En revanche, d'autres fonctions effectrices des IgG, telles que la phagocytose et la présentation de l'antigène semblent être médiées à la fois par le FcRn et les FcγR classiques.
Récepteurs Fc- alpha
Un seul récepteur Fc appartient au sous-groupe Fcα , il s'agit de FcαRI (ou CD89)[64]. FcαRI se trouve sur la surface des neutrophiles, des éosinophiles, monocytes, de certains macrophages (y compris les cellules de Kupffer), et de quelques cellules dendritiques. Il est composé de deux domaines extracellulaire de type Ig, et fait partie à la fois de la superfamille des immunoglobulines et de la famille des récepteurs de reconnaissance immunitaire multi-chaîne (MIRR). Il signale en s'associant avec deux FcRy de signalisation des chaînes. Un autre récepteur peut également se lier aux IgA, même s'il a une plus grande affinité pour un autre anticorps, l'immunoglobuline M[65]. Ce récepteur est appelé récepteur Fc-alpha/mu (Fcα/µR) et est un type I de protéine transmembranaire. Avec un domaine de type Ig dans sa partie extracellulaire, ce récepteur Fc est également un membre de la superfamille des immunoglobulines[66].
Récepteurs Fc-epsilon
Deux types de FcεR sont connus :
- Le récepteur FcεRI de forte affinité est un membre de la superfamille des immunoglobulines (il a deux domaines de type Ig). On trouve FcεRI sur les cellules de Langerhans épidermiques, les éosinophiles, les mastocytes et les basophiles[67],[68] En raison de sa distribution cellulaire, ce récepteur joue un rôle majeur dans le contrôle des réactions allergiques. FcεRI est également exprimé sur les cellules présentatrices de l'antigène, et contrôle la production d'importants médiateurs immunitaires appelées cytokines qui favorisent l'inflammation[69].
- le récepteur de faible affinité FcεRII (CD23) est une lectine de type C. FcεRII a de multiples fonctions qu'il soit lié à la membrane ou comme récepteur soluble ; il contrôle la croissance et la différenciation des cellules B et bloque la liaison IgE des éosinophiles, monocytes et des basophiles[70].
Tableau récapitulatif
| Nom du récepteur | Principal ligand anticorps | Affinité pour le ligand | Cellules concernées | Effet résultant de la liaison aux anticorps |
| Récepteur Fc des immunoglobulines G | ||||
| FcγRI (CD64) | IgG1 et IgG3 | Forte (Kd ~ 10−9 M) | Macrophages |
Phagocytose Activation cellulaire |
| FcγRIIA (CD32) | IgG | Faible (Kd > 10−7 M) | Macrophages Neutrophiles |
Phagocytose Dégranulation (eosinophiles) |
| FcγRIIB1 (CD32) | IgG | Faible(Kd > 10−7 M) | Lymphocyte B |
Absence de phagocytose Inhibition de l'activité cellulaire |
| FcγRIIB2 (CD32) | IgG | Faible (Kd > 10−7 M) | Macrophages Neutrophiles |
Phagocytose Inhibition de l'activité cellulaire |
| FcγRIIIA (CD16a) | IgG | Faible (Kd > 10−6 M) | NK cells Macrophages (certain tissues) |
Induction de la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) Induction de la libération de cytokine release par les macrophages |
| FcγRIIIB (CD16b) | IgG | Faible (Kd > 10−6 M) | Eosinophiles Macrophages |
Induction de la lyse microbienne |
| Récepteur Fc des immunoglobulines E | ||||
| FcεRI | IgE | Forte (Kd ~ 10−10 M) | Blastocytes Eosinophiles |
Degranulation Phagocytose |
| FcεRII (CD23) | IgE | Faible (Kd > 10−7 M) | Leucocytes B Eosinophiles |
Possible adhésion moléculaire transport d'IgE à travers l'épithelium intestinal |
| Récepteur Fc des immunoglobulines A | ||||
| FcαRI (CD89) | IgA | Faible (Kd > 10−6 M) | Monocytes Macrophages |
Phagocytose Induction de la lyse microbienne |
| Fcα/μR | IgA et IgM | Forte pour IgM, Moyenne pour IgA | Lymphocytes B Cellules mésangiales |
Endocytose Induction de la lyse microbienne |
| Récepteur Fc néonatal | ||||
| FcRn | IgG | Monocytes Macrophages |
Transfère les IgG de la mère au fœtus via le placenta Transfère les IgG de la mère à l'enfant par le lait | |
Fonctions
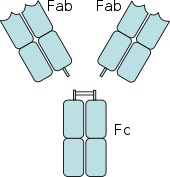
Les récepteurs Fc sont présents sur nombre de cellules du système immunitaire, dont les phagocytes tels que macrophages et monocytes ; les granulocytes tels que neutrophiles, éosinophiles et lymphocytes du système immunitaire inné (lymphocytes NK) ou du système immunitaire adaptatif (par exemple, lymphocytes B)[71],[72],[73]. Ils permettent à ces cellules de se lier aux anticorps qui sont attachés à la surface des microbes ou aux microbes de cellules infectées, en aidant ces cellules à identifier et à éliminer les microbes pathogènes. Les récepteurs Fc lient les anticorps à leur région Fc, une interaction qui active la cellule possédant le récepteur Fc[74]. L'activation des phagocytes est la fonction la plus communément attribuée aux récepteurs Fc. Par exemple, les macrophages commencent à ingérer et à tuer les agents pathogènes enveloppés d'IgG en les phagocytant quand ils se sont liés à leurs récepteurs Fcy[75]. Leur activité stimule la destruction des microbes par des cellules phagocytes ou cytotoxiques, ou celle des cellules infectées par phagocytose ou cytotoxicité à médiation cellulaire dépendante des anticorps. Ils jouent un rôle essentiel dans la modulation de la réponse immunitaire humorale et innée.par le mécanisme d'opsonisation pour les cellules phagocytaires et sur l'action cytotoxique des cellules NK tueuses nommée cytotoxicité à médiation cellulaire dépendante des anticorps.
Un autre processus impliquant les récepteurs Fc est appelé cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC). Au cours de l'ADCC, les récepteurs FcγRIII présents sur la surface des lymphocytes NK stimulent la libération de molécules cytotoxiques à partir de leurs granules par les cellules NK, pour tuer les cellules cibles couvertes d'anticorps[76].
FcRI a une fonction différente. FceRI est le récepteur Fc des granulocytes, qui est impliqué dans les réactions allergiques et de défense contre les parasites infectieux. Lorsqu'un certain allergique de l'antigène ou du parasite est présent, la réticulation d'au moins deux des IgE des molécules et de leurs récepteurs Fc sur la surface des granulocytes va activer les cellules pour libérer rapidement les médiateurs préformés de ses granules.
Mode de fonctionnement des récepteurs
Les récepteurs d'immunoglobuline Fc (FcR) sont des molécules membranaires exprimées par plusieurs cellules hématopoïétiques qui reconnaissent la région Fc de plusieurs classes et sous-classes d'immunoglobulines (Ig). On distingue le FcR pour IgG (FcγRI / CD64, FcγRII / CD32 et FcγRIII / CD16), IgE (FcϵRI), IgA (FcαRI / CD89), IgM (FcμR) et IgA / IgM (Fcα / μR). Plusieurs autres récepteurs exprimés sur différents types de cellules se lient également aux molécules d'Ig: FcR néonatal pour IgG (FcRn) sur l'épithélium intestinal, le placenta et l'endothélium, FcϵR de faible affinité (FcϵRII / CD23) sur les cellules B et les macrophages, et récepteur d'Ig polymère (pIgR) sur l'épithélium muqueux [77] [78].[79]La fonction des anticorps dépend d'une part de leur capacité à reconnaître les épitopes antigéniques et, d'autre part, de leur flexibilité dynamique et de leur capacité à interagir avec leurs FcR apparentés. L'engagement des FcR exprimés par les leucocytes déclenche un certain nombre de fonctions pro-inflammatoires, anti-inflammatoires et immunomodulatrices dans les réponses immunitaires adaptatives de l'hôte conduisant à une protection mais parfois aussi à une maladie.
Des immunoglobulines G
Activation
Les récepteurs Fc gamma générent des signaux à l'intérieur de leurs cellules via un important motif d'activation appelé Motif d’activation des récepteurs immuns basé sur la tyrosine (ITAM)[80]. Un ITAM est une séquence spécifique d'acides aminés (YXXL) apparaissant deux fois de façon rapprochée dans la queue intracellulaire d'un récepteur. Lorsque des groupes phosphate sont ajoutés à des résidus de tyrosine (Y) de l'ITAM par des enzymes appelées tyrosine kinases, une cascade de signalisation est générée à l'intérieur de la cellule. Cette réaction de phosphorylation suit généralement l'interaction d'un récepteur Fc avec son ligand. Un ITAM est présent dans la queue intracellulaire de FcyRIIA, et sa phosphorylation induit la phagocytose des macrophages. FcyRI et FcyRIIIA n'ont pas d'ITAM mais peuvent transmettre une activation du signal à leurs phagocytes par l'intermédiaire d'une autre protéine. Cette protéine adaptatrice est appelée sous-unité Fcy et, comme FcyRIIA, contient les deux séquences YXXL qui sont caractéristiques d'un ITAM.
Inhibition
La présence d'un seul motif YXXL n'est pas suffisante pour activer les cellules, et représente un motif (I/VXXYXXL) connu comme motif d’inhibition des récepteurs immuns basé sur la tyrosine (ITIM). FcγRIIB1 et FcγRIIB2 présentent des séquences ITIM et sont des inhibiteurs des récepteurs Fc ; ils n'induisent pas de phagocytose. L'action inhibitrice de ces récepteurs est contrôlée par des enzymes qui éliminent les groupes de phosphates à partir de résidus de tyrosine; les phosphatases PTPN6 (en) et INPP5D (en) inhibent la signalisation par les récepteurs Fcγ[81]. La liaison du ligand à FcγRIIB conduit à la phosphorylation de la tyrosine du motif ITAM . Cette modification génère un site de liaison de la phosphatase, un domaine de reconnaissance SH2. L'arrêt du signal d'activation de l'ITAM est causé par l'inhibition des protéines tyrosine kinases de la famille Src, et par hydrolyse de la membrane PIP3, qui interrompt la signalisation aval par les récepteurs d'activation, telles que l'activation par FcγRs, TCR, BCR et les récepteurs de cytokines (par exemple, c-Kit)[82].
La signalisation négative par FcγRIIB est surtout importante pour la régulation des lymphocytes B activés. La signalisation positive des lymphocytes B est initiée par la liaison de l'antigène étranger à la surface des immunoglobulines. Le même anticorps spécifique à l'antigène est sécrété et il peut le supprimer or déclencher un signal négatif. Ce signal négatif est fourni par FcγRIIB[83] : ((en)) Experiments using B cell deletion mutants and dominant-negative enzymes⇔des expériences utilisant des mutations de cellules et des enzymes à dominant négatif ont établi le rôle important dans la signalisation négative du domaine SH2 contenant de l'inositol 5-phosphatase (SHIP). La signalisation négative par SHIP semble inhiber la voie de signalisation Ras par le biais d'une concurrence entre le domaine SH2 et les Grb2 et Shc ; elle peut impliquer la consommation de médiateurs lipides intracellulaires qui agissent comme activateurs d'enzymes allostériques ou qui favorisent l'entrée du Ca2+ extracellulaire[84].
Des immunoglobulines A et M
Activation cellulaire
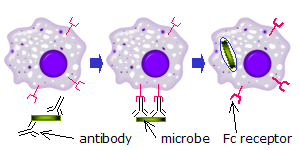
Sur les phagocytes
Lorsque des molécules d'IgG, spécifiques à un antigène ou à des composants membranaires donnés, se lient à l'agent pathogène dans leurs régions Fab (fragment antigen binding région), leurs régions Fc pointent vers l'extérieur, à portée immédiate des phagocytes. Les phagocytes lient ces régions Fc régions avec leurs récepteurs Fc. De nombreuses interactions de faible affinité se produisent entre les récepteurs et les anticorps qui travaillent ensemble pour se lier fermement aux microbes enveloppés d'anticorps. La faible affinité individuelle empêche les récepteurs Fc de se lier aux anticorps en l'absence d'antigène, et, par conséquent, réduit la probabilité de l'activation des cellules immunitaires en l'absence d'infection. Cela empêche également l'agglutination des phagocytess par des anticorps lorsqu'il n'y a pas d'antigène. Après qu'un agent pathogène a été lié, les interactions entre la région Fc de l'anticorps et les récepteurs Fc des phagocytes provoquent l'initiation de le phagocytose. L'agent pathogène est englouti par les phagocytes par un processus actif impliquant la liaison et la libération du complexe région Fc/récepteur Fc, jusqu'à ce que la membrane cellulaire de la phagocyte recouvre entièrement l'agent pathogène[85].
Sur les lymphocytes NK
Les récepteurs Fc sur les cellules NK qui reconnaissent les IgG liées à la membrane d'une cellule-cible infectée par un agent pathogène sont appelées CD16 ou FcγRIII[86]. L'activation de FcγRIII par les IgG provoque la libération de cytokines telles que l'IFN-γ qui envoie des signaux à d'autres cellules immunitaires et médiateurs cytotoxiques comme la perforine et le granzyme, lesquelles entrent dans la cellule cible et déclenchent la mort cellulaire par apoptose. Ce processus est connu sous le nom de Cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC). Les récepteurs FcγRIII présents sur les cellules NK peuvent également être associés avec des IgG monomères (c'est-à-dire des IgG non liées à des antigènes). Lorsque cela se produit, le récepteur Fc inhibe l'activité des lymphocytes NK[87].
Sur les mastocytes

Les anticorps IgE se lient aux antigènes des allergènes. Ces allergènes liés à des molécules d'IgE interagissent avec les récepteurs Fcε à la surface des mastocytes. L'activation des mastocytes après l'engagement de FcεRI provoque un processus appelé la dégranulation, dans lequel les mastocytes libèrent des molécules préformées à partir de leurs granules cytoplasmiques. Celles-ci sont un mélange de composés incluant histamine, protéoglycanes, et protéases à sérine[88] Les mastocytes activés synthétisent et sécrétent aussi des médiateurs lipidiques (tels que prostaglandine, leucotriène, et platelet-activating factor) et des cytokines (interleukine 1, interleukine 3, interleukine 4, interleukine 5, interleukine 6, interleukine 13, facteur de nécrose tumorale-alpha, GM-CSF, et plusieurs chimiokines[89],[90].. Ces médiateurs contribuent à l'inflammation en attirant d'autres leucocytes.
Sur les éosinophiles
Les gros parasites comme les helminthes (vers) Schistosoma mansoni sont trop grands pour être ingérés par les phagocytes. Ils ont aussi une structure externe appelé tégument qui est résistant à l'attaque par des substances libérées par les macrophages et les mastocytes. Cependant, ces parasites peuvent être recouverts par des IgE et reconnus par FcεRI sur la surface des éosinophiles. Les éosinophiles activés libérent des médiateurs préformés comme la protéine basique majeure, et des enzymes telles que la peroxydase, contre qui les helminthes ne sont pas résistants[91],[92]. L'interaction de la FcεRI récepteur avec la portion Fc des helminthes lié IgE entraîne la libération par les éosinophiles de ces molécules dans un mécanisme similaire à celui des cellules NK au cours de l'ADCC[93].
Récepteur Fc et maladie
Utilisation thérapeutique des récepteurs Fc
Articles annexes
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Receptor Fc » (voir la liste des auteurs).
- (en) Sanae Ben Mkaddem, Amaya Murua, Héloise Flament et Dimitri Titeca-Beauport, « Lyn and Fyn function as molecular switches that control immunoreceptors to direct homeostasis or inflammation », Nature Communications, vol. 8, no 1, , p. 246 (ISSN 2041-1723, PMID 28811476, PMCID PMC5557797, DOI 10.1038/s41467-017-00294-0, lire en ligne, consulté le )
- R. Anderson, « Manipulation of cell surface macromolecules by flaviviruses », Advances in Virus Research, vol. 159, , p. 229–74 (PMID 14696331, DOI 10.1016/S0065-3527(03)59007-8)
- Judith Owen, Jenni Punt, Sharon Stranford et Patricia Jones, Immunology, New York, W.H. Freeman and Company, , 7e éd. (ISBN 978-14641-3784-6), p. 423
- Judith Owen, Jenni Punt, Sharon Stranford et Patricia Jones, Immunology, New York, W.H. Freeman and Company, , 7e éd. (ISBN 978-14641-3784-6), p. 423
- W. H. Fridman, « Fc receptors and immunoglobulin binding factors », FASEB Journal, vol. 5, no 12, , p. 2684–90 (PMID 1916092)
- Z. K. Indik, J. G. Park, S. Hunter et A. D. Schreiber, « The molecular dissection of Fc gamma receptor mediated phagocytosis », Blood, vol. 86, no 12, , p. 4389–99 (PMID 8541526)
- P. T. Harrison, W. Davis, J. C. Norman, A. R. Hockaday et J. M. Allen, « Binding of monomeric immunoglobulin G triggers Fc gamma RI-mediated endocytosis », The Journal of Biological Chemistry, vol. 269, no 39, , p. 24396–402 (PMID 7929100)
- (en) Peter Sondermann, Robert Huber, Vaughan Oosthuizen et Uwe Jacob, « The 3.2-Å crystal structure of the human IgG1 Fc fragment–FcγRIII complex », Nature, vol. 406, no 6793, , p. 267–273 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/35018508, lire en ligne, consulté le )
- (en) Paul A. Ramsland, William Farrugia, Tessa M. Bradford et Caroline Tan Sardjono, « Structural Basis for FcγRIIa Recognition of Human IgG and Formation of Inflammatory Signaling Complexes », The Journal of Immunology, vol. 187, no 6, , p. 3208–3217 (ISSN 0022-1767 et 1550-6606, PMID 21856937, PMCID PMC3282893, DOI 10.4049/jimmunol.1101467, lire en ligne, consulté le )
- Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nommées:2 - (en) Martin Guilliams, Pierre Bruhns, Yvan Saeys et Hamida Hammad, « The function of Fcγ receptors in dendritic cells and macrophages », Nature Reviews Immunology, vol. 14, no 2, , p. 94–108 (ISSN 1474-1733 et 1474-1741, DOI 10.1038/nri3582, lire en ligne, consulté le )
- Schur PH. IgG subclasses. A historical perspective. Monogr Allergy (1988) 23:1–11.
- Ernst LK, van de Winkel JG, Chiu IM, Anderson CL. Three genes for the human high affinity Fc receptor for IgG (Fc gamma RI) encode four distinct transcription products. J Biol Chem (1992) 267(22):15692–700.
- (en) L.K. Ernst, A.-m. Duchemin, K.L. Miller et C.L. anderson, « Molecular characterization of six variant Fc », Molecular Immunology, vol. 35, nos 14-15, , p. 943–954 (DOI 10.1016/S0161-5890(98)00079-0, lire en ligne, consulté le )
- (en) Mark D Hulett et P.Mark Hogarth, « The second and third extracellular domains of Fc γ RI (CD64) confer the unique high affinity binding of IgG2a », Molecular Immunology, vol. 35, nos 14-15, , p. 989–996 (DOI 10.1016/S0161-5890(98)00069-8, lire en ligne, consulté le )
- (en) Pierre Bruhns, Bruno Iannascoli, Patrick England et David A. Mancardi, « Specificity and affinity of human Fcγ receptors and their polymorphic variants for human IgG subclasses », Blood, vol. 113, no 16, , p. 3716–3725 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2008-09-179754, lire en ligne, consulté le )
- (en) P W Parren, P A Warmerdam, L C Boeije et J Arts, « On the interaction of IgG subclasses with the low affinity Fc gamma RIIa (CD32) on human monocytes, neutrophils, and platelets. Analysis of a functional polymorphism to human IgG2. », Journal of Clinical Investigation, vol. 90, no 4, , p. 1537–1546 (ISSN 0021-9738, PMID 1401085, PMCID PMC443201, DOI 10.1172/JCI116022, lire en ligne, consulté le )
- (en) Kathryn L. Armour, Jan G.J. van de Winkel, Lorna M. Williamson et Mike R. Clark, « Differential binding to human FcγRIIa and FcγRIIb receptors by human IgG wildtype and mutant antibodies », Molecular Immunology, vol. 40, no 9, , p. 585–593 (DOI 10.1016/j.molimm.2003.08.004, lire en ligne, consulté le )
- (en) Bruce D. Wines, Maree S. Powell, Paul W. H. I. Parren et Nadine Barnes, « The IgG Fc Contains Distinct Fc Receptor (FcR) Binding Sites: The Leukocyte Receptors FcγRI and FcγRIIa Bind to a Region in the Fc Distinct from That Recognized by Neonatal FcR and Protein A », The Journal of Immunology, vol. 164, no 10, , p. 5313–5318 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.164.10.5313, lire en ligne, consulté le )
- (en) Joris van der Heijden, Willemijn B. Breunis, Judy Geissler et Martin de Boer, « Phenotypic Variation in IgG Receptors by Nonclassical FCGR2C Alleles », The Journal of Immunology, vol. 188, no 3, , p. 1318–1324 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.1003945, lire en ligne, consulté le )
- (en) Willemijn B. Breunis, Edwin van Mirre, Marrie Bruin et Judy Geissler, « Copy number variation of the activating FCGR2C gene predisposes to idiopathic thrombocytopenic purpura », Blood, vol. 111, no 3, , p. 1029–1038 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2007-03-079913, lire en ligne, consulté le )
- Huizinga TW, Kerst M, Nuyens JH, Vlug A, von dem Borne AE, Roos D, et al. Binding characteristics of dimeric IgG subclass complexes to human neutrophils. J Immunol (1989) 142(7):2359–64.
- (en) Sergei Radaev, Shawn Motyka, Wolf-Herman Fridman et Catherine Sautes-Fridman, « The Structure of a Human Type III Fcγ Receptor in Complex with Fc », Journal of Biological Chemistry, vol. 276, no 19, , p. 16469–16477 (ISSN 0021-9258 et 1083-351X, DOI 10.1074/jbc.M100350200, lire en ligne, consulté le )
- (en) Peter Sondermann, Robert Huber, Vaughan Oosthuizen et Uwe Jacob, « The 3.2-Å crystal structure of the human IgG1 Fc fragment–FcγRIII complex », Nature, vol. 406, no 6793, , p. 267–273 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/35018508, lire en ligne, consulté le )
- (en) F. W. R. Brambell, W. A. Hemmings et I. G. Morris, « A Theoretical Model of γ-Globulin Catabolism », Nature, vol. 203, no 4952, , p. 1352–1355 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/2031352a0, lire en ligne, consulté le )
- (en) F.W.Rogers Brambell, « THE TRANSMISSION OF IMMUNITY FROM MOTHER TO YOUNG AND THE CATABOLISM OF IMMUNOGLOBULINS », The Lancet, vol. 288, no 7473, , p. 1087–1093 (DOI 10.1016/S0140-6736(66)92190-8, lire en ligne, consulté le )
- (en) Victor Ghetie, James G. Hubbard, Jin-Kyoo Kim et May-Fang Tsen, « Abnormally short serum half-lives of IgG in β2-microglobulin-deficient mice », European Journal of Immunology, vol. 26, no 3, , p. 690–696 (DOI 10.1002/eji.1830260327, lire en ligne, consulté le )
- (en) E. J. Israel, D. F. Wilsker, K. C. Hayes et D. Schoenfeld, « Increased clearance of IgG in mice that lack β 2 ‐microglobulin: possible protective role of FcRn », Immunology, vol. 89, no 4, , p. 573–578 (ISSN 0019-2805 et 1365-2567, PMID 9014824, PMCID PMC1456584, DOI 10.1046/j.1365-2567.1996.d01-775.x, lire en ligne, consulté le )
- (en) Anthony P. West et Pamela J. Bjorkman, « Crystal Structure and Immunoglobulin G Binding Properties of the Human Major Histocompatibility Complex-Related Fc Receptor † , ‡ », Biochemistry, vol. 39, no 32, , p. 9698–9708 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi000749m, lire en ligne, consulté le )
- (en) Wilhelm P. Burmeister, Andrew H. Huber et Pamela J. Bjorkman, « Crystal structure of the complex of rat neonatal Fc receptor with Fc », Nature, vol. 372, no 6504, , p. 379–383 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/372379a0, lire en ligne, consulté le )
- (en) Derry C. Roopenian, Gregory J. Christianson, Thomas J. Sproule et Aaron C. Brown, « The MHC Class I-Like IgG Receptor Controls Perinatal IgG Transport, IgG Homeostasis, and Fate of IgG-Fc-Coupled Drugs », The Journal of Immunology, vol. 170, no 7, , p. 3528–3533 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.170.7.3528, lire en ligne, consulté le )
- (en) Chaity Chaudhury, Samina Mehnaz, John M. Robinson et William L. Hayton, « The Major Histocompatibility Complex–related Fc Receptor for IgG (FcRn) Binds Albumin and Prolongs Its Lifespan », Journal of Experimental Medicine, vol. 197, no 3, , p. 315–322 (ISSN 1540-9538 et 0022-1007, PMID 12566415, PMCID PMC2193842, DOI 10.1084/jem.20021829, lire en ligne, consulté le )
- (en) L. N. Gastinel, N. E. Simister et P. J. Bjorkman, « Expression and crystallization of a soluble and functional form of an Fc receptor related to class I histocompatibility molecules. », Proceedings of the National Academy of Sciences, vol. 89, no 2, , p. 638–642 (ISSN 0027-8424 et 1091-6490, PMID 1530991, PMCID PMC48294, DOI 10.1073/pnas.89.2.638, lire en ligne, consulté le )
- (en) P. Sondermann, A. Pincetic, J. Maamary et K. Lammens, « General mechanism for modulating immunoglobulin effector function », Proceedings of the National Academy of Sciences, vol. 110, no 24, , p. 9868–9872 (ISSN 0027-8424 et 1091-6490, PMID 23697368, PMCID PMC3683708, DOI 10.1073/pnas.1307864110, lire en ligne, consulté le )
- (en) Anthony P. West et Pamela J. Bjorkman, « Crystal Structure and Immunoglobulin G Binding Properties of the Human Major Histocompatibility Complex-Related Fc Receptor † , ‡ », Biochemistry, vol. 39, no 32, , p. 9698–9708 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi000749m, lire en ligne, consulté le )
- (en) Nigel M. Stapleton, Jan Terje Andersen, Annette M. Stemerding et Stefania P. Bjarnarson, « Competition for FcRn-mediated transport gives rise to short half-life of human IgG3 and offers therapeutic potential », Nature Communications, vol. 2, no 1, , p. 599 (ISSN 2041-1723, PMID 22186895, PMCID PMC3247843, DOI 10.1038/ncomms1608, lire en ligne, consulté le )
- (en) Helga Einarsdottir, Yanli Ji, Remco Visser et Chunyan Mo, « H435-containing immunoglobulin G3 allotypes are transported efficiently across the human placenta: implications for alloantibody-mediated diseases of the newborn: Placental Transport of IgG3 », Transfusion, vol. 54, no 3, , p. 665–671 (DOI 10.1111/trf.12334, lire en ligne, consulté le )
- (en) Victor Ghetie, James G. Hubbard, Jin-Kyoo Kim et May-Fang Tsen, « Abnormally short serum half-lives of IgG in β2-microglobulin-deficient mice », European Journal of Immunology, vol. 26, no 3, , p. 690–696 (DOI 10.1002/eji.1830260327, lire en ligne, consulté le )
- (en) E. J. Israel, D. F. Wilsker, K. C. Hayes et D. Schoenfeld, « Increased clearance of IgG in mice that lack β 2 ‐microglobulin: possible protective role of FcRn », Immunology, vol. 89, no 4, , p. 573–578 (ISSN 0019-2805 et 1365-2567, PMID 9014824, PMCID PMC1456584, DOI 10.1046/j.1365-2567.1996.d01-775.x, lire en ligne, consulté le )
- (en) R. P. Junghans et C. L. Anderson, « The protection receptor for IgG catabolism is the beta2-microglobulin-containing neonatal intestinal transport receptor. », Proceedings of the National Academy of Sciences, vol. 93, no 11, , p. 5512–5516 (ISSN 0027-8424 et 1091-6490, PMID 8643606, PMCID PMC39277, DOI 10.1073/pnas.93.11.5512, lire en ligne, consulté le )
- (en) Derry C. Roopenian, Gregory J. Christianson, Thomas J. Sproule et Aaron C. Brown, « The MHC Class I-Like IgG Receptor Controls Perinatal IgG Transport, IgG Homeostasis, and Fate of IgG-Fc-Coupled Drugs », The Journal of Immunology, vol. 170, no 7, , p. 3528–3533 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.170.7.3528, lire en ligne, consulté le )
- (en) Clark L. Anderson, Chaity Chaudhury, Jonghan Kim et C.L. Bronson, « Perspective – FcRn transports albumin: relevance to immunology and medicine », Trends in Immunology, vol. 27, no 7, , p. 343–348 (DOI 10.1016/j.it.2006.05.004, lire en ligne, consulté le )
- J Borvak, « Functional expression of the MHC class I-related receptor, FcRn, in endothelial cells of mice », International Immunology, vol. 10, no 9, , p. 1289–1298 (DOI 10.1093/intimm/10.9.1289, lire en ligne, consulté le )
- (en) Shreeram Akilesh, Gregory J. Christianson, Derry C. Roopenian et Andrey S. Shaw, « Neonatal FcR Expression in Bone Marrow-Derived Cells Functions to Protect Serum IgG from Catabolism », The Journal of Immunology, vol. 179, no 7, , p. 4580–4588 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.179.7.4580, lire en ligne, consulté le )
- (en) Imre Kacskovics, Judit Cervenak, Anna Erdei et Richard A. Goldsby, « Recent advances using FcRn overexpression in transgenic animals to overcome impediments of standard antibody technologies to improve the generation of specific antibodies », mAbs, vol. 3, no 5, , p. 431–439 (ISSN 1942-0862 et 1942-0870, DOI 10.4161/mabs.3.5.17023, lire en ligne, consulté le )
- (en) Masaru Yoshida, Steven M Claypool, Jessica S Wagner et Emiko Mizoguchi, « Human Neonatal Fc Receptor Mediates Transport of IgG into Luminal Secretions for Delivery of Antigens to Mucosal Dendritic Cells », Immunity, vol. 20, no 6, , p. 769–783 (DOI 10.1016/j.immuni.2004.05.007, lire en ligne, consulté le )
- Israel EJ, Patel VK, Taylor SF, Marshak-Rothstein A, Simister NE. Requirement for a beta 2-microglobulin-associated Fc receptor for acquisition of maternal IgG by fetal and neonatal mice. J Immunol (1995) 154(12):6246–51.
- (en) E. J. Israel, S. Taylor, Z. Wu et E. Mizoguchi, « Expression of the neonatal Fc receptor, FcRn, on human intestinal epithelial cells », Immunology, vol. 92, no 1, , p. 69–74 (ISSN 0019-2805 et 1365-2567, PMID 9370926, PMCID PMC1363983, DOI 10.1046/j.1365-2567.1997.00326.x, lire en ligne, consulté le )
- (en) Mark S. Ladinsky, Kathryn E. Huey-Tubman et Pamela J. Bjorkman, « Electron tomography of late stages of FcRn-mediated antibody transcytosis in neonatal rat small intestine », Molecular Biology of the Cell, vol. 23, no 13, , p. 2537–2545 (ISSN 1059-1524 et 1939-4586, PMID 22573886, PMCID PMC3386217, DOI 10.1091/mbc.e12-02-0093, lire en ligne, consulté le )
- (en) Gerburg M. Spiekermann, Patricia W. Finn, E. Sally Ward et Jennifer Dumont, « Receptor-mediated Immunoglobulin G Transport Across Mucosal Barriers in Adult Life », Journal of Experimental Medicine, vol. 196, no 3, , p. 303–310 (ISSN 1540-9538 et 0022-1007, PMID 12163559, PMCID PMC2193935, DOI 10.1084/jem.20020400, lire en ligne, consulté le )
- (en) Steven M. Claypool, Bonny L. Dickinson, Jessica S. Wagner et Finn-Eirik Johansen, « Bidirectional Transepithelial IgG Transport by a Strongly Polarized Basolateral Membrane Fcγ-Receptor », Molecular Biology of the Cell, vol. 15, no 4, , p. 1746–1759 (ISSN 1059-1524 et 1939-4586, PMID 14767057, PMCID PMC379272, DOI 10.1091/mbc.e03-11-0832, lire en ligne, consulté le )
- (en) Bonny L. Dickinson, Kamran Badizadegan, Zhen Wu et Jeremy C. Ahouse, « Bidirectional FcRn-dependent IgG transport in a polarized human intestinal epithelial cell line », Journal of Clinical Investigation, vol. 104, no 7, , p. 903–911 (ISSN 0021-9738, PMID 10510331, PMCID PMC408555, DOI 10.1172/JCI6968, lire en ligne, consulté le )
- (en) Uzma Shah, Bonny L. Dickinson, Richard S. Blumberg et Neil E. Simister, « Distribution of the IgG Fc Receptor, FcRn, in the Human Fetal Intestine: », Pediatric Research, vol. 53, no 2, , p. 295–301 (ISSN 0031-3998, PMID 12538789, PMCID PMC2819091, DOI 10.1203/00006450-200302000-00015, lire en ligne, consulté le )
- Yoshida M, Kobayashi K, Kuo TT, Bry L, Glickman JN, Claypool SM, et al. Neonatal Fc receptor for IgG regulates mucosal immune responses to luminal bacteria. J Clin Invest (2006) 116(8):2142
- Rachel E. Horton et Gestur Vidarsson, « Antibodies and Their Receptors: Different Potential Roles in Mucosal Defense », Frontiers in Immunology, vol. 4, (ISSN 1664-3224, PMID 23882268, PMCID PMC3712224, DOI 10.3389/fimmu.2013.00200, lire en ligne, consulté le )
- (en) Xiaoping Zhu, Gang Meng, Bonny L. Dickinson et Xiaotong Li, « MHC Class I-Related Neonatal Fc Receptor for IgG Is Functionally Expressed in Monocytes, Intestinal Macrophages, and Dendritic Cells », The Journal of Immunology, vol. 166, no 5, , p. 3266–3276 (ISSN 0022-1767 et 1550-6606, PMID 11207281, PMCID PMC2827247, DOI 10.4049/jimmunol.166.5.3266, lire en ligne, consulté le )
- (en) Judit Cervenak, Balázs Bender, Zita Schneider et Melinda Magna, « Neonatal FcR Overexpression Boosts Humoral Immune Response in Transgenic Mice », The Journal of Immunology, vol. 186, no 2, , p. 959–968 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.1000353, lire en ligne, consulté le )
- (en) Gestur Vidarsson, Annette M. Stemerding, Nigel M. Stapleton et Suzanne E. Spliethoff, « FcRn: an IgG receptor on phagocytes with a novel role in phagocytosis », Blood, vol. 108, no 10, , p. 3573–3579 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2006-05-024539, lire en ligne, consulté le )
- (en) K. Baker, S.-W. Qiao, T. T. Kuo et V. G. Aveson, « Neonatal Fc receptor for IgG (FcRn) regulates cross-presentation of IgG immune complexes by CD8-CD11b+ dendritic cells », Proceedings of the National Academy of Sciences, vol. 108, no 24, , p. 9927–9932 (ISSN 0027-8424 et 1091-6490, PMID 21628593, PMCID PMC3116387, DOI 10.1073/pnas.1019037108, lire en ligne, consulté le )
- (en) Wentao Mi, Sylvia Wanjie, Su-Tang Lo et Zhuo Gan, « Targeting the Neonatal Fc Receptor for Antigen Delivery Using Engineered Fc Fragments », The Journal of Immunology, vol. 181, no 11, , p. 7550–7561 (ISSN 0022-1767 et 1550-6606, PMID 19017944, PMCID PMC2738423, DOI 10.4049/jimmunol.181.11.7550, lire en ligne, consulté le )
- (en) S.-W. Qiao, K. Kobayashi, F.-E. Johansen et L. M. Sollid, « Dependence of antibody-mediated presentation of antigen on FcRn », Proceedings of the National Academy of Sciences, vol. 105, no 27, , p. 9337–9342 (ISSN 0027-8424 et 1091-6490, PMID 18599440, PMCID PMC2453734, DOI 10.1073/pnas.0801717105, lire en ligne, consulté le )
- (en) I A Heijnen, M J van Vugt, N A Fanger et R F Graziano, « Antigen targeting to myeloid-specific human Fc gamma RI/CD64 triggers enhanced antibody responses in transgenic mice. », Journal of Clinical Investigation, vol. 97, no 2, , p. 331–338 (ISSN 0021-9738, PMID 8567952, PMCID PMC507022, DOI 10.1172/JCI118420, lire en ligne, consulté le )
- « The Fc receptor for IgA (FcalphaRI, CD89) », Immunology Letters, vol. 92, nos 1–2, , p. 23–31 (PMID 15081523, DOI 10.1016/j.imlet.2003.11.018)
- « Molecular and functional characteristics of the Fcalpha/muR, a novel Fc receptor for IgM and IgA », Springer Seminars in Immunopathology, vol. 28, no 4, , p. 377–82 (PMID 17061088, DOI 10.1007/s00281-006-0050-3)
- « Molecular characteristics of IgA and IgM Fc binding to the Fcalpha/muR », Biochemical and Biophysical Research Communications, vol. 345, no 1, , p. 474–8 (PMID 16681999, DOI 10.1016/j.bbrc.2006.04.084)
- « A review on Fc epsilon RI on human epidermal Langerhans cells », International Archives of Allergy and Immunology, vol. 104 Suppl 1, no 1, , p. 63–4 (PMID 8156009, DOI 10.1159/000236756)
- « 5. IgE, mast cells, basophils, and eosinophils », The Journal of Allergy and Clinical Immunology, vol. 117, no 2 Suppl Mini-Primer, , S450-6 (PMID 16455345, DOI 10.1016/j.jaci.2005.11.016)
- « The central role of FcepsilonRI in allergy », Clinical and Experimental Dermatology, vol. 28, no 2, , p. 184–7 (PMID 12653710, DOI 10.1046/j.1365-2230.2003.01209.x)
- « Structure and function of Fc epsilon receptor II (Fc epsilon RII/CD23): a point of contact between the effector phase of allergy and B cell differentiation », Ciba Foundation Symposium, vol. 147, , p. 23-31; discussion 31-5 (PMID 2695308)
- P. Selvaraj, N. Fifadara, S. Nagarajan, A. Cimino et G. Wang, « Functional regulation of human neutrophil Fc gamma receptors », Immunologic Research, vol. 29, nos 1–3, , p. 219–30 (PMID 15181284, DOI 10.1385/IR:29:1-3:219)
- A. Sulica, W. H. Chambers, M. Manciulea, D. Metes, S. Corey, H. Rabinowich, T. L. Whiteside et R. B. Herberman, « Divergent signal transduction pathways and effects on natural killer cell functions induced by interaction of Fc receptors with physiologic ligands or antireceptor antibodies », Natural Immunity, vol. 14, no 3, , p. 123–33 (PMID 8832896)
- M. Sarfati, S. Fournier, C. Y. Wu et G. Delespesse, « Expression, regulation and function of human Fc epsilon RII (CD23) antigen », Immunologic Research, vol. 11, nos 3–4, , p. 260–72 (PMID 1287120, DOI 10.1007/BF02919132)
- M. Raghavan et P. J. Bjorkman, « Fc receptors and their interactions with immunoglobulins », Annual Review of Cell and Developmental Biology, vol. 12, , p. 181–220 (PMID 8970726, DOI 10.1146/annurev.cellbio.12.1.181)
- J. A. Swanson et A. D. Hoppe, « The coordination of signaling during Fc receptor-mediated phagocytosis », Journal of Leukocyte Biology, vol. 76, no 6, , p. 1093–103 (PMID 15466916, DOI 10.1189/jlb.0804439)
- P. D. Sun, « Structure and function of natural-killer-cell receptors », Immunologic Research, vol. 27, nos 2–3, , p. 539–48 (PMID 12857997, DOI 10.1385/IR:27:2-3:539)
- (en) Andrew Pincetic, Stylianos Bournazos, David J DiLillo et Jad Maamary, « Type I and type II Fc receptors regulate innate and adaptive immunity », Nature Immunology, vol. 15, no 8, , p. 707–716 (ISSN 1529-2908 et 1529-2916, DOI 10.1038/ni.2939, lire en ligne, consulté le )
- (en) Pierre Bruhns et Friederike Jönsson, « Mouse and human FcR effector functions », Immunological Reviews, vol. 268, no 1, , p. 25–51 (DOI 10.1111/imr.12350, lire en ligne, consulté le )
- Hiromi Kubagawa, Yoshiki Kubagawa, Dewitt Jones et Tahseen H. Nasti, « The Old but New IgM Fc Receptor (FcμR) », dans Fc Receptors, vol. 382, Springer International Publishing, (ISBN 978-3-319-07910-3, DOI 10.1007/978-3-319-07911-0_1, lire en ligne), p. 3–28
- New nomenclature for the Reth motif (or ARH1/TAM/ARAM/YXXL) Cambier J.C. (1995) Immunology Today Feb;16(2):110 DOI: 10.1016/0167-5699(95)80105-7
- « The effect of phosphatases SHP-1 and SHIP-1 on signaling by the ITIM- and ITAM-containing Fcgamma receptors FcgammaRIIB and FcgammaRIIA », Journal of Leukocyte Biology, vol. 73, no 6, , p. 823–9 (PMID 12773515, DOI 10.1189/jlb.0902454)
- « Inhibitory receptors abound? », Proceedings of the National Academy of Sciences of the United States of America, vol. 94, no 12, , p. 5993–5 (PMID 9177155, PMCID 33673, DOI 10.1073/pnas.94.12.5993)
- « Augmented humoral and anaphylactic responses in Fc gamma RII-deficient mice », Nature, vol. 379, no 6563, , p. 346–9 (PMID 8552190, DOI 10.1038/379346a0)
- « Inhibitory signaling by B cell Fc gamma RIIb », Current Opinion in Immunology, vol. 10, no 3, , p. 306–12 (PMID 9638367, DOI 10.1016/s0952-7915(98)80169-6)
- « Fcgamma receptor signaling in phagocytes », International Journal of Hematology, vol. 84, no 3, , p. 210–6 (PMID 17050193, DOI 10.1532/IJH97.06140)
- « Receptors for the Fc fragment of IgG on natural killer cells », Natural Immunity, vol. 12, nos 4–5, , p. 218–34 (PMID 8257828)
- « Regulation of human natural cytotoxicity by IgG. IV. Association between binding of monomeric IgG to the Fc receptors on large granular lymphocytes and inhibition of natural killer (NK) cell activity », Cellular Immunology, vol. 147, no 2, , p. 397–410 (PMID 8453679, DOI 10.1006/cimm.1993.1079)
- « Regulation of mast cell activation through FcepsilonRI », Chemical Immunology and Allergy, vol. 87, , p. 22–31 (PMID 16107760, DOI 10.1159/000087568)
- « Gene expression profiles for Fc epsilon RI, cytokines and chemokines upon Fc epsilon RI activation in human cultured mast cells derived from peripheral blood », Cytokine, vol. 16, no 4, , p. 143–52 (PMID 11792124, DOI 10.1006/cyto.2001.0958)
- « Mast cells », Physiological Reviews, vol. 77, no 4, , p. 1033–79 (PMID 9354811)
- « Mechanism of the interaction mediating killing of Schistosoma mansoni by human eosinophils », The American Journal of Tropical Medicine and Hygiene, vol. 29, no 5, , p. 842–8 (PMID 7435788)
- « Eosinophils: from low- to high-affinity immunoglobulin E receptors », Allergy, vol. 50, no 25 Suppl, , p. 20–3 (PMID 7677229, DOI 10.1111/j.1398-9995.1995.tb04270.x)
- « High-affinity IgE receptor on eosinophils is involved in defence against parasites », Nature, vol. 367, no 6459, , p. 183–6 (PMID 8114916, DOI 10.1038/367183a0)
