Oxygénation par membrane extracorporelle
| CIM-10 PCS | Z92.81 |
|---|---|
| CIM-9-CM Volume 3 | « 39.65 » |
| MeSH | « 29295 » |
| MedlinePlus | 007234 |
L’oxygénation par membrane extracorporelle, communément appelée ECMO (l'acronyme anglais de extracorporeal membrane oxygenation), désigne, en réanimation, une technique de circulation extracorporelle offrant une assistance à la fois cardiaque et respiratoire à des patients dont le cœur et/ou les poumons ne sont pas capables d'assurer un échange gazeux compatible avec la vie. Cette procédure a d'abord été utilisée chez les enfants, mais s'est popularisée de plus en plus auprès des adultes à mesure que les indications de l'ECMO se diversifiaient.
L'ECMO est une technique de suppléance d'organe, et est parfois aussi appelée extracorporeal life support (ECLS). Elle fonctionne en extrayant du sang désoxygéné du corps du patient par des canules de gros diamètre et en le faisant traverser une membrane qui élimine le dioxyde de carbone avant de l’oxygéner – recréant ainsi artificiellement les échanges gazeux alvéolaires – avant de le réinjecter dans la circulation sanguine.
L’oxygénation par membrane extracorporelle peut ainsi assurer une oxygénation adéquate pendant plusieurs jours, voire plusieurs semaines ou mois, laissant aux poumons le temps de guérir sans recours à une ventilation mécanique agressive. Néanmoins, en raison des exigences techniques et humaines que sa mise en œuvre engendrent, à son coût élevé et aux nombreux risques de complications (essentiellement l'hémorragie), l'ECMO est considérée comme un traitement de dernier recours pour des patients en état de défaillance cardiaque et/ou respiratoire sévère voire irréversible. Chez l'adulte, les taux de survie sous ECMO sont de l'ordre de 60 % en bloc opératoire, 30 % en intervention médicale d'urgence (où l'ECMO est une technique émergente en 2021).
Historique[modifier | modifier le code]
Dès les années 1930 à Philadelphie, le Dr John Heysham Gibbon commence à travailler sur les techniques de circulation extracorporelles, ses recherches menant finalement au développement d'une machine cœur-poumon utilisée avec succès en 1953 lors d'une opération à cœur ouvert. Il faut attendre 1971 pour voir l'utilisation réussie d'un bypass cardiopulmonaire au chevet d'un patient. Avant cela, ces machines ne bénéficiant pas d'un « oxygénateur » permettant de séparer les gaz du sang, et les patients ne survivaient que quelques heures avant de développer des désordres sanguins fatals (hémolyse, thrombocytopénie et coagulopathie).
En 1975, le Dr Robert Bartlett (en) et son équipe parviennent à sauver un nouveau-né ayant inhalé du méconium grâce à cette technique, marquant le début de l'ECMO. Les années 1970 marquent une période de grands progrès en réanimation : création des unités de soins intensifs, utilisation des dialyses, meilleure compréhension des phénomènes de ventilation invasive, notamment par la pression positive (PEP). Dans la décennie suivante, plusieurs études démontrent les taux de succès importants de l'ECMO sur les enfants souffrant de détresse respiratoire aiguë. Cependant, les mêmes études randomisées ne sont pas du tout aussi optimistes chez les adultes, certaines faisant état de 90 % de mortalité[1]. À la suite de ces études, l'utilisation des ECMO sur les adultes est à peu près abandonné, alors que son utilisation s'étend chez les enfants (en 1986, certaines études rapportent un taux de survie d'environ 50 %[2],[3]).
Les années 1990 voient la création de l'Extracorporeal Life Support Organization (ELSO) et le développement d'une nouvelle vague d'études cherchant à re-populariser l'ECMO chez les adultes, notamment avec l'aide des National Institutes of Health américains[4]. Les progrès technologiques en général dans le domaine de la médecine de réanimation ont permis le développement de l'ECMO dont le taux de mortalité est bien différent des années 1970. Une étude britannique appelée Conventional Ventilatory Support versus Extracorporeal Membrane Oxygenation for Severe Adult Respiratory Failure (CESAR) publiée en 2008, ainsi que plusieurs autres études randomisées ont participé à l'expansion des ECMO. De plus, son succès pour traiter l'épidémie de grippe H1N1 en 2009 a fini de populariser son utilisation.
Des études récentes étendent plus encore ses indications, puisqu'en plus des défaillances cardiopulmonaires « traditionnelles », elle commence à être utilisée pour potentialiser la réanimation cardiopulmonaire dans les cas d'arrêt cardiaque, mais aussi pour traiter les embolies pulmonaires, l'hypothermie, les noyades, les overdoses, les obstructions des voies aériennes, et les déséquilibres électrolytiques sévères.
Principe[modifier | modifier le code]

Le principe de l'ECMO est de mettre le cœur ou les poumons (ou les deux) au repos plus ou moins complet en attendant leur guérison (ou une intervention visant à les remplacer). Ainsi, les patients sont généralement sédatés et paralysés pour permettre le repos de ces organes, y compris une intubation trachéale et une assistance minimale par ventilation mécanique.
Un circuit d'ECMO est semblable à celui d'une dérivation cardiopulmonaire utilisée en chirurgie cardiaque. Il consiste en l'insertion d'une canule dans un vaisseau sanguin (habituellement une veine de gros calibre) permettant un flux sanguin important. Le sang veineux désoxygéné et riche en dioxyde de carbone (CO2) est donc aspiré par une pompe centrifuge intégrée au circuit (tournant à environ 3 000 tours par minute, pour un volume sanguin total mobilisé allant jusqu'à 5 L/min).
Une fois à l'extérieur du corps, le sang circule en continu dans des tuyaux de plastique spécialisé, dont l'intérieur est tapissé par un anticoagulant (héparine, ainsi que certaines indications pour du citrate) pour empêcher la formation de caillots dans le circuit. Après le passage de la pompe, il traverse un « oxygénateur à membrane » qui simule le processus d'échanges gazeux qui a lieu physiologiquement dans les alvéoles pulmonaires : elle retient le dioxyde de carbone du sang et y injecte de l'oxygène. Le sang ainsi oxygéné est alors remis en circulation dans le corps du patient par une canule veineuse ou artérielle. Avant d'être réinjecté, le sang passe à travers un réchauffeur qui rétablit la normothermie sanguine (37°).
Une anticoagulation systémique est nécessaire pour maintenir un flux sanguin approprié et éviter la coagulation précoce de la membrane. De même, pour éviter des infections, le patient bénéficie généralement d'une antibio-prophylaxie.
Types[modifier | modifier le code]
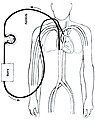
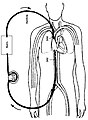
Il existe différents types d'ECMO, dont les deux plus courants sont la voie veino-artérielle (VA) et la voie veino-veineuse (VV)[5]. Dans les deux cas, le sang extrait du système veineux est oxygéné à l'extérieur du corps. Dans la VA ECMO, le sang ainsi ré-oxygéné est remis en circulation dans le système artériel, alors que dans la VV ECMO, l'opération termine dans le système veineux[6]. Pour résumer, la VA ECMO apporte un soutien cardiorespiratoire alors que la VV ECMO n'assure qu'un soutien respiratoire.
-
VA ECMO
-
VV ECMO
Veino-artérielle (VA)[modifier | modifier le code]
Dans l'ECMO veino-artérielle, une canule de sortie veineuse est placée dans l'une des grosses veines (souvent fémorale ou jugulaire), et une canule artérielle est insérée dans l'une des grosses artères (souvent fémorale ou carotide) pour le retour du sang. Le bout de la canule veineuse doit atteindre la jonction entre la veine cave inférieure et l'oreillette droite, alors que le bout de la canule artérielle est maintenue dans l'aorte ascendante ou l'artère iliaque[7].
Si ECMO est le terme général, la VA ECMO est parfois appelée ECLS (extracorporeal life support) pour la différencier de la VV ECMO (extracorporeal membrane oxygenation).
Dans le cas d'une canule artérielle fémorale, en raison du haut risque d'ischémie du membre liée à la présence de la canule de gros diamètre dans l'artère irriguant la jambe, un cathéter de reperfusion est souvent inséré en même temps que les canules[8].
Veino-veineuse (VV)[modifier | modifier le code]
Dans l'ECMO veino-veineuse, une canule de sortie veineuse est placée dans la veine fémorale et une canule de retour est insérée dans la veine jugulaire interne. Certaines ECMO sont canulées grâce à un cathéter à double lumière inséré dans la jugulaire interne, qui extrait le sang de la veine cave supérieure, et le ramenant dans l'oreillette droite[9].
Autres systèmes[modifier | modifier le code]
Pour certaines indications spécifiques, un circuit veino-veino-artériel (VVA ECMO) peut aussi être utilisé. Il consiste, comme son nom l'indique, en une canule de sortie veineuse qui extrait le sang de la veine fémorale, et le fait passer à travers la membrane[10]. Après celle-ci, le circuit est divisé en deux : une canule veineuse (jugulaire) ainsi qu'une canule artérielle (carotide ou sous-clavière). Le même schéma peut s'appliquer dans la région fémorale.
De plus, si les ECMO traditionnelles fonctionnent comme une pompe centrifuge qui aspire le sang veineux pour le réinjecter après le passage à travers la membrane dans la veine ou l'artère de retour, un nouveau système artério-veineux (AV) « sans pompe » a vu le jour[11]. Ce système utilise la pompe naturelle du cœur pour éjecter le sang à l'extérieur du corps par la canule artérielle et le réinjecter dans le système veineux après avoir été oxygéné par la membrane[12],[13].
Indications[modifier | modifier le code]
Il existe deux indications majeures à l'ECMO : les défaillances respiratoire et/ou circulatoire sévères et aigües, potentiellement réversibles et réfractaire aux autres traitements. Elle peut être mise en place au lit du patient, en attente d'une amélioration de l'organe défaillant ou d'un traitement plus radical, de type transplantation cardiaque.
Les indications principales de l'ECMO sont[14] :
- défaillance respiratoire hypoxémique / SDRA (PaO2/FiO2 < 100 mmHg) réfractaire aux traitements conventionnels (ventilation mécanique avec paramètres optimisés (FiO2, PEP, ratio I:E), recrutement alvéolaire, décubitus ventral, etc.) ;
- défaillance respiratoire hypercapnique avec acidose respiratoire critique (pH artériel < 7,20) ;
- choc cardiogénique réfractaire aux traitements conventionnels (inotropes, drogues vasoactives, ballon de contre-pulsion aortique, etc.) ;
- arrêt cardiocirculatoire. Son intérêt reste toutefois discuté dans le cadre extra-hospitalier, des études montrant un taux de survie supérieur[15], d'autres non[16] ;
- dans l'attente d'une transplantation cardiaque ou d'un appareil d'assistance ventriculaire.
Chez les enfants[modifier | modifier le code]

L'ECMO est utilisé dans des unités de soins intensifs néonatals, pour des nouveau-nés atteints de détresse pulmonaire[17] ; mais ils sont également utilisés chez les adultes qui, même avec l'aide d'une assistance respiratoire, ont cependant besoin d'être oxygénés jusqu'à ce que leur corps soit de nouveau capable de s'en charger sans assistance. L'une des nouvelles utilisations concerne les adultes et les enfants atteints de grippe H1N[18]. Le traitement ECMO assure l'oxygénation jusqu'à ce que leurs fonctions pulmonaires aient recouvré suffisamment leurs capacités pour maintenir une saturation suffisante en oxygène (O2). Il s'agit là souvent d'une solution de dernier recours.
Pour sauver un nouveau-né, l'efficacité de l'ECMO est de l'ordre de 75 %. Les nouveau-nés ne peuvent être placés sous ECMO s'ils pèsent moins de deux kilos environ, car ils ont des vaisseaux sanguins extrêmement fins pour la mise en place des canules, ce qui freine la libre circulation du flux sanguin (c'est un phénomène comparable à la « résistance vasculaire »)[19]. Par conséquent, le procédé ne peut être utilisé sur la plupart des prématurés. Les enfants nouveau-nés sont parfois placés sous ECMO du fait d'un système respiratoire qui ne fonctionne pas parfaitement, ou de tout autre maladie congénitale ; mais le taux de survie tombe alors à 33 % environ.
Contre-indications[modifier | modifier le code]
La plupart des contre-indications sont relatives, faisant l'objet d'un calcul risques/bénéfices par l'équipe médicale. Les contre-indications relatives principales sont[14] :
- conditions incompatibles avec une vie normale même si l'état de santé du patient s'améliore ;
- maladies ou conditions préexistantes qui affectent déjà la qualité de vie (cancer en stade terminal, affections du système nerveux central, fin de vie, risque de CIVD dû à l'anticoagulation systémique) ;
- lorsque les traitements conventionnels ont été poursuivis trop longtemps ou que la défaillance est à un stade trop avancé pour justifier la mise en œuvre de la procédure ;
- âge et poids.
Durée[modifier | modifier le code]
L'ECMO par voie veino-veineuse peut suffire à fournir de l'oxygène pendant plusieurs semaines, permettant aux poumons malades de guérir. Cependant, du fait des exigences techniques élevées, du coût, et des risques de complication, tels que les saignements sous traitement anti-coagulant, l'ECMO n'est généralement considéré que comme une solution d'ultime recours.
La durée maximale pour un nouveau-né sous ECMO est en général de l'ordre de 21 jours. Le Dr Thomas Krummel, qui préside la chirurgie générale à l'université Stanford, a détenu le record de la durée de survie sous ECMO, avec 62 jours. Ce record est tombé, le , lorsqu'un patient de l'hôpital NTU, à Taïwan, a survécu à une noyade après un traitement sous ECMO de 117 jours[20].
Statistiques[modifier | modifier le code]
Depuis sa création en 1990, l'Extracorporeal Life Support Organization (ELSO) publie régulièrement les statistiques internationales d'utilisation des ECMO et met à jour les taux de survie.
| Population | Pathologie | Nombre de procédures |
Survie à l'ECMO | Survie à l'hospitalisation | ||||
|---|---|---|---|---|---|---|---|---|
| Nombre | Taux | Nombre | Taux | |||||
| Néonatalogie | Respiratoire | 28 723 | 24 155 | 84 % | 21 274 | 74 % | ||
| Cardiaque | 6 269 | 3 885 | 62 % | 2 599 | 41 % | |||
| Mixte | 1 254 | 806 | 64 % | 514 | 41 % | |||
| Pédiatrie | Respiratoire | 7 210 | 4 787 | 66 % | 4 155 | 58 % | ||
| Cardiaque | 8 021 | 5 341 | 67 % | 4 067 | 51 % | |||
| Mixte | 2 788 | 1 532 | 55 % | 1 144 | 41 % | |||
| Adultes | Respiratoire | 9 102 | 5 989 | 66 % | 5 254 | 58 % | ||
| Cardiaque | 7 850 | 4 394 | 56 % | 3 233 | 41 % | |||
| Mixte | 2 379 | 948 | 40 % | 707 | 30 % | |||
| TOTAL | 73 596 | 51 837 | 70 % | 42 947 | 58 % | |||
Le nombre de centres spécialisés équipés avec des ECMO est passé de 83 au niveau mondial à près de 300 en 2016[21].
Complications[modifier | modifier le code]
Une septicémie mortelle peut se produire lorsque les gros cathéters insérés dans le cou deviennent un terrain où se développe une infection[22]. Les risques additionnels comprennent l'éventualité de saignements, éventualité fréquente, et dont la forme la plus redoutée chez le nouveau-né est le saignement intracrânien[23]. Chez l'adulte, les taux de survie sous ECMO sont de l'ordre de 60 %, et on a parlé de patients restés sous traitement pendant plus de dix semaines.
Dans le traitement par voie veino-artérielle, les patients dont la fonction cardiaque ne récupère pas suffisamment vite pour cesser l'assistance par ECMO peuvent être réorientés vers un dispositif d'assistance ventriculaire (VAD, ventricular assist device) ou une transplantation.
Chez les nourrissons âgés de moins de 34 semaines de gestation, plusieurs systèmes physiologiques sont encore peu formés, en particulier la vascularisation cérébrale et la matrice germinale (germinal matrix), ce qui se traduit alors par une sensibilité élevée à de légères variations de pH, de PaO2, et de pression intracrânienne[19]. Au vu du risque d'hémorragies intraventriculaires, c'est maintenant une pratique standard que de faire une échographie du cerveau avant de mettre le patient sous ECMO[19].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Extracorporeal membrane oxygenation » (voir la liste des auteurs).
- (en) Warren M. Zapol et al., « Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study », Journal of American Medical Association, (consulté le )
- (en) Luciano Gattinoni et al., « Low-Frequency Positive-Pressure Ventilation With Extracorporeal CO2 Removal in Severe Acute Respiratory Failure », Journal of American Medical Association, (consulté le )
- (en) P. Pearl O'Rourke et al., « Extracorporeal Membrane Oxygenation and Conventional Medical Therapy in Neonates With Persistent Pulmonary Hypertension of the Newborn: A Prospective Randomized Study », Pediatrics, (consulté le )
- (en) « Diffusion of ECMO Technology -- Extracorporeal Membrane Oxygenation (Report of the Workshop) », sur National Institutes of Health, Eunice Kennedy Shriver National Institute of Child Health and Human Development, (consulté le )
- (en) Guillermo Martinez et Alain Vuylsteke, « Extracorporeal Membrane Oxygenation in Adults », sur MedScape, British Journal of Anaesthetists, (consulté le )
- (en) Frederik Stöhr et al., « Extracorporeal membrane oxygenation for acute respiratory distress syndrome: is the configuration mode an important predictor for the outcome? », sur Oxford Journals, Interactive CardioVasc Thoracic Surgery, (consulté le )
- « ECMO », sur Groupe hospitalier Pitié-Salpétrière, Service de chirurgie thoracique et cardio-vasculaire (consulté le )
- (en) D. Wang, JB. Zwischenberger et al., « Wang-Zwische double lumen cannula-toward a percutaneous and ambulatory paracorporeal artificial lung », sur PubMed, American Society for Artificial Internal Organs, (consulté le )
- (en) Fabio Ius et al., « Veno-veno-arterial extracorporeal membrane oxygenation for respiratory failure with severe haemodynamic impairment: technique and early outcomes », sur Oxford Journals, Interactive CardioVasc Thoracic Surgery, (consulté le )
- P.-E. Falcoz et G. Capellier, « Principes et indications de l'ECMO en pathologie pulmonaire de l'adulte », EM Consulte, (consulté le )
- (en) A. Liebold et al., « Pumpless extracorporeal lung assist using an arterio-venous shunt. Applications and limitations », sur Minerva Anestesiologica, Italian Society of Anesthesiology, Analgesia, Resuscitation and Intensive Care, (consulté le )
- (en) R. Kopp et al., « Pumpless arterio-venous extracorporeal lung assist compared with veno-venous extracorporeal membrane oxygenation during experimental lung injury », sur Oxford Journals, British Journal of Anaesthesiologists, (consulté le )
- [PDF] (en) « General Guidelines for all ECLS Cases », Extracorporeal Life Support Organization, (consulté le )
- Yannopoulos D, Bartos J, Raveendran G et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial, Lancet, 2020;396:1807-1816
- Suverein MM, Delnoij TSR, Lorusso R et al. Early extracorporeal CPR for refractory out-of-hospital cardiac arrest, N Engl J Med, 2022;388:299-309
- Elbourne D, Field D, Mugford M, « Oxygénation extracorporelle par oxygénateur à membrane en cas d'insuffisance respiratoire sévère chez le nouveau-né », Base de Données des Analyses Documentaires Systématiques Cochrane, (consulté le )
- « Grippe A(H1N1): recours accru à l'oxygénation extracorporelle en Australie et en Nouvelle-Zélande », sur APM International (consulté le ).
- (en) « Concepts Of Neonatal ECMO », The Internet Journal of Perfusionists, (consulté le )
- « Patient recovers after 117 days of ECMO treatment - Taipei Times », sur www.taipeitimes.com (consulté le )
- (en) « ECLS Registry Report - International Summary », Extracorporeal Life Support Organization, (consulté le )
- Andreas Widmer et Patrick Francioli, « Infections liées aux cathéters veineux centraux : revue », sur Swiss Noso (consulté le ).
- Francis Gold, Yannick Aujard 2006, p. 404
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- J.-Y. Chevalier, Francis Gold et Yannick Aujard, Soins intensifs et réanimation du nouveau-né, Elsevier Masson, , 597 p. (ISBN 978-2-294-02012-4, lire en ligne), « Oxygénation extra-corporelle »
Liens externes[modifier | modifier le code]
- (en) [ Oxygénation extracorporelle par oxygénateur à membrane], sur BSG, la bibliothèque de santé génésique de l'OMS (consulté le )
- (en) ECMO Simulation Site