Synthèse de Kiliani-Fischer
La synthèse de Kiliani-Fischer, appelée également synthèse de cyanohydrine, nommée d'après les chimistes allemands Heinrich Kiliani[1] et Hermann Emil Fischer[2], est une méthode de synthèse de monosaccharides par l'élongation de leur chaîne carbonée.
Principe[modifier | modifier le code]
Cette méthode de synthèse repose sur la synthèse et l'hydrolyse d'une cyanohydrine, allongeant la chaîne carbonée d'un aldose d'un atome de carbone, et préservant la stéréochimie de tous les atomes de carbone stéréogènes précédemment présents. Le nouveau carbone stéréogène est produit avec deux stéréochimies, faisant du produit de la synthèse de Kiliani-Fischer un mélange de deux sucres diastéréoisomères appelés « épimères ». Par exemple, le D-arabinose est converti en un mélange de D-glucose et de D-mannose.
Synthèse classique[modifier | modifier le code]
La version originale de la version synthèse de Kiliani-Fischer procède via des intermédiaires cyanohydrine et lactone d'acide aldonique.
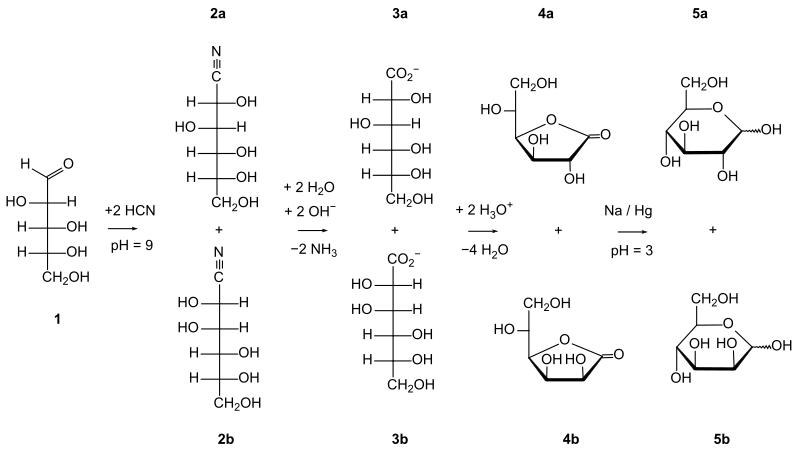
La première étape est la réaction entre le sucre initial et un cyanure aqueux (en général le cyanure de sodium NaCN, mais aussi le cyanure d'hydrogène, HCN) par addition nucléophile du cyanure sur le groupe carbonyle du sucre (même si les sucres tendent à exister majoritairement sous la forme d'hémiacétals cycliques, il y a toujours un équilibre chimique entre cette forme et la forme aldéhyde/cétone chaine ouverte, et dans le cas des aldoses, c'est ce groupe aldéhyde qui réagit, déplaçant l'équilibre vers la forme ouverte) formant une cyanohydrine. Cette dernière est chauffée en présence d'eau, ce qui hydrolyse son groupe nitrile en groupe carboxyle qui réagit rapidement sur lui-même par estérification intra-moléculaire pour former une lactone, plus stable. Les deux lactones diastéréoisomères sont ensuite séparées (par chromatographie, extraction liquide-liquide, ou toute autre méthode de séparation) et la lactone désirée est réduite par un amalgame de sodium.
Le schéma ci-dessus présente le D-arabinose (1) converti par le cyanure d'hydrogène en un mélange de D-glucononitrile (2a) et D-mannononitrile (2b). Ces deux composés sont hydrolysés en deux diastéréoisomère aldonate, le D-gluconate (3a ) et le D-mannonate (3b) qui réagissent par estérification intra-moléculaire pour donner deux γ-lactones, la γ-D-gluconolactone (4a) et la γ-D-mannonolactone (4b). Ces deux composés sont séparées et réduits par l’amalgame de sodium en aldohexoses, D-glucose (5a) ou D-mannose (5b)[3]. Le rendement par cette méthode est aux alentours de 30 %.
Version améliorée[modifier | modifier le code]
En 1958, R. Kuhn et al.[4] ont décrit une amélioration de la méthode avec de meilleurs rendements et permettant de synthétiser des sucres à chaîne plus longue. Au lieu de convertir la cyanohydrine en lactone, on lui fait subir une hydrogénation réductrice catalysée par le palladium sur sulfate de baryum (Pd/BaSO4) dans l'eau, pour former une imine. Par la présence de l'eau, l'imine s'hydrolyse rapidement pour former un aldéhyde, c'est-à-dire le sucre final qui est ainsi produit en deux étapes au lieu de trois. La séparation des isomères a alors lieu à l'étape de la production des sucres au lieu de la séparation des intermédiaires lactones.
L'utilisation d'un catalyseur spécifique est nécessitée par la présence d'un groupe aldéhyde dans le produit final qui pourrait être réduit en groupe hydroxyle donnant donc un alditol si l'hydrogénation était trop brutale. Pour la limiter, on utilise donc un catalyseur empoisonné comme le catalyseur de Lindlar par exemple. La réaction ci-dessous illustre cette méthode pour la conversion du L-thréose en L-lyxose et L-xylose :

Utilisation et limitations[modifier | modifier le code]
Les deux énantiomères du glycéraldéhyde étant disponibles dans le commerce, il est possible d'accéder à n'importe quel stéréoisomère de n'importe quel aldose par un nombre approprié de synthèses de Kiliani-Fischer. Le triose D-glyceraldehyde (1) permet d'obtenir les tétroses D-érythrose (2a) et D-thréose (2b). Ces deux composés permettent d'obtenir les pentoses D-ribose (3a) et D-arabinose (3b) d'une part, et D-xylose (3c) et D-lyxose (3d) d'autre part. L'itération suivante permet d'obtenir les hexoses D-allose (4a), D-altrose (4b), D-glucose (4c), D-mannose (4d), D-gulose (4e), D-idose (4f), D-galactose (4g) et D-talose (4h). Il est par la suite possible d'obtenir les D-heptoses et au-delà, et la série des énantiomères L est également disponible en partant du L-glycéraldéhyde.

En pratique, la synthèse de Kiliani–Fischer est utilisée pour produire des sucres qui sont difficiles ou impossibles à obtenir à partir de sources naturelles. Si cette méthode permet d'obtenir n'importe quel stéréoisomère, elle est limitée par le rendement faible, qui décroit exponentiellement avec les itérations nécessaires, et par l'utilisation de réactifs toxiques. De plus, pour produire un composé à n atomes de carbone, il faut pouvoir disposer d'un approvisionnement en produit « n-1 », et si celui-ci n'est pas disponible directement, il faut recourir à un important travail de synthèse pour l'obtenir.
En outre, ce procédé ne donne un accès direct qu'aux aldoses, alors que certains sucres d'intérêt sont des cétoses. Cependant, certains cétoses peuvent être accessibles à partir d'aldoses similaires par isomérisation via un intermédiaire énediol. Par exemple, au repos dans une solution aqueuse basique, le glucose, le fructose et la mannose s'interconvertissent car ils partagent une forme énediol (voir mutarotation). Certains sucres non-courants peuvent aussi être accessibles par aldolisation.
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Kiliani–Fischer synthesis » (voir la liste des auteurs) et en allemand « Kiliani-Fischer-Synthese » (voir la liste des auteurs).
- (de) H. Kiliani, « Ueber das Cyanhydrin der Lävulose », Ber. Dtsch. Chem. Ges., vol. 18, no 2, , p. 3066–3072 (ISSN 0365-9496, DOI 10.1002/cber.188501802249, lire en ligne).
- (de) E. Fischer, « Reduction von Säuren der Zuckergruppe », Ber. Dtsch. Chem. Ges., vol. 22, no 2, , p. 2204–2205 (ISSN 0365-9496, DOI 10.1002/cber.18890220291, lire en ligne).
- (de) E. Breitmaier et G. Jung, Organische Chemie, Stuttgart (Allemagne), Georg Thieme Verlag, , 1000 p. (ISBN 978-3-13-541505-5, lire en ligne), chap. 20 (« Aldehyde und Ketone »), p. 330.
- (de) R. Kuhn et H. Grassner, « Mechanismus der Katalytischen Hydrierung von Hydroxynitrilen. α-D-Fructoheptose aus D-Fructosecyanhydrin », Liebigs Ann. Chem., vol. 612, no 1, , p. 55–64 (ISSN 0075-4617, DOI 10.1002/jlac.19586120106).