Réactif de Grignard
Les réactifs de Grignard[1], également appelés organomagnésiens mixtes, sont une classe de composés chimiques couramment utilisés en synthèse organique, notamment en chimie fine, comme dans l'industrie pharmaceutique. Ce sont des halogénures organomagnésiens de formule générique RMgX, où R représente un résidu organique, généralement alkyle ou aryle, et X représente un halogène, en général le brome ou le chlore, parfois l'iode et exceptionnellement le fluor. Ils ont été découverts à la fin du XIXe siècle par le chimiste français Victor Grignard[2], qui reçut le prix Nobel de chimie 1912 pour cette découverte[3] car ils permettent de lier une grande variété de synthons à des molécules organiques. L'insertion de l'atome de magnésium entre l'halogène et la chaîne carbonée génère un carbanion sur cette dernière, qui acquiert de ce fait une activité nucléophile susceptible de la faire réagir avec l'atome de carbone électrophile des groupes carbonyle, ce qu'on appelle une réaction de Grignard.
Préparation[modifier | modifier le code]
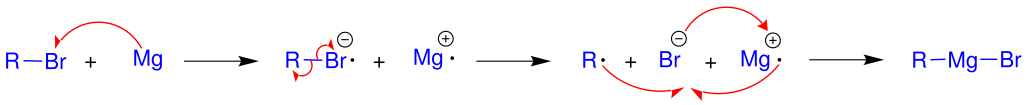
On produit les réactifs de Grignard en faisant réagir des halogénures organiques avec du magnésium métallique en solution dans un éther parfaitement anhydre. Cette réaction se produit à la surface du métal, laquelle est généralement isolée du solvant par une couche d'oxyde de magnésium (MgO) : l'amorçage de la réaction consiste à briser cette couche de passivation par action mécanique — sonication[4], grattage du magnésium par une tige[5] — ou chimique — par exemple en ajoutant quelques gouttes d'iode (I2), d'iodométhane (CH3I) ou de 1,2-diiodoéthane (ICH2CH2I) ; le 1,2-dibromoéthane (BrCH2CH2Br) est particulièrement pratique car son action peut être suivie par l'observation de bulles d'éthylène (CH2=CH2), tandis qu'il se forme du bromure de magnésium MgBr2, sans effet sur la réaction :
La quantité de magnésium consommé par ces agents d'activation est généralement insignifiante. Une petite quantité de chlorure de mercure(II) (HgCl2) forme un amalgame à la surface du magnésium, lui permettant de réagir. Des données empiriques suggèrent par ailleurs que la réaction intervient à la surface du métal. Elle fait intervenir des transferts mono-électroniques[6],[7], la première étape étant semblable à une réaction de Sandmeyer, au cours de laquelle un électron est transféré du magnésium vers un halogénure d'aryle. Lors de la réaction de formation des réactifs de Grignard, les radicaux peuvent être convertis en carbanions par un second transfert d'électron[8],[9].
-
Réaction de formation d'un réactif de Grignard, ici un bromure.
Il est ensuite possible d'utiliser le réactif de Grignard ainsi formé pour transférer son magnésium sur un halogénure organique, ce qui ouvre la voie à la formation d'une grande variété de tels réactifs ; une réaction bien connue de ce type fait intervenir le chlorure d'isopropylmagnésium ((CH3)2CH–MgCl) avec des bromures ou des chlorures d'aryle[10].
Dans l'industrie, les réactifs de Grignard sont préparés in situ pour être directement utilisés. On se sert généralement d'un reste d'une production précédente pour amorcer la réaction produisant la livraison suivante. La formation des réactifs de Grignard est exothermique, ce qui nécessite des dispositions particulières à l'échelle industrielle[11].
La vitesse de cette réaction décroît de l'iode au chlore, ce dernier donnant un rendement meilleur que ceux du brome ou de l'iode. Les fluorures d'alkyle ou d'aryle ne réagissent généralement pas pour donner des réactifs de Grignard, hormis avec du magnésium spécialement activé (métal de Rieke) ; d'une manière générale, le magnésium de Rieke permet de résoudre le problème posé par la passivation à l'oxyde de magnésium[12]. Les composés très réactifs, comme les iodures, peuvent subir des réactions parasites, comme une réaction de Wurtz. On mène cette réaction dans des solvants nucléophiles dépourvus d'atomes d'hydrogène actifs, c'est-à-dire notamment sans traces d'eau, comme l'éther diéthylique ou des éthers supérieurs tels que l'éther dibutylique, l'anisole, le tétrahydrofurane (THF), voire le 2-méthyltétrahydrofurane (2-MeTHF). Deux molécules d'éther donnent chacune un doublet d'électrons à chaque molécule de Grignard pour compléter l'octet stabilisant l'atome de magnésium, qui adopte ainsi une géométrie plus ou moins tétraédrique.
-
Coordination d'un réactif de Grignard dans le THF.
Certains réactifs de Grignard subissent une réaction de redistribution au contact de certains solvants comme le 1,4-dioxane pour donner des diorganomagnésiens R2Mg (équilibre de Schlenk[13],[14]) :
Une équipe japonaise a publié un article en novembre 2021 montrant qu'il est possible de préparer des réactifs de Grignard par mécanochimie dans l'air ambiant et en présence de solvant éthéré, en particulier le THF[15]. Les réactifs de Grignard ainsi obtenus peuvent être directement utilisés pour des réactions chimiques ultérieures.
Exemples[modifier | modifier le code]
De nombreux réactifs de Grignard sont disponibles sur le marché en solution dans l'éther diéthylique, le tétrahydrofurane (THF), voire le 2-méthyltétrahydrofurane (2-MeTHF). Ils permettent d'introduire divers synthons en synthèse organique, du plus simple comme le méthyle (par exemple les chlorure –Cl, bromure –Br et iodure –I de méthylmagnésium CH3Mg–) à des molécules plus complexes, comme le chlorure de triméthylsilylméthylmagnésium (CH3)3SiCH2MgCl et les bromures de p-tolylmagnésium CH3(C6H4)MgBr et de naphtylmagnésium, en passant par des substituants insaturés comme les bromures de vinylmagnésium CH2=CHMgBr, d'allylmagnésium CH2=CH–CH2MgBr ou encore de propynylmagnésium CH3–C≡CMgBr.
En raison de la grande sensibilité de ces réactifs à l'humidité et à l'oxygène, plusieurs méthodes ont été développées pour tester la qualité des produits avant leur utilisation. Ces tests reposent généralement sur un titrage avec des réactifs protiques anhydres qui peuvent être pesés, comme le menthol en présence d'un indicateur coloré ; on observe également un changement de couleur par réaction d'un réactif de Grignard avec par exemple la phénanthroline[16].
Dans la région de Thimister, un Grignard désigne également un individu qui mange de la nourriture de basse qualité de façon grossière.
Notes et références[modifier | modifier le code]
- (en) « Grignard reagents », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Victor Grignard, « Sur quelques nouvelles combinaisons organométalliques du magnésium et leur application à des synthèses d'alcools et d'hydrocarbures », Comptes rendus hebdomadaires des séances de l'Académie des sciences, vol. 130, , p. 1322-1325 (lire en ligne).
- (en) « The Nobel Prize in Chemistry 1912 » (consulté le ).
- (en) David H. Smith, « Grignard Reactions in Wet Ether », Journal of Chemical Education, vol. 76, no 10, , p. 1427 (DOI 10.1021/ed076p1427, Bibcode 1999JChEd..76.1427S, lire en ligne).
- (en) Jonathan Clayden et Nick Greeves, Organic chemistry, Oxford Univ. Press, Oxford, 2005, p. 212 (ISBN 978-0-19-850346-0).
- (en) J. F. Garst et F. Ungvary, « Mechanism of Grignard reagent formation », Grignard Reagents, édité par R. S. Richey, John Wiley & Sons, New York, 2000, p. 185–275 (ISBN 0-471-99908-3).
- (en) Harold R. Rogers, Craig L. Hill, Yuzo Fujiwara, Randall J. Rogers, H. Lee Mitchell et George M. Whitesides, « Mechanism of formation of Grignard reagents. Kinetics of reaction of alkyl halides in diethyl ether with magnesium », Journal of the American Chemical Society, vol. 102, no 1, , p. 217-226 (DOI 10.1021/ja00521a034, lire en ligne).
- (en) Henricus J. R. de Boer, Otto S. Akkerman et Friedrich Bickelhaupt, « Carbanions as Intermediates in the Synthesis of Grignard Reagents », Angewandte Chemie International Edition, vol. 27, no 5, , p. 687-689 (DOI 10.1002/anie.198806871, lire en ligne).
- (en) Gerard P. M. van Klink, Henricus J. R. de Boer, Gerrit Schat, Otto S. Akkerman, Friedrich Bickelhaupt et Anthony L. Spek, « Carbanions as Intermediates in the Formation of Grignard Reagents », Organometallics, vol. 21, no 10, , p. 2119-2135 (DOI 10.1021/om011083a, lire en ligne).
- (en) Paul Knochel, Wolfgang Dohle, Nina Gommermann, Florian F. Kneisel, Felix Kopp, Tobias Korn, Ioannis Sapountzis et Viet Anh Vu, « Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange », Angewandte Chemie International Edition, vol. 42, no 36, , p. 4302-4320 (PMID 14502700, DOI 10.1002/anie.200300579, lire en ligne).
- (en) Philip E. Rakita, « 5. Safe Handling Practices of Industrial Scale Grignard Ragents », Gary S. Silverman et Philip E. Rakita, Handbook of Grignard reagents, CRC Press, 1996, p. 79–88 (ISBN 0-8247-9545-8).
- (en) Yee-Hing Lai, « Grignard Reagents from Chemically Activated Magnesium », Synthesis, vol. 8, , p. 585-604 (DOI 10.1055/s-1981-29537, lire en ligne).
- Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, 2005, Librairie du Cèdre, 1re éd., p. 533 (ISBN 2-916346-00-7).
- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic press, 2005, p. 498 (ISBN 0-12-429785-4).
- (en) Rina Takahashi, « Mechanochemical synthesis of magnesium-based carbon nucleophiles in air and their use in organic synthesis »
 , sur Nature Communications, (consulté le ).
, sur Nature Communications, (consulté le ).
- (en) Arkady Krasovskiy et Paul Knochel, « Convenient Titration Method for Organometallic Zinc, Magnesium, and Lanthanide Reagents », Synthesis, vol. 5, , p. 0890-0891 (DOI 10.1055/s-2006-926345, lire en ligne).