1,4-Dioxane
| 1,4-Dioxane | |

| |
| 1-4-Dioxane | |
| Identification | |
|---|---|
| Nom UICPA | 1-4-Dioxane 1,4-Dioxacyclohexane |
| Synonymes |
Dioxyde de diéthylène |
| No CAS | |
| No ECHA | 100.004.239 |
| No CE | 204-661-8 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C4H8O2 [Isomères] |
| Masse molaire[2] | 88,105 1 ± 0,004 4 g/mol C 54,53 %, H 9,15 %, O 36,32 %, |
| Propriétés physiques | |
| T° fusion | 12 °C[1] |
| T° ébullition | 101 °C[1] |
| Paramètre de solubilité δ | 20,5 MPa1/2 (25 °C)[3]
19,7 J1/2·cm-3/2 (25 °C)[4] |
| Miscibilité | dans l'eau : miscible[1] |
| Masse volumique | 1,03 g·cm-3[1] |
| T° d'auto-inflammation | 180 °C[1] |
| Point d’éclair | 12 °C[1] |
| Limites d’explosivité dans l’air | 2–22,5 % vol[1] |
| Pression de vapeur saturante | 38 mbar à 20 °C 68 mbar à 30 °C 159 mbar à 50 °C |
| Point critique | 52,1 bar, 313,85 °C[5] |
| Précautions | |
| SGH[7] | |
| H225, H319, H335, H351, EUH019 et EUH066 |
|
| SIMDUT[8] | |
  B2, D2A, D2B, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[6] | |
| Inhalation | Maux de tête, nausées. Toux. Mal de gorge. Douleurs abdominales. Vertiges. Somnolence. Vomissements. Perte de conscience. |
| Peau | Rougeur. |
| Yeux | Rougeur. Douleur. Larmoiement. |
| Ingestion | (Voir Inhalation). |
| Écotoxicologie | |
| LogP | -0,42[1] |
| Seuil de l’odorat | bas : 0,8 ppm haut : 172 ppm[9] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le 1,4-dioxane est l'un des trois isomères du dioxane. C'est un solvant fortement suspecté d'être cancérigène chez l'homme et cancérigène avéré sur le rat. Il a été très utilisé, et notamment ajouté à certains solvants chlorés, dans la seconde partie du XXe siècle, pour les rendre plus stables. Il peut contaminer les nappes phréatiques et l'eau (tout en dégradant ses qualités organoleptiques)[10].

Propriétés[modifier | modifier le code]
- Concentration à saturation : 38 000 ppm
- Coefficient de partage (eau/huile) : 2,6
- Limite de détection olfactive : 24,00 ppm
- Facteur de conversion (ppm→mg/m³) : 3,603
- Taux d'évaporation (éther=1) : 5,8
Synthèse[modifier | modifier le code]
Le 1,4-dioxane peut être synthétisé à partir de l'époxyéthane. L'époxyéthane subit une hydratation (catalysée par un acide fort, acide sulfurique concentré par exemple) pour former de l'éthane-1,2-diol (glycol). Puis une substitution nucléophile bimoléculaire (SN2) est catalysée par un acide fort, entre deux molécules de glycol. Enfin, une SN2 intramoléculaire, toujours catalysée par un acide fort, est suivie d'une déprotonation.
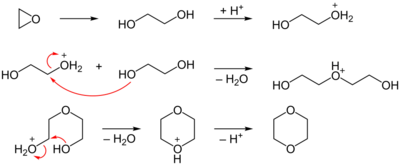
Utilisations[modifier | modifier le code]
Le 1,4-dioxane est avant tout utilisé dans des solvants pour le secteur de la manufacture.
On le trouve aussi dans certains fumigènes et liquides de refroidissement, et comme agent moussant.
C'est un sous-produit accidentel des procédés d'éthoxylation dans la fabrique de cosmétiques (déodorants, shampoings, dentifrice ou liquide pour bain de bouche) qu'il contamine alors.
Il est aussi utilisé comme solution-étalon pour calibrer des appareils de RMN, comme le tétraméthylsilane.
Également, le 1-4 Dioxane est le seul solvant connu qui puisse extraire le sodium présent dans un agrégat de sodium/oxyde de magnésium.
Toxicité[modifier | modifier le code]
Sa DL50 est de 5170 mg/kg chez le rat de laboratoire[11].
Il est irritant pour les yeux et les voies respiratoires et il peut endommager le système nerveux central, le foie et les reins[12].
Une étude (1978) sur la mortalité de travailleurs exposés au 1,4-dioxane a trouvé un nombre de décès par cancer non-significativement différent du nombre attendu[13].
En 2014 il était classé par le NIEHS comme «raisonnablement susceptibles d'être cancérogènes pour l'homme»[14] ; de même par le CIRC qui le classe cancérogène du groupe 2B (c'est-à-dire peut-être cancérogène pour l'homme car cancérogène connu chez d'autres animaux[15]. L'Agence de protection de l'environnement des États-Unis (EPA) le classe aussi comme un cancérogène probable chez l'homme (ayant observé une incidence accrue de cancer dans les études contrôlées sur les animaux, mais pas dans les études épidémiologiques sur les travailleurs utilisant ce composé) et comme irritant - dès 400 milligrammes par mètre cube), à des taux significativement plus élevées que ceux retrouvés dans les produits commercialisés pour le grand public[16]. Les études sur le rat suggèrent que le plus grand risque pour la santé est associé à l'inhalation de vapeurs pures[17],[18],[19].
Cancérogène[modifier | modifier le code]
Le 1,4-dioxane est cancérogène chez l'animal, il produit des tumeurs hépatiques et nasales. Il est classé cancérogène catégorie 3 par l'UE et dans le groupe 2B (cancerogène possible pour l'homme) par le CIRC[20].
Risque d'explosion[modifier | modifier le code]
Comme certains autres éthers, le dioxane se combine à l'oxygène de l'air lors d'une exposition prolongée à l'air pour former des peroxydes potentiellement explosifs. La distillation des dioxanes concentre ces peroxydes, augmentant le danger.
Polluant[modifier | modifier le code]
Ce polluant est assez souvent retrouvé sous (ou près) d'anciennes zones industrielles ayant utilisé des solvants (A la concentration de 1 μg/L (~ 1 ppb) il est fréquent dans les nappes des États-Unis1, 4-Dioxane Fact Sheet: Support Document" (PDF). OPPT Chemical Fact Sheets. United States Environmental Protection Agency. .
Il est fréquent dans les lixiviat de décharges : dans le seul État du New Hampshire, en 2010 il est encore retrouvé sur 67 sites testés (de 2 ppb à plus de 11 000 ppb dans la nappe) et trente de ces sites sont d'anciennes décharges de déchets solides, presque toutes fermés des années plus tôt[10].
Dans la nappe, le 1,4-dioxane se dégrade très mal et est plus mobile que les solvants chlorés qui l'accompagnent[10]. On a montré (2015) au Canada que le solvant chloré qui lui est le plus souvent associé est le TCA, aujourd'hui interdit, depuis 1996 au Québec (et moindrement le DCM) ; la présence de TCA et dcm dans la nappe est donc un indicateur probable de panaches de pollution de l'eau au 1,4-dioxane éventuellement loin vers l'aval du sens de circulation de la nappe[10].
Considéré comme faiblement toxique pour la vie aquatique, il peut être biodégradé dans les milieux superficiels par plusieurs voies, mais très peu dans la nappe où il persistera durant des décennies voir plus d'un siècle, et les problèmes qu'il y pose sont exacerbés par sa grande solubilité dans l'eau, et parce qu'il ne se lie pas facilement aux sols[10] ; il contamine donc facilement les eaux souterraines qui à leur tour peuvent polluer des sources ou des eaux destinées au réseau d'eau potable[10]. Pour ces raisons un panache de pollution par du dioxane qui était associé à un autre solvant peut être plus étendu que le panache de son solvant associé[10].
Contaminant de cosmétiques[modifier | modifier le code]
Comme sous-produit du processus d'éthoxylation (voie de production de nombreux ingrédients de produits nettoyants et dits hydratants), le dioxane peut les contaminer. On en a retrouvé dans des cosmétiques et produits de soins personnels tels que déodorants, parfums, shampooings, dentifrices et bains de bouche [21] [22]. L'éthoxylation rend des agents nettoyants courants tels que le laureth sulfate d'ammonium et le laureth sulfate de sodium moins abrasifs et plus moussants. Du 1,4-dioxane est présent à faible dose dans divers cosmétiques, et bien que probablement cancérigène, c'est une substance non réglementée dans les cosmétiques en Chine et aux États-Unis[21].
En 2008 une association de consommateurs (Organic Consumers Association) a révélé la présence de dioxane dans près de 50 % des produits de soins personnels bio qu'elle a testés[22].
Depuis 1979 la Food and Drug Administration (FDA) des États-Unis teste les matières premières cosmétiques et les produits finis pour y déterminer les taux de 1,4-dioxane[23]. Le 1,4-dioxane était présent dans de nombreux ingrédients bruts éthoxylés (jusqu'à 1410 ppm) et sans surprise retrouvé dans les cosmétiques du commerce (jusqu'à 279 ppm)[23] Plus de 85 ppm de 1?4 Dioxane ont été retrouvés dans des shampooings pour enfants, confirmant le besoin d'une surveillance étroite des matières premières et des produits finis[23], mais bien que la FDA encourage les fabricants à éliminer ce 1,4-dioxane, la loi fédérale ne l'exige pas[24].
Règlementation[modifier | modifier le code]
Dans les eaux souterraines prélevées pour fabriquer l'eau potable, le Japon a déterminé un seuil (norme) de 50 μg/L à ne pas dépasser[25]. En Australie, le National Industrial Chemicals Notification and Assessment Scheme concluait en 1998 que : « selon les résultats obtenus, le 1,4-dioxane peut être classifié comme étant pratiquement non toxique pour les micro-organismes, plantes et invertébrés aquatiques ainsi que sur les poissons. »[26].
Si l'OMS définit un seuil maximal de 50 µg/L dans l'eau potable (taux associée à un risque supplémentaire de cancer de 1·10-5 selon OMS (2005)[27], l'US-EPA préconise 0,35 µg/L[28].
Ni la France ni l'Union européenne ne règlementent la teneur en 1,4-dioxane de l'eau potable (EDCH). En France des taux de 2,4 µg/L sont relevés[29].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1,4-Dioxane » (voir la liste des auteurs).
- 1, 4 - DIOXANNE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Christian Reichardt, Solvents and Solvent Effects in Organic Chemistry, Weinheim, WILEY-VCH, , 3e éd., 629 p. (ISBN 3-527-30618-8), p. 66
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) « 1,4-Dioxane Evidence for Carcinogenicity », sur National Institutes of Health, (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Dioxane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- « 1,4-Dioxane », sur hazmap.nlm.nih.gov (consulté le )
- Houde H (2012) La problématique du 1,4-dioxane associé aux solvants chlorés dans le traitement de l'eau souterraine (Doctoral dissertation, Université de Sherbrooke).
- Surprenant K.S (2000) "Dioxane in Ullmann's Encyclopedia of Industrial Chemistry". doi:10.1002/14356007.a08_545
- "International Chemical Safety Card". National Institute for Occupational Safety and Health.
- "Mortality Follow-up of Workers Exposed to 1,4-Dioxane". American College of Occupational and Environmental Medicine. Retrieved 26 March 2016.
- "12th Report on Carcinogens". United States Department of Health and Human Services’ National Toxicology Program.
- IARC Monographs Volume 71 (PDF). International Agency for Research on Cancer
- 1,4-Dioxane (1,4-Diethyleneoxide). Hazard Summary. U.S. Environmental Protection Agency. Avril 1992. Fact Sheet.
- Kano, Hirokazu; Umeda, Yumi; Saito, Misae; Senoh, Hideki; Ohbayashi, Hisao; Aiso, Shigetoshi; Yamazaki, Kazunori; Nagano, Kasuke; Fukushima, Shoji (2008). "Thirteen-week oral toxicity of 1,4-dioxane in rats and mice". The Journal of toxicological sciences. 33 (2): 141–53. doi:10.2131/jts.33.141. .
- Kasai, T; Saito, M; Senoh, H; Umeda, Y; Aiso, S; Ohbayashi, H; Nishizawa, T; Nagano, K; Fukushima, S (2008). "Thirteen-week inhalation toxicity of 1,4-dioxane in rats". Inhalation toxicology. 20 (10): 961–71. doi:10.1080/08958370802105397. .
- Kasai T & al. (2009). "Two-year inhalation study of carcinogenicity and chronic toxicity of 1,4-dioxane in male rats". Inhalation toxicology. 21 (11): 889–97.
- « Fiche toxicologique n°28: 1,4-dioxane », INRS
- "Watchdog issues inspection results on Johnson & Johnson". China Daily. Xinhua. 21 March 2009.
- " Carcinogenic 1,4-Dioxane Found in Leading 'Organic' Brand Personal Care Products " (Communiqué de presse). Organic Consumers Association. 14 Mars 2008. Archive d'un document original faite le 24 Septembre 2010
- Black, RE; Hurley, FJ; Havery, DC (2001) "Occurrence of 1,4-dioxane in cosmetic raw materials and finished cosmetic products". Journal of AOAC International. 84 (3): 666–70.
- FDA/CFSAN--Cosmetics Handbook Part 3: Cosmetic Product-Related Regulatory Requirements and Health Hazard Issues. Prohibited Ingredients and other Hazardous Substances: 9. Dioxane
- Ministry of Health Labour and Welfare (MHLW) (2010). Diagram13 Drinking Water Quality Standards (April 2010-). In Japan. Ministry of Health, Labour and Welfare. Welcome to Ministry of Health, Labour and Welfare, Consulter en ligne
- National Industrial Chemicals Notification and Assessment Scheme (NICNAS) (1998). 1,4-Dioxane Priority Existing Chemical No. 7. In Australian Gouvernment, Department of Health and Ageing. NICNAS - National Industrial Chemicals Notification and Assessment Scheme http://www.nicnas.gov.au/publications/car/pec/pec7/pec7_full_report_pdf.pdf
- Organisation mondiale de la santé (OMS) (2005). 1,4-Dioxane in Drinking-water. Background document for development of WHO Guidelines for Drinking-water Quality. In WHO. WHO World Health Organization | http://www.who.int/water_sanitation_health/dwq/chemicals/14dioxane0505.pdf .
- LIBERATION, « Eau potable : le dioxane, cancérogène possible, détecté dans plusieurs régions françaises », Libération, (lire en ligne, consulté le ).
- https://www.anses.fr/fr/system/files/LABORATOIRE2022AST0255Ra.pdf
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- CSST (canada) fiche de la commission de la santé et de la sécurité au travail
- Houde H (2012) La problématique du 1,4-dioxane associé aux solvants chlorés dans le traitement de l'eau souterraine (Doctoral dissertation, Université de Sherbrooke).





