Diéthylphosphite
| Diéthylphosphite | |
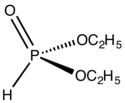
| |
| Structure du diéthylphosphite | |
| Identification | |
|---|---|
| Synonymes |
phosphonate de diéthyle |
| No CAS | |
| No ECHA | 100.010.992 |
| No CE | 212-091-6 |
| No RTECS | TG7875000 |
| PubChem | 6327654 |
| ChEBI | 41962 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore[1] |
| Propriétés chimiques | |
| Formule | C4H10O3P |
| Masse molaire[2] | 137,094 2 ± 0,004 8 g/mol C 35,04 %, H 7,35 %, O 35,01 %, P 22,59 %, |
| Propriétés physiques | |
| T° fusion | −70 °C[1] |
| T° ébullition | 188 °C[1] |
| Solubilité | s'hydrolyse dans l'eau |
| Masse volumique | 1,07 g·cm-3[1] à 20 °C |
| T° d'auto-inflammation | 230 °C[1] |
| Point d’éclair | 74 °C[1] |
| Limites d’explosivité dans l’air | entre 3,8 % et 12,8 % en volume |
| Pression de vapeur saturante | < 3 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
| H317, H318, P261, P280, P302+P352 et P305+P351+P338 |
|
| NFPA 704[3] | |
| Écotoxicologie | |
| DL50 | 3 900 mg·kg-1[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le diéthylphosphite est un composé organophosphoré de formule chimique (CH3CH2O)2P(O)H, également écrite (EtO)2P(O)H. Il se présente sous la forme d'un liquide incolore qui s'hydrolyse dans l'eau. La grande réactivité de sa liaison P–H est exploitée couramment pour obtenir d'autres composés organophosphorés. La molécule présente une géométrie tétraédrique.
Préparation et propriétés[modifier | modifier le code]
Le diéthylphosphite a probablement été produit pour la première fois dans les années 1850 à partir de trichlorure de phosphore PCl3 et d'éthanol CH3CH2OH, mais sa préparation intentionnelle a été plus tardive. La réaction peut être écrite de la manière suivante[4] :
De nombreux dérivés peuvent être obtenus de la même manière[5],[6].
Bien qu'il soit désigné comme phosphite (CH3CH2O)2POH, le diéthylphosphite se présente dans presque tous les cas sous forme de phosphonate (CH3CH2O)2P(O)H, à l'instar de l'acide phosphoreux (HO)2P(O)H. De nombreuses réactions du diéthylphosphite ne peuvent cependant s'expliquer que par un équilibre entre les tautomères à phosphore(III) et à phosphore(V) :
- (CH3CH2O)2PV(O)H (CH3CH2O)2PIII(OH).
Réactions[modifier | modifier le code]
Transestérification[modifier | modifier le code]
La diéthylphosphite subit une transestérification sous l'effet d'un alcool. Pour les alcools à point d'ébullition élevé, la réaction peut être favorisée par l'élimination de l'éthanol CH3CH2OH libéré[7] :
De même, les amines peuvent déplacer l'un des groupes éthoxyle[8] :
Alkylation sur l'atome de phosphore[modifier | modifier le code]
Le diéthylphosphite est déprotoné par le tert-butylate de potassium (CH3)3COK, ce qui permet l'alkylation du composé sur l'atome de phosphore après libération de tert-butanol (CH3)3COH[9] :
- (CH3CH2O)2P(O)H + (CH3)3COK ⟶ (CH3CH2O)2P(O)K + (CH3)3COH ;
- (CH3CH2O)2P(O)K + RBr ⟶ (CH3CH2O)2P(O)R + KBr, où R représente un alkyle.
Des catalyseurs au palladium permettent de traiter des halogénures d'aryle[10]. Le mécanisme de couplage C–P confère une analogie avec la réaction de Buchwald-Hartwig.
La réaction du diéthylphosphite avec des réactifs de Grignard conduit à une déprotonation initiale suivie par le déplacement des groupes éthoxyle[11],[12]. Ceci ouvre la voie à la synthèse d'oxydes de phosphines secondaires telles que l'oxyde de diméthylphosphine (CH3)2P(O)H, comme illustré par les réactions idéalisées ci-dessous :
- (CH3CH2O)2P(O)H + CH3MgBr ⟶ (CH3CH2O)2P(O)MgBr + CH4 ;
- (CH3CH2O)2P(O)MgBr + 2 CH3MgBr ⟶ (CH3O)2P(O)MgBr + 2 CH3CH2OMgBr ;
- (CH3O)2P(O)MgBr + H2O ⟶ (CH3)2P(O)H + HOMgBr.
Hydrophosphonylation[modifier | modifier le code]
Le diéthylphosphite peut s'additionner sur des groupes insaturés par hydrophosphonylation (en). Il s'additionne par exemple sur les aldéhydes de manière semblable à la réaction d'Abramov (en) :
- (CH3CH2O)2P(O)H + RCHO ⟶ (CH3CH2O)2P(O)CH(OH)R.
Avec les imines, il se forme des aminophosphonates (en) par la réaction de Pudovik (en) et la réaction de Kabachnik-Fields (en)[13].
Notes et références[modifier | modifier le code]
- Entrée « Diethyl phosphite » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 février 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Diethyl phosphite, 97+% », sur Alfa Aesar (consulté le ).
- (en) J. E. Malowan,T. P. Traise et T. M. Beck, « Diethyl Phosphite », Inorganic Syntheses, vol. 4, (DOI 10.1002/9780470132357.ch19, lire en ligne)
- (en) Leandro Pedrosa, « Esterification of Phosphorus Trichloride with Alcohols; Diisopropyl phosphonate », ChemSpider Synthetic Pages, Royal Society of Chemistry, , SyntheticPage 488 (DOI 10.1039/SP488, lire en ligne)
- (en) H. Fakhraian et A. Mirzaei, « Reconsideration of the Base-Free Batch-Wise Esterification of Phosphorus Trichloride with Alcohols », Organic Process Research & Development, vol. 8, no 3, , p. 401-404 (DOI 10.1021/op049958v, lire en ligne)
- (en) John E. Malowan, T. P. Traise et A. D. F. Toy, « Dioctyl Phosphite », Inorganic Syntheses, vol. 4, (DOI 10.1002/9780470132357.ch20, lire en ligne)
- (en) John M. Read, Yu-Pu Wang, Rick L. Danheiser, Erik Daa Funder et Erick M. Carreira, « Synthesis of Phosphoryl Ynamides by Copper-Catalyzed Alkynylation of Phosphoramidates. Preparation of Diethyl benzyl(oct-1-yn-1-yl)phosphoramidate », Organic Syntheses, vol. 92, , p. 156-170 (DOI 10.15227/orgsyn.092.0156, orgsyn.org/Content/pdfs/procedures/v92p0156.pdf)
- (en) Robert K. Boeckman, Jr., Robert B. Perni, James E. Macdonald, Anthony J. Thomas, Stacey C. Slater et James D. White, « 6-Diethylphosphonomethyl-2,2-dimethyl-1,3-dioxen-4-one [Phosphonic acid, [(2,2-dimethyl-4-oxo-4H-1,3-dioxin-6-yl)methyl]-, diethyl ester] », Organic Syntheses, vol. 66, , p. 194 (DOI 10.15227/orgsyn.066.0194, lire en ligne)
- (en) Kenneth Green, « Diethyl Phosphonite », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd211, lire en ligne)
- (en) Hugh R. Hays, « Reaction of diethyl phosphonate with methyl and ethyl Grignard reagents », The Journal of Organic Chemistry, vol. 33, no 10, , p. 3690-3694 (DOI 10.1021/jo01274a003, lire en ligne)
- (en) Carl A. Busacca, Jon C. Lorenz, Paul Sabila, Nizar Haddad, Chris H. Senanayake, Scott E. Denmark et Christopher S. Regens, « Synthesis of Electron-Deficient Secondary Phosphine Oxides and Secondary Phosphines: Bis[3,5-bis(trifluoromethyl)phenyl]phosphine Oxide and Bis[3,5-bis(trifluoromethyl)phenyl]phosphine », Organic Syntheses, vol. 84, , p. 242 (DOI 10.15227/orgsyn.084.0242, orgsyn.org/Content/pdfs/procedures/v84p0242.pdf)
- (en) György Keglevich et Erika Bálint, « The Kabachnik–Fields Reaction: Mechanism and Synthetic Use », Moelcules, vol. 17, no 11, , p. 12821-12835 (PMID 23117425, PMCID 6268146, DOI 10.3390/molecules171112821, lire en ligne)




