Quinoléine
| Quinoléine | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Synonymes |
Benzo(b)pyridine |
||
| No CAS | |||
| No ECHA | 100.001.865 | ||
| No CE | 202-051-6 | ||
| PubChem | 7047 | ||
| No E | E104 | ||
| FEMA | 3470 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide hygroscopique incolore, d'odeur caractéristique. brunit lors d'exposition à la lumière[1]. | ||
| Propriétés chimiques | |||
| Formule | C9H7N [Isomères] |
||
| Masse molaire[4] | 129,158 6 ± 0,007 9 g/mol C 83,69 %, H 5,46 %, N 10,84 %, |
||
| Moment dipolaire | 2,29 ± 0,11 D[2] | ||
| Diamètre moléculaire | 0,623 nm[3] | ||
| Propriétés physiques | |||
| T° fusion | −15 °C[1] | ||
| T° ébullition | 237,7 °C à 760 mmHg 163,2 °C à 100 mmHg 136,7 °C à 40 mmHg 119,8 °C à 20 mmHg 103,8 °C à 10 mmHg 89,6 °C à 5 mmHg 59,7 °C à 1,0 mmHg |
||
| Solubilité | Peu sol dans l'eau froide. Sol dans l'eau chaude. Miscible avec l'éther, l'éthanol, le disulfure de carbone. Dissout le soufre, le phosphore, le trioxyde d'arsenic. |
||
| Paramètre de solubilité δ | 22,1 MPa1/2 (25 °C)[5] | ||
| Masse volumique | 1,093 g·ml-1 à 25 °C | ||
| T° d'auto-inflammation | 480 °C[1] | ||
| Point d’éclair | 105 °C[1] | ||
| Limites d’explosivité dans l’air | 1,2–7 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 100 Pa[1] | ||
| Point critique | 508,85 °C[6] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | 1,624[3] | ||
| Précautions | |||
| SIMDUT[8] | |||
Produit non classé |
|||
| NFPA 704 | |||
| Directive 67/548/EEC | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 460 mg·kg-1 (rat, oral) | ||
| LogP | 2,06[1] | ||
| Seuil de l’odorat | bas : 71 ppm[9] | ||
| Considérations thérapeutiques | |||
| Classe thérapeutique | antipaludique | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
| Sulfate de quinoléine | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.001.865 |
| No CE | 208-492-0 |
| Apparence | poudre cristalline blanche à gris-blanc |
| Propriétés chimiques | |
| Formule | C9H9NO4S |
| Masse molaire[10] | 227,237 ± 0,014 g/mol C 47,57 %, H 3,99 %, N 6,16 %, O 28,16 %, S 14,11 %, |
| Propriétés physiques | |
| T° fusion | 163 à 165 °C |
| Solubilité | 1–5 mg·ml-1 eau à 20 °C. 1 g/50ml éthanol absolu froid, 1 g/9ml éthanol absolu bouillant |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Chlorure de quinoléine | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.001.865 |
| No CE | 208-489-4 |
| PubChem | 68264 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs déliquescents |
| Propriétés chimiques | |
| Formule | C9H8ClN |
| Masse molaire[11] | 165,62 ± 0,01 g/mol C 65,27 %, H 4,87 %, Cl 21,41 %, N 8,46 %, |
| Propriétés physiques | |
| T° ébullition | 234,1 °C à 760 mmHg |
| Solubilité | Sol dans l'eau, l'éthanol, le benzène chaud, le chloroforme. Peu sol dans l'éther froid. |
| Point d’éclair | 101,1 °C |
| Pression de vapeur saturante | 0,082 2 mmHg à 25 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Salicylate de quinoléine | |
| Identification | |
|---|---|
| No ECHA | 100.001.865 |
| PubChem | 11529111 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline rouge-gris |
| Propriétés chimiques | |
| Formule | C16H13NO3 [Isomères] |
| Masse molaire[12] | 267,279 3 ± 0,014 8 g/mol C 71,9 %, H 4,9 %, N 5,24 %, O 17,96 %, |
| Propriétés physiques | |
| T° ébullition | 234,1 °C à 760 mmHg |
| Solubilité | Sol dans 80 parts d'eau. Sol dans l'éthanol, le benzène, l'éther, le glycérol, les huiles |
| Point d’éclair | 101,1 °C |
| Pression de vapeur saturante | 0,082 2 mmHg à 25 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Tartrate de quinoléine | |
| Identification | |
|---|---|
| No ECHA | 100.001.865 |
| Apparence | cristaux blancs |
| Propriétés chimiques | |
| Formule | C43H45N3O24 |
| Masse molaire[13] | 987,823 1 ± 0,045 4 g/mol C 52,28 %, H 4,59 %, N 4,25 %, O 38,87 %, |
| Propriétés physiques | |
| T° fusion | décomposition à 125 °C |
| Solubilité | Sol dans 80 parts d'eau, 150 parts d'éthanol. Insol dans l'éther |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
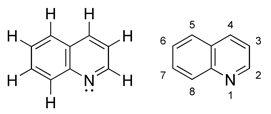
La quinoléine, également nommée leucoline, 1-azanaphthalène, 1-benzazine, ou benzo[b]pyridine, est un composé organique aromatique hétérocyclique de formule chimique C9H7N. Elle peut être décrite schématiquement comme étant formée par la "soudure" d'une molécule de benzène et d'une molécule de pyridine. C'est un liquide incolore hygroscopique possédant une odeur forte.
Propriétés physico-chimiques
La quinoléine est peu soluble dans l'eau, mais sa solubilité dans les solvants organiques est bonne. Lorsqu'elle est exposée à la lumière, elle devient jaune, puis brune. C'est une base très faible de pKa 4,94.
Découverte
La quinoléine a été extraite pour la première fois par F. Runge en 1834 du goudron de houille dans lequel elle est naturellement présente. Runge extrait de la houille trois huiles qu'il nomma selon leur coloration à la chaux : le Kyanol ou Blauöl (huile bleue, aniline), le Pyrrol ou Rothöl (huile rouge, pyrrole) et le Leukol ou Weissöl (huile blanche). Peu de temps plus tard, en 1842, Charles Frédéric Gerhardt obtint par distillation alcaline de la quinine une huile incolore qu'il appela d'abord Chinoilin (huile de quinine), puis Chinolein. Celle-ci s'avéra identique au Leukol de Runge et donna par la suite son nom au composé. Comme cette huile pouvait facilement s'obtenir en grandes quantités à partir de la houille, la chimie de synthèse avec pour objet le développement d'analogues de la quinine tels que la chloroquine fut grandement favorisée.
La quinoléine est également présente naturellement dans les Rutaceae poussant en Amérique du Sud, ainsi que, fait rarissime dans le monde animal, chez certains phasmes (Insecta - Phasmatodea) comme Oreophoetes peruana (Saussure, 1868), également connu sous le nom de Phasme du Pérou, qui secrète s'il est dérangé un liquide blanc riche en quinoléine par deux glandes située sur le prothorax.
Production
Elle peut être synthétisée par une méthode connue sous le nom de synthèse de Skraup, à partir de sulfate de fer(II), de glycérol, d'aniline, de nitrobenzène et d'acide sulfurique. Elle peut aussi être préparé par la réaction de Povarov à partir d'aniline, de benzaldéhyde et d'un alcène activé. D'autres méthodes de synthèse existent qui sont des dérivés de la synthèse de Skraup qui utilisent des agents d'oxydation différents.
Utilisation
La quinoléine est utilisée dans des procédés métallurgiques, ainsi que dans la fabrication de polymères, de colorants et de produits agrochimiques. Elle est également utilisée comme solvant, comme désinfectant et comme conservateur alimentaire, par exemple E324 (Ethoxyquine) est un conservateur et pesticide de la famille de la quinoléine.
Le colorant jaune de quinoléine est codé E104 et répertorié comme colorant alimentaire par le Codex Alimentarius. Plusieurs médicaments ou composés à propriétés pharmaceutiques potentielles comportent le motif de base quinoléine.
Sécurité
La quinoléine est toxique. Une exposition courte à ses vapeurs peut entraîner une irritation du nez, des yeux et de la gorge, ainsi que des vertiges et la nausée. Les effets à long terme sont moins bien connus, mais des études ont mis en évidence un lien entre la quinoléine et des affections du foie. Elle pourrait également avoir un effet cancérogène et mutagène.
- R: 20 (Nocif par inhalation)
- R: 21 (Nocif par contact avec la peau)
- R: 22 (Nocif en cas d’ingestion)
- R: 36 (Irritant pour les yeux)
- R: 37 (Irritant pour les voies respiratoires)
- R: 38 (Irritant pour la peau)
- R: 41 (Risque de lésions oculaires graves)
- R: 40 (Effet cancérogène suspecté : preuves insuffisantes)
- S: 26 (En cas de contact avec les yeux, laver immédiatement consulter un ophtalmologiste)
- S: 23 (Ne pas respirer les gaz/fumées/vapeurs/aérosols (terme(s) approprié(s) à indiquer par le fabricant))
- S: 36 (Porter un vêtement de protection approprié)
Notes et références
- QUINOLEINE, Fiches internationales de sécurité chimique
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-859-4)
- « Quinoléine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Quinoline », sur hazmap.nlm.nih.gov (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Voir aussi
Articles connexes
- Benzène
- Pyridine
- Isoquinoline (analogue de la quinoléine pour lequel l'atome d'azote est en position 2)
- Naphtalène (analogue de la quinoléine sans l'atome d'azote)






