IRM cardiaque
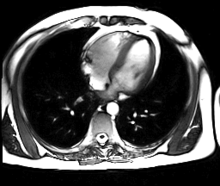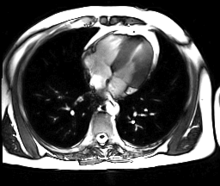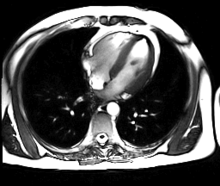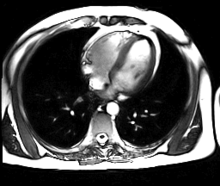
L’IRM cardiaque est un procédé d’imagerie médicale reposant sur l’excitation des noyaux d’hydrogène de l’organisme par impulsion de radiofréquences (imagerie par résonance magnétique), qui permet d’obtenir une image des organes intra-thoraciques sans limitation liée à la composition des tissus.
Contrairement à l’échocardiographie pour laquelle la pénétration du faisceau d’ultrasons dans les tissus est entravée par l’interposition de tissu pulmonaire ventilé, empêchant une évaluation cardiaque satisfaisante chez environ 10 % des patients, l’IRM cardiaque procure des images diagnostiques chez tous les patients, indépendamment de leur morphologie. L’acquisition d’un large champ de vision (field of view, FOV) permet une évaluation des structures thoraciques en plus de l’examen du cœur et des gros vaisseaux. L’IRM acquiert des images dans n’importe quel plan anatomique déterminé par l’opérateur, ce qui permet une imagerie adaptée à l’anatomie complexe du cœur et en particulier une évaluation morphologique dirigée des cardiopathies congénitales. Une caractéristique déterminante de l’IRM en cardiologie est sa capacité à caractériser les tissus mous pour détecter les pathologies du myocarde ; schématiquement, on utilisera les séquences en pondération T1 pour rechercher la présence de graisse, les séquences en pondération T2 pour l’œdème myocardique, et le rehaussement tardif après injection de gadolinium (T1) pour la fibrose myocardique.
En comparaison avec l’IRM d’organes statiques (par exemple l’IRM cérébrale), les défis de l’IRM cardiaque sont de représenter avec une définition maximale un organe se contractant de façon rythmique, et se déplaçant dans la cage thoracique tout au long du cycle respiratoire. Ces contraintes ont rendu nécessaire le développement de séquences d’acquisition rapides, synchronisées à l’électrocardiogramme, d’une durée de 15 à 20 secondes afin de permettre une acquisition en apnée. Il est de ce fait difficile d’obtenir des images de qualité chez un patient très dyspnéique ou incapable d’effectuer des apnées répétées. De façon analogue, un rythme cardiaque rapide (>100 bpm) ou très irrégulier (notamment en cas de fibrillation auriculaire, rythme bigéminé ou fréquentes extrasystoles), ou un signal ECG de mauvaise qualité réduisent sensiblement la définition des images. Le temps total d’acquisition d’un protocole standard d’IRM cardiaque varie entre 30 et 60 minutes. Il dure sensiblement plus longtemps qu’un scanner cardiaque mais l’absence de rayons X est un bénéfice notable pour le patient, en particulier si des examens répétés sont à envisager. La station prolongée dans le tunnel de l’IRM peut être problématique pour les patients claustrophobes (environ 2 % des patients), et reste contre-indiquée pour les porteurs de certains pacemaker, défibrillateurs implantables, implants cochléaires ou clips neurochirurgicaux. Il est recommandé de contrôler la compatibilité IRM des appareils ou prothèses implantées chirurgicalement[1].
L’injection de produit de contraste, gadolinium chélaté, est en principe contre-indiquée pour les patients avec insuffisance rénale sévère (débit de filtration glomérulaire estimée inférieure à 30 ml·min-1)[2] en raison du risque de fibrose systémique néphrogénique, une maladie invalidante de la peau, ressemblant à la sclérodermie[3],[4]. Ce risque a été très fortement diminué et pourrait même disparaître avec le recours à des produits de contraste dits cycliques. Les chélates de gadolinium sont également contre-indiqué de principe chez la femme enceinte.
Techniques d’IRM et séquences[modifier | modifier le code]
Analyse de la morphologie[modifier | modifier le code]
Écho de spin : images « sang noir »[modifier | modifier le code]
Une série de 10 à 15 coupes transverses de 5 à 10 mm d’épaisseur, avec espace entre les coupes de 0 à 5 mm, acquise durant la diastase (acquisition en phase unique), permet l’évaluation initiale de l’anatomie thoracique ainsi que de la disposition des cavités cardiaques et de leurs connexions. En cas d’anatomie complexe, on y ajoute fréquemment une série de coupes sagittales et une série de coupes coronales afin de mieux préciser les relations anatomiques. Une série de coupes sagittales obliques est parfois nécessaire pour préciser l’anatomie de l’arche aortique. La séquence utilisée est le « turbo spin echo », une séquence d’écho de spin rapide dont le train d’écho comporte entre 9 et 15 impulsions de rephasage de 180°, produisant à chaque rephasage un écho, réalisant une ligne d’encodage de phase différente. La séquence est précédée d’une double impulsion d’inversion (180°), l’une non sélective et la seconde sélective à la coupe, permettant d’annuler le signal du sang circulant[5],[6]. Ces images sont caractérisées par une forte pondération en T1 avec un excellent contraste entre le pool sanguin, hypo-intense (noir), et les structures vasculaires et musculaires, plus intenses. On parle donc de séquences en sang noir ou black blood. La durée d’acquisition de ce type de séquences est relativement longue, car la répétition d’impulsions de radiofréquence (impulsions d’inversion de 180°) est nécessaire pour rephaser le signal et produire un écho ; en contrepartie, cette séquence est peu sensibles aux artefacts de susceptibilité que peuvent causer les structures métalliques (stents, cerclages de sternotomie médiane…). Le contraste entre le sang circulant et la paroi vasculaire est en général bonne, mais l’annulation du signal sanguin peut être imparfaite (pool sanguin incomplètement noirci) dans les cavités où le flux sanguin est ralenti (veines pulmonaires ou systémiques, conduits veineux obstrués, thromboses, ventricule fortement dilaté…) pouvant résulter en une mauvaise délimitation endothéliale.
Séquences bSSFP : images « sang clair »[modifier | modifier le code]
Dans le cas où les images en « sang noir » sont équivoques, la morphologie peut être précisée en répétant les mêmes séries de coupes axiales, sagittales et coronales en utilisant une séquence en écho de gradient de type bSSFP (balanced steady-state free precession), particulièrement peu susceptible aux artefacts de flux. Il s’agit d’une séquence d’acquisition très rapide en mode de phase unique, qui produit un signal d’écho sans appliquer d’impulsion de rephasage, mais en inversant simplement la direction du gradient d’encodage de fréquence. L’inversion du gradient de champ magnétique étant nettement plus rapide que l’application d’une nouvelle impulsion de radiofréquence, ces séquences de type écho de gradient permettent d’accélérer sensiblement la production des signaux et l’acquisition des données. La bSSFP est la séquence d’écho de gradient la plus utilisée en IRM cardiaque en raison de son contraste élevé et de son important rapport signal / bruit. Le contraste est fonction du rapport T2/T1 des tissus ; le sang présent dans la cavité ventriculaire apparaît donc clair, avec une excellente délimitation endothéliale, indépendamment du flux sanguin[7]. On parle d’imagerie en « sang clair » ou bright blood. Cette séquence, comme toutes les séquences d’écho de gradient, est en revanche susceptible aux inhomogénéités du champ magnétique et l’on observe fréquemment une perte de signal (signal void) au voisinage des stents ou d’autres structures métalliques.
Acquisition tridimensionnelle bSSFP[modifier | modifier le code]
Alternativement, il est possible d’obtenir une évaluation anatomique des structures cardiaques non pas par séries de coupes successives, mais par l’acquisition directe d’un volume qu’il sera possible d’interroger à loisir dans différents plans au moment de l’analyse. Pour permettre ces reconstructions et garantir une résolution spatiale suffisante, il est primordial d’acquérir des voxels isotropiques, c’est-à-dire ayant la même dimension dans les trois plans. Les coupes standard ont une résolution de 1-2 x 1–2 mm dans le plan et une épaisseur de coupe de 8 à 10 mm produisant des voxels en forme de parallélépipèdes rectangles. L’acquisition volumétrique implique un encodage de phase dans deux directions différentes, rallongeant sensiblement le temps d’acquisition ; avec l’utilisation de séquences rapides de type bSSFP, le temps d’acquisition du volume cardiaque est de l’ordre de 3 à 4 minutes pour une résolution isotropique de 2,1 mm[8]. L’acquisition se fait en respiration libre, et les artefacts de mouvement liés à l’excursion diaphragmatique sont réduits par l’utilisation d’un navigateur, une séquence IRM rapide détectant au début de chaque cycle cardiaque la position de la coupole droite du diaphragme : l’acquisition de données du volume cardiaque ne sera pratiquée que durant les cycles cardiaques coïncidant avec un diaphragme en position d’expirium. Les techniques 3D sont principalement utilisées pour l’analyse des cardiopathies congénitales[9], ainsi que pour évaluer la morphologie et le trajet épicardiques des artères coronaires[10].
Analyse de la fonction cardiaque[modifier | modifier le code]
Séquences ciné bSSFP des ventricules[modifier | modifier le code]
La rapidité et le remarquable contraste que les séquences ciné bSSFP des ventricules[11] procurent entre le muscle cardiaque et le sang circulant font de ces séquences en écho de gradient la séquence de choix pour l’évaluation de la fonction des ventricules. Au contraire des images morphologiques, statiques, il s’agit d’une acquisition multi-phases de la même coupe myocardique (habituellement entre 25 et 35 phases par cycle cardiaque, en fonction de l’intervalle RR) permettant d’obtenir une image en mouvement – ou coupe ciné du ventricule. Ce type d’acquisition s’effectue sur plusieurs cycles cardiaques et requiert une apnée de 10 à 20 secondes. Il ne s’agit donc pas d’une imagerie en temps réel, contrairement à l’échocardiographie. La résolution spatiale, la définition de l’endocarde et la reproductibilité de la méthode sont en revanche supérieures en IRM, faisant d’elle le procédé d’imagerie de choix pour l’évaluation des volumes, de la masse et de la fonction ventriculaire (fraction d'éjection) par méthode de Simpson modifiée. L’avantage de l’IRM est d’autant plus évident dans l’évaluation du ventricule droit, difficile à visualiser entièrement en échocardiographie.
Typiquement, on acquiert des images caractérisées par une épaisseur de coupe de 8 à 10 mm avec espacement de 0 à 2 mm, une résolution dans le plan de 1-2 x 1 à 2 mm et une résolution temporelle de l’ordre de 40 à 60 ms. Pour le ventricule gauche, les coupes standard sont la vue 4 cavités, 2 cavités et 3 cavités ou vue de la chambre de chasse. Un plan orthogonal à la vue 3 cavités est acquise afin de compléter l’évaluation de la chambre de chasse gauche et de la valve aortique. On effectue ensuite une série de 8 à 12 coupes en court axe des ventricules, parallèles au plan atrio-ventriculaire, couvrant tout le volume ventriculaire de la base à l’apex. Pour le ventricule droit, on effectue une vue 2 cavités en traçant un axe perpendiculaire à la vue 4 cavités et reliant le milieu de l’anneau tricuspide à l’apex du ventricule droit. Une vue simultanée de la chambre de réception et de la chambre de chasse du ventricule droit peut ensuite être construite, de même qu’une seconde vue orthogonale de la chambre de chasse droite, permettant l’évaluation de la valve pulmonaire. On ajoute une série de coupes ciné axiales pures destinées à rechercher des anomalies segmentaires de la contraction de la paroi libre du ventricule droit, notamment en cas de suspicion de dysplasie arythmogène du ventricule droit. Dans le cas de cardiopathies congénitales, on ajoutera au besoin des coupes ciné supplémentaires, dont l’orientation sera adaptée à l’anatomie particulière du patient. Les vues utiles dans ce contexte sont par exemple les coupes des artères pulmonaires afin d’en évaluer le diamètre et la pulsatilité dans les tétralogies de Fallot opérées, et l’évaluation morphologique des conduits veineux dans les circulations de type Fontan, ou après la correction d’une transposition des gros vaisseaux par opération de Senning ou Mustard. En cas de suspicion de communication inter-auriculaire, l’acquisition d’une série de coupes ciné des oreillettes, parallèles au plan atrio-ventriculaire, est recommandée ; comme principe général dans les acquisitions destinées à rechercher une communication anormale entre deux cavités cardiaques, on choisira une épaisseur de coupe plus fine (5 à 8 mm) sans espace entre les coupes.
Séquences ciné ultra-rapides en respiration libre[modifier | modifier le code]
Ces séquences consistent à acquérir une coupe ciné complète du cœur en temps réel sans synchronisation à l’ECG. La séquence est de type bSSFP couplée à des techniques d’imagerie parallèle afin d’accélérer la vitesse d’acquisition. Inévitablement, les images produites ont une faible définition mais ont l’avantage de pouvoir évaluer les modifications de la contraction ventriculaire au cours du cycle respiratoire. La résolution temporelle est de l’ordre de 50-70 ms pour une résolution spatiale dans le plan de 2–3 x 2–3 mm. L’acquisition dure environ 20 secondes, s’étalant sur trois cycles respiratoires. Ces séquences trouvent leur utilité dans la recherche d’interférence entre le ventricule droit et le ventricule gauche en cas de suspicion de constriction péricardique[12].
Caractérisation tissulaire sans injection de produit de contraste[modifier | modifier le code]
Images en pondération T1[modifier | modifier le code]
Il s’agit d’images morphologiques fixes acquises en diastole. La séquence utilisée est un écho de spin avec double pré-impulsion d’inversion destinée à annuler le signal du sang circulant (« sang noir »), identique à la séquence utilisée pour les séries de coupes morphologiques décrites ci-dessus. On l’applique en général sur des coupes en 4 cavités et en court axe, mais on peut y ajouter d’autres coupes adaptées à l’anatomie du patient, notamment pour mieux caractériser une tumeur myocardique. Alors que le signal du sang circulant est annulé et apparaît noir, la graisse, caractérisée par un temps de relaxation T1 court, apparaît hyperintense et le muscle cardiaque est d’intensité intermédiaire. Cette séquence trouve son utilité dans la caractérisation des masses et tumeurs myocardiques (intensité différente entre la tumeur et le muscle cardiaque normal, signal hyperintense caractéristique du lipome), dans la recherche d’une infiltration graisseuse du myocarde (cas avancés de dysplasie arythmogène du ventricule droit, transformation adipeuse d’une cicatrice d’infarctus), ainsi qu’en cas de pathologie péricardique (mesure de l’épaisseur du péricarde, hypo-intense et bordé par deux lignes hyperintenses de graisse épicardique et péricardique). À noter que la présence de graisse peut être confirmée en répétant la même séquence, précédée d’une pré-impulsion destinée à supprimer le signal du tissu adipeux (impulsion d’inversion standard (STIR : short tau inversion recovery) ou sélective au spectre de fréquence du tissu adipeux (SPIR : spatial inversion recovery) ; TI 120-150 ms). Sur ces séquences de saturation de graisse (séquences en triple inversion), le signal hyperintense visualisé sur la séquence T1 standard est spécifiquement annulé et apparaît hypo-intense.
Images en pondération T2[modifier | modifier le code]
Il s’agit d’images morphologiques fixes acquises en diastole. Cette séquence d’écho de spin est destinée à mettre en évidence les structures liquidiennes, tirant parti du temps de relaxation T2 particulièrement long de l’eau. Cette séquence, caractérisée par un temps de répétition (TR) prolongé, classiquement de deux intervalles RR, et d’un temps d’écho (TE) élevé, de l’ordre de 80 ms, est d’acquisition relativement longue. Pour en accélérer l’acquisition à 15-20 secondes, on utilise, comme pour les séquences pondérées en T1, la technique de turbo spin echo consistant à appliquer plusieurs impulsions d’inversion de 180° après l’écho initial afin de créer de multiples échos durant le même intervalle TR. Contrairement aux séquences T2 classiques (c’est-à-dire n’utilisant pas le turbo), pratiquées notamment en imagerie cérébrale, la séquence T2 en turbo spin echo tend à créer un signal paradoxalement hyperintense pour la graisse en raison d’interactions spin-spin particulières dans ce tissu (J-coupling), nécessitant d’y associer une pré-impulsion de saturation de graisse (séquence T2-STIR[13]). Cette séquence détecte l’œdème intramyocardique, notamment dans le contexte d’infarctus myocardique aigu ou de myocardite ; il se traduit par un signal hyperintense comparé au signal du myocarde sain. Un tel signal hyperintense en T2 peut également s’observer dans les tumeurs myocardiques mitotiquement actives, associée à de l’œdème tumoral, ou dans le myxome de l’oreillette, de composition riche en eau.
Surcharge en fer et hémochromatose[modifier | modifier le code]
En raison de ses propriétés ferromagnétiques, le fer présent dans les tissus engendre des inhomogénéités du champ magnétique. Ces inhomogénéités induisent une accélération du déphasage du spin des protons après impulsion de radiofréquence, résultant en une dégradation plus rapide du signal et un raccourcissement du temps T2*. Pratiquement, le myocarde surchargé en fer des patients souffrant d’hémochromatose ou de cardiomyopathie par surcharge en fer présente, pour un TE identique, un signal moins intense que le myocarde d’un sujet normal. La valeur T2* du myocarde d’un patient peut être déterminée par relaxométrie IRM. Il s’agit d’une acquisition rapide en écho de gradient répétée une dizaine de fois sur une même coupe court axe mi-ventriculaire avec augmentation progressive du temps d’écho (TE), par exemple entre 2,5 ms et 18 ms (spoiled gradient multi-echo T2* sequence). L’intensité du signal myocardique est mesurée sur chaque coupe au niveau du septum inter-ventriculaire et sa valeur est rapportée graphiquement en fonction de la valeur du TE. La courbe obtenue est exponentielle de forme y = K·e-TE/T2* où y représente l’intensité du signal et K est une constante. De cette relation, la valeur du T2* est calculée comme le temps nécessaire à la réduction de 63 % de l’intensité du signal initial. Un T2* inférieur à 10 ms a été associé à une surcharge martiale sévère et cliniquement significative du myocarde[14],[15].
Produit de contraste IRM : le gadolinium[modifier | modifier le code]
Le gadolinium (64Gd) est un métal rare qui a la propriété de posséder sur sa dernière orbitale un nombre élevé de spins d’électrons non appariés. Le champ magnétique produit par un électron est plus fort que celui produit par un proton (noyau d’hydrogène), et cet élément paramagnétique constitue donc un candidat idéal pour la fabrication de produits de contraste IRM, raccourcissant les temps de relaxation T1 et T2 des protons des tissus et modifiant l’intensité de leur signal. Toxique à l’état pur, le gadolinium doit être chélaté pour être rendu soluble et utilisable par voie intraveineuse en clinique. Différents chélateurs sont utilisés, et les chélateurs les plus fréquemment utilisés en clinique sont de petite taille (<1000 Da) et ont une distribution extracellulaire (DTPA[16], le DO3A ou le BOPTA par exemple). Au niveau du cœur, le contraste est rapidement éliminé du myocarde normal, pauvre en tissu interstitiel, mais s’accumule de façon prolongée dans les zones de nécrose, de fibrose ou d’œdème, où l’espace interstitiel est pathologiquement augmenté.
L’effet du gadolinium étant de raccourcir le temps de relaxation T1 des tissus où il s’accumule, les séquences d’IRM avec contraste sont en règle générale des séquences pondérées en T1. En raison de la cinétique particulière de distribution et d’élimination du gadolinium dans les tissus, le délai écoulé entre l’injection de contraste et l’acquisition des images est très important car il détermine le type d’informations, morphologiques ou fonctionnelles que procure la séquence. Ainsi, les images de premier passage du contraste dans le tissu myocardique sont à la base de l’imagerie de perfusion, les images acquises immédiatement (<2 minutes) après injection (rehaussement précoce) permettent l’identification de zones myocardiques avasculaires ou de thrombus intra-cavitaires, et les images acquises tardivement (10 à 15 minutes) après injection de gadolinium (rehaussement tardif) évaluent la présence de fibrose ou de cicatrices myocardiques. De plus, l’angiographie IRM nécessite l’injection de produit de contraste, et permet l’imagerie des structures vasculaires par des séquences d’acquisition tridimensionnelles rapides suivant la progression du bolus de gadolinium dans l’arbre vasculaire et les cavités cardiaques.
Imagerie de perfusion myocardique[modifier | modifier le code]
L’imagerie de perfusion repose sur l’imagerie en temps réel du premier passage d’un bolus de gadolinium à travers le muscle cardiaque. Elle utilise des séquences rapides en écho de gradient (spoiled gradient echo ou bSSFP), précédées d’une pré-impulsion de saturation (90°) afin d’accentuer la pondération T1 des images. Jusqu’à trois coupes en court axe du ventricule gauche sont acquises lors de chaque battement cardiaque, ou jusqu’à six coupes tous les deux battements cardiaques. Les images sont acquises de préférence en diastole, ce qui peut s’avérer difficile pour les patients tachycardes, notamment durant un protocole de stress pharmacologique. Le bolus de contraste est injecté dans une veine de large calibre du pli du coude à l’aide d’une pompe automatique. La dose usuelle est de 0,05-0,1 millimoles de gadolinium par kilogramme de poids corporel. Pour la recherche d’ischémie myocardique, l’injection de gadolinium est effectuée au pic d’un stress pharmacologique par adénosine, dipyridamole ou dobutamine dans le but d’obtenir une vasodilatation coronaire, respectivement une contractilité myocardique, maximale. L’acquisition dynamique est débutée au moment de l’injection du contraste, qui rehausse successivement les cavités droites puis gauches avant de perfuser le muscle cardiaque. On observe alors la progression rapide du contraste, de l’épicarde vers l’endocarde chez le sujet sain, et le rehaussement du myocarde est homogène et complet à la fin du premier passage de gadolinium. Chez les patients atteints de maladie coronaire significative, les zones de déficit de perfusion sont caractérisées par un retard ou un déficit segmentaire du rehaussement myocardique. Une analyse semiquantitative peut être effectuée[17],[18]. Dans certains centres, la même séquence de perfusion est répétée après quelques minutes, sans stress pharmacologique. L’analyse de la perfusion myocardique de repos est destinée à mieux différencier les artéfacts des déficits de perfusion réels en comparant les images de stress et les images de repos (en cas de sténose coronarienne significative, seul un déficit de perfusion au stress est en principe observé); elle ne permet pas toujours de trancher de façon définitive et n’est pas pratiquée dans tous les centres. Notons encore que l’imagerie de perfusion de repos est utilisée pour la caractérisation des masses et tumeurs myocardiques afin d’en préciser le degré de vascularisation ; une tumeur maligne, hypervasculaire, présentera par exemple un rehaussement important durant l’imagerie de perfusion.
Rehaussement précoce après injection de gadolinium[modifier | modifier le code]
Il s’agit d’une séquence en écho de gradient avec pré-impulsion d’inversion ou de saturation, acquise immédiatement après l’injection de produit de contraste. La dose maximale de gadolinium injectée durant un examen standard est de 0,2 millimole par kilogramme de poids corporel. On retranchera de cette dose la quantité de produit de contraste déjà injectée durant la – ou les séquences de perfusion. Les images de rehaussement précoce montrent un myocarde complètement rehaussé et hyper-intense ; seules les zones non vascularisées sont de signal hypo-intense. Dans le contexte d’un infarctus du myocarde récent, une zone hypo-intense au sein du territoire infarci révèle la présence d’obstruction microvasculaire[19] (correspondant au phénomène de no-reflow angiographique) tandis qu’une zone hypointense située dans la cavité ventriculaire, accolée au myocarde akinétique, indique la présence d’un thrombus mural[20]. Pour le diagnostic de la myocardite aiguë, le recours aux séquences de rehaussement précoce est recommandée, afin d’identifier les zones d’inflammation myocardique, hyperémiques, qui apparaissent plus hyperintenses que le myocarde normal.
Rehaussement tardif après injection de gadolinium[modifier | modifier le code]
Il s’agit d’une séquence acquise entre 10 et 20 minutes après l’injection du produit de contraste[21],[22]. Appelée également imagerie de la cicatrice, cette séquence a pour but de mettre en évidence les zones de fibrose intra-myocardique. L’étude de la cinétique du produit de contraste dans le tissu cardiaque montre que le contraste est rapidement évacué de l’espace interstitiel du myocarde normal alors que sa vidange est ralentie dans les zones de fibrose où l’espace extracellulaire est augmenté ; le temps de relaxation T1 des zones de fibrose se trouve donc significativement raccourci par rapport à celui du myocarde sain. La séquence utilisée est une séquence en écho de gradient (ou une séquence en bSSFP) précédée d’une impulsion d’inversion (180°) permettant de maximiser le contraste T1. Afin de produire un contraste maximal entre les zones de myocarde sain et de fibrose, le réglage du temps d’inversion (TI), c'est-à-dire le délai entre la pré-impulsion d’inversion et le début de la séquence proprement dite, est déterminant ; il s’agit en effet de lancer la séquence au moment précis où le myocarde normal ne produit aucun signal alors que les zones de fibrose, dont le T1 est raccourci par accumulation de gadolinium, produisent un signal d’écho. On obtient ainsi un rapport d’intensité en théorie infini entre la fibrose et le myocarde normal (en pratique, ce rapport d’intensité est supérieur à 10), faisant de cette séquence un moyen très sensible pour la détection de la fibrose macroscopique. Le myocarde sain apparaît alors hypo-intense (noir) et les zones de fibrose hyper-intenses (claires) ; « ce qui est clair est mort » (« bright is dead ») est le slogan mnémotechnique qui caractérise cette séquence. Cette séquence est également appropriée pour la recherche d’obstruction microvasculaire, apparaissant comme un noyau hypo-intense au sein d’une zone de fibrose hyper-intense. La résolution dans le plan des images de rehaussement tardif est de l’ordre de 1,4-1,8 x 1,4-1,8 mm avec une épaisseur de coupe de 5 à 8 mm[23]. Étant donné que la cinétique d’élimination du contraste dépend du poids du patient, de la dose de contraste injectée et du délai entre l’injection et l’acquisition des images, le choix du TI idéal doit tenir compte de ces paramètres ; il varie entre 250 et 400 ms. Très utilisée dans l’évaluation de la cardiopathie ischémique et de la viabilité myocardique, l’étude du rehaussement tardif est également importante dans l’évaluation des cardiomyopathies (recherche de fibrose interstitielle), des masses et tumeurs myocardiques (rehaussement homogène du fibrome, détection de zones de nécrose) et des pathologies péricardiques (rehaussement du péricarde enflammé).
Angiographie IRM[modifier | modifier le code]
Les séquences d’angiographie consistent en une acquisition volumétrique durant le transit d’un bolus de contraste. Grâce à la rapidité des scanners modernes, plusieurs angiographies peuvent être acquises durant une même apnée d’environ 20 secondes, permettant d’obtenir en une seule séquence une angiographie pulmonaire et une angiographie aortique ; on parle de séquences en quatre dimensions ou 4D. L’acquisition s’effectue en deux temps, avec dans un premier temps, l’acquisition avant l’injection de contraste de signaux de haute fréquence et de faible amplitude, codant la définition de l’image. Ces informations définissent les contours des structures intrathoraciques qui ne se modifient pas durant l’injection du produit de contraste ; leur acquisition n’est pas répétée durant la phase dynamique afin d’accroître la vitesse de l’acquisition durant cette seconde phase. Le second temps de la séquence débute donc avec l’injection par pompe automatique d’un bolus de produit de contraste. La progression du produit de contraste est suivie en temps réel et l’acquisition proprement dite débutée lorsque le produit de contraste atteint la cavité cardiaque ou la structure vasculaire à caractériser (on commencera par exemple une angiographie de l’arche aortique quand le bolus aura atteint le ventricule gauche). Lors de cette seconde phase de l’acquisition, seuls les signaux de haute amplitude et de basse fréquence qui codent le contraste de l’image seront acquis, de façon répétée, durant les 20 secondes suivant le déclenchement de la séquence. La superposition des deux acquisitions forme l’image finale, d’une résolution dans le plan de 1-2,5 x 1-2,5 mm. Elle pourra être reconstruite en trois dimensions ou visualisée en projection maximale selon les besoins diagnostiques.
Cartographies de flux[modifier | modifier le code]
Le signal IRM enregistré est un signal de radiofréquence complexe, comprenant une fréquence, une amplitude et une phase. Les séquences en écho de gradient peuvent être codées en phase de sorte à mesurer la vitesse du flux sanguin. Cette technique repose sur la propriété de déphasage du signal IRM par les protons en mouvement, proportionnel à la vitesse du flux dans le champ magnétique. Il est donc possible, par ces séquences particulières, d’encoder la vitesse d’un flux et d’en mesurer le débit. La précision de la mesure dépend de la position du plan d’acquisition, qui doit être placé perpendiculairement au flux mesuré. L’opérateur décide, pour une acquisition donnée, d’une vitesse d’encodage maximale (VENC), la vitesse causant un déphasage de signal de 180°. Le VENC doit être légèrement supérieur (120 %) à la vitesse du flux pour en obtenir une mesure optimale. S’il est trop grand, le signal obtenu sera de mauvaise qualité, avec un rapport signal sur bruit élevé. S’il est trop petit, un phénomène d’aliasing survient, empêchant toute évaluation quantitative du flux[24]. Ces mesures trouvent principalement leur application dans l’estimation de la sévérité de shunts intracardiaques, ou dans l’estimation de la sévérité d’insuffisances valvulaires aortique ou pulmonaire par mesure du volume régurgitant et de la fraction de régurgitation.
Tissue tagging et analyse de la déformation[modifier | modifier le code]
Les séquences de tagging ou « tatouage myocardique » ont pour but d’analyser et de quantifier la déformation du myocarde durant le cycle cardiaque, et sont utilisées conjointement avec des séquences ciné en bSSFP ou en écho de gradient. Le principe est de « tatouer » sur la coupe IRM une grille de référence à l’aide de pré-impulsions de saturation (90°). Les bandes de saturation sont appliquées au début de l’acquisition et persistent pour la durée du cycle cardiaque. Comme le tissu saturé se déplace de façon cohérente avec la contraction myocardique sur une image ciné, la déformation de la grille au cours du cycle cardiaque reflète la déformation myocardique. Ces séquences ont montré leur utilité dans l’analyse de la déformation myocardique (strain, strain rate, torsion…)[25] ainsi que dans l’analyse de la synchronisation de la contraction myocardique. La nécessité de disposer d’outils informatiques complexes pour quantifier la déformation limitent actuellement l’utilisation de ces techniques en routine clinique. Elles sont néanmoins parfois utilisées de façon qualitative, par exemple pour détecter une fusion des feuillets péricardiques viscéral et pariétal en cas de suspicion de péricardite constrictive ou de tumeur médiastinale invasive.
Spectroscopie IRM[modifier | modifier le code]
Si l’imagerie conventionnelle par IRM repose sur l’excitation des protons (noyaux d’hydrogène) de l’organisme, il est important de rappeler que tous les noyaux d’atomes caractérisés par un nombre de masse impair ont une charge nette et peuvent également acquérir un moment magnétique. Ces éléments sont dits IRM-actifs, peuvent s’aligner dans le champ magnétique de l’IRM et sont capables de produire un signal après excitation par un signal de radiofréquence adéquat. Les principaux éléments actifs sont l’hydrogène, le carbone, l’azote, l’oxygène, le fluor, le sodium et le phosphore. La spectroscopie IRM est la seule technique permettant l’analyse du métabolisme cardiaque de façon non invasive et sans traceurs radioactifs. Elle nous renseigne sur le métabolisme énergétique du myocarde dans la cardiopathie ischémique, l’insuffisance cardiaque, l’hypertrophie myocardique et les maladies valvulaires, et permet d’évaluer la réponse aux traitements. La spectroscopie IRM relève encore du domaine de la recherche[26].
Applications cliniques[modifier | modifier le code]
Maladie coronarienne[modifier | modifier le code]
L’IRM cardiaque offre en un seul examen une évaluation exhaustive de la cardiopathie ischémique avec caractérisation de la morphologie, de la fonction, de la perfusion et de la viabilité myocardiques. Un protocole d’imagerie standard comprend la mesure des volumes et de la fraction d’éjection du ventricule gauche à l’aide de séquences ciné en long axe et court axe. Les anomalies de la cinétique segmentaire sont évaluées sur ces mêmes images ; leur sévérité est classifiée de façon semi-quantitative (normokinésie, hypokinésie, akinésie, dyskinésie) et leur distribution est décrite à l’aide du modèle des 17 segments myocardiques. Après injection de gadolinium, les séquences de rehaussement tardif détectent les cicatrices d’infarctus, de localisation sous-endocardique ou transmurale avec une sensibilité supérieure à celle de la scintigraphie[27]. La distribution des zones de fibrose est décrite à l’aide du modèle des 17 segments. Le degré de transmuralité est inversement proportionnel à la probabilité de récupération fonctionnelle après revascularisation et constitue un indicateur de la viabilité myocardique[28]. Schématiquement, un segment akinétique avec rehaussement sous-endocardique touchant moins de 50 % de l’épaisseur myocardique peut être considéré comme probablement viable, tandis qu’un segment avec rehaussement supérieur à 50 % de l’épaisseur myocardique est considéré non viable. Au sein de la cicatrice, hyper-intense, on peut parfois observer un noyau hypo-intense correspondant à une zone d’obstruction micro-vasculaire où le contraste ne peut pas pénétrer. La présence d’obstruction micro-vasculaire est un marqueur de sévérité de l’infarctus myocardique et est associé à un pronostic plus réservé en termes de récupération fonctionnelle[29],[30]. Dans la phase aiguë (1-20 jours) de l’infarctus myocardique, les séquences en pondération T2 permettent d’identifier l’œdème myocardique, dont l’extension a été corrélée avec le volume myocardique à risque de nécrose[31]. L’œdème myocardique est de signal hyper-intense en pondération T2.
Le rehaussement précoce après injection de gadolinium identifie également l’obstruction micro-vasculaire comme une zone myocardique hypo-intense au sein d’un myocarde fortement rehaussé par le gadolinium. Un signal hypo-intense situé dans la cavité ventriculaire et localisé en regard d’une paroi myocardique akinétique ou anévrysmale indique la présence d’un thrombus mural intra-ventriculaire associé à l’infarctus. Les séquences de rehaussement après injection de gadolinium en IRM cardiaques sont supérieures à l’échocardiographie de contraste pour l’identification de thrombus intra-cavitaires[32].
Les artères coronaires peuvent être visualisées directement à l’aide de séquences 3D de haute résolution (épaisseur de coupe de 1,5 mm avec résolution dans le plan de 1.0 x 1,0 mm). Leur trajet épicardique peut être évalué mais la résolution des images est actuellement insuffisante pour pouvoir juger de la présence et de la sévérité de sténoses coronariennes[33]. L’angiographie coronaire par IRM est un domaine de recherche actif et l’on s’attend à une amélioration notable de la résolution de ces acquisitions avec l’utilisation de champs magnétiques de plus haute intensité (3 teslas ou plus) ; l’intérêt du développement de la coronarographie par IRM est de pouvoir caractériser la composition de la plaque et son risque de rupture en plus de la simple évaluation du degré de sténose, sans exposer le patient aux radiations[34].
Si l’IRM est actuellement inférieure à l’angio-CT coronaire pour la détection des sténoses coronariennes[35], elle permet en revanche une excellente évaluation fonctionnelle de la perfusion myocardique. Dans les séquences de perfusion sous stress pharmacologique, on obtient une détection au moins aussi sensible de défauts de perfusion par rapport à la scintigraphie myocardique[36]. Plusieurs études ont démontré la valeur pronostique de l’IRM de perfusion, avec une excellente survie sans événement cardiovasculaire en cas d’IRM de perfusion normale[37],[38],[39]. Il s’agit donc d’un examen de choix dans le dépistage de la maladie coronarienne chez les patients présentant des douleurs thoraciques avec une probabilité clinique intermédiaire, ou dans le suivi des patients revascularisés qui présentent une récidive de douleurs thoraciques.
Maladies valvulaires[modifier | modifier le code]
Les valves normales sont des structures fines au mouvement rapide, de faible densité de proton, rendant leur visualisation difficile sur les séquences d’écho de spin. Elles sont mieux visualisées sur les séquences d’écho de gradient ou bSSFP, notamment en raison de la perte de signal occasionnée par les minimes turbulences du sang circulant au contact des feuillets valvulaires[40]. Ces séquences ciné permettent de juger de l’ouverture d’une valve cardiaque et d’en dépister une éventuelle insuffisance. La résolution temporelle de l’IRM, de l’ordre de 30 phases par cycle cardiaque, est nettement inférieure à celle de l’échocardiographie, et ne permet pas une évaluation morphologique complète de l’appareil valvulaire et sous-valvulaire. En particulier, il est difficile d’identifier la présence de petites structures très mobiles et, en cas de suspicion d’endocardite, seules les larges végétations peuvent être identifiées. L’IRM peut néanmoins être utile dans ce contexte pour identifier un abcès ou une extension extracardiaque de l’infection.
L’intérêt principal de l’IRM dans l’évaluation des valvulopathies est sa capacité de juger de la sévérité des insuffisances valvulaires, de façon qualitative en inspectant la taille du jet régurgitant sur les images ciné, ou de façon quantitative par mesure des volumes ventriculaires et par mesure des débits par cartographie de flux.
En ce qui concerne les valves aortique et pulmonaire, la mesure par cartographie de flux du volume d’éjection systolique et du volume régurgitant diastolique, au niveau de l’aorte ascendante ou du tronc pulmonaire, permet une quantification précise de la sévérité d’une insuffisance. Le rapport du volume régurgitant et du volume d’éjection correspond à la fraction de régurgitation qui caractérise la sévérité de l’insuffisance valvulaire. Des fractions de régurgitation supérieures à 50 % pour la valve aortique et à 35 % pour la valve pulmonaire ont été provisoirement suggérées comme un critère d’insuffisance sévère[41].
Pour la quantification d’une insuffisance mitrale, il est nécessaire de comparer le volume d’éjection obtenu par cartographie de flux au niveau de l’aorte ascendante (méthode des flux) avec le volume d’éjection calculé à partir des volumes télédiastolique et télésystolique du ventricule gauche (méthode des volumes). En l’absence d’insuffisance valvulaire aortique, le volume d’éjection est similaire pour les deux méthodes. En cas d’insuffisance mitrale isolée, la différence entre le volume d’éjection par méthode des volumes et le volume d’éjection par méthode des flux correspond au volume régurgitant à travers la valve mitrale[41]. Un protocole spécifique a été proposé pour caractériser la morphologie de la valve mitrale en cas d’insuffisance significative, afin de détecter la présence d’un prolapsus localisé et d’en estimer la sévérité[42] ; cette étude montre la faisabilité de la technique mais ne compare pas ses performances à celles de l'échocardiographie trans-thoracique ou trans-œsophagienne.
Pour l’insuffisance tricuspide, la planimétrie de l’orifice régurgitant à la vena contracta sur une séquence de cartographie de flux a été suggéré[41].
Pour l’évaluation de la sténose aortique, la mesure du gradient maximal peut s’effectuer par cartographie de flux, en plaçant de façon très soigneuse le plan de mesure, perpendiculaire au flux et à l’endroit de l’accélération maximale. Une bonne corrélation a été montrée entre l’IRM et l’échocardiographie pour la mesure du gradient maximal[43]. La surface d’ouverture de la valve peut être estimée par équation de continuité[44] ou par planimétrie directe[45].
Sur le plan technique, rappelons que les mesures par cartographie de flux sont des mesures délicates qui requièrent de l’expérience de la part de l’opérateur. Le plan de mesure doit être soigneusement placé perpendiculairement au flux sanguin afin d’éviter toute sous-estimation des débits. Un champ magnétique très homogène est requis et une correction pour les inhomogénéités du champ peut s’avérer nécessaire lors de l’analyse des données[46]. Enfin, pour l’évaluation d’une insuffisance aortique, il faut se rappeler que le plan valvulaire se déplace vers l’apex en systole et vers l’aorte en diastole alors que le plan de mesure par l’IRM reste immobile. En diastole, le plan valvulaire se déplace donc en direction opposée au flux régurgitant, ce qui implique une sous-estimation systématique du volume régurgitant. Le degré de sous-estimation sera d’autant plus important que le la fonction systolique longitudinale du ventricule gauche est dynamique[41].
Cardiopathies congénitales[modifier | modifier le code]
L’IRM cardiaque est actuellement incontournable pour l’évaluation des cardiopathies congénitales. Les protocoles d’imagerie sont souvent complexes et doivent être ajustés à la pathologie de chaque patient. Ils associent, de façon variable, une évaluation morphologique de la disposition des organes intra-thoraciques et de l’arrangement des cavités cardiaques (séries de coupes diastoliques en « sang noir » ou « sang clair », ou acquisition d’un bloc 3D en respiration libre), une mesure de la taille et de la fonction des ventricules (séquences ciné), une évaluation de la perméabilité des conduits veineux ou chirurgicaux (séquences ciné, séquences d’angiographie), le dépistage de shunts intracardiaques (cartographie de flux), une évaluation de la fonction des valves (séquences ciné, cartographie de flux), la recherche de fibrose myocardique ou de cicatrice d’infarctus (rehaussement tardif, notamment après opérations nécessitant une réimplantation des artères coronaires), une évaluation de la perfusion myocardique en cas d’anomalies coronaires, une évaluation morphologique de l’anatomie des gros vaisseaux (avec notamment la recherche d’anomalies des branches de l’arche aortique ou de coarctation aortique par séquences d’angiographie), ou la localisation de collatérales aorto-pulmonaire ou de shunts chirurgicaux (séquences d’angiographie). Une partie importante de cette évaluation morpho-fonctionnelle peut être effectuée par échocardiographie. Cependant, son caractère multimodal et sa capacité de visualiser sans restriction les organes intra-thoraciques (notamment les cavités cardiaques droites, les veines pulmonaires, les gros vaisseaux et les conduits chirurgicaux) font de l’IRM le procédé d’imagerie de choix des cardiopathies congénitales. Au vu de la complexité des protocoles d’acquisition, il est important de planifier à l’avance le protocole d’imagerie pour un patient particulier en fonction de son histoire clinique, de ses antécédents chirurgicaux et de la problématique actuelle. Des recommandations synthétiques ont été publiées par les sociétés savantes concernées afin d’aider le radiologue et le cardiologue dans cette tâche[47].
Cardiomyopathies[modifier | modifier le code]
Cardiomyopathie hypertrophique (CMH)[modifier | modifier le code]
Les formes classiques de CMH avec hypertrophie asymétrique du septum sont facilement reconnues en échocardiographie qui permet une mesure précise de l’épaisseur des parois myocardiques, l’évaluation de la morphologie et de la fonction de la valve mitrale et la détection d’obstruction dynamique de la chambre de chasse du ventricule gauche. Sur le plan de l’évaluation morphologique, l’IRM cardiaque, en utilisant des séquences ciné en long axe et court axe des ventricules, est supérieure à l’échocardiographie pour la détection des formes atypiques, et en particulier de la CMH apicale[48],[49]. Elle est également utile pour différencier la CMH d’une hypertrophie physiologique chez un sportif d’élite[50]. Les images ciné en long axe (3 et 4 cavités) peuvent détecter un mouvement antérieur systolique de la valve mitrale et la présence de flux turbulent dans la chambre de chasse, suggérant une possible obstruction dynamique (cardiomyopathie hypertrophique obstructive). Toutefois, la résolution temporelle de l’IRM, nettement inférieure à celle de l’échocardiographie, ne permet pas d’apprécier en détail le mouvement rapide du feuillet antérieur de la valve mitrale et la présence d’une obstruction dynamique significative ne peut pas être identifiée avec certitude. Il est ainsi préférable d’y associer une évaluation par échocardiographie avec mesure Doppler de la vitesse du flux de la chambre de chasse gauche. Dans la CMH, le rehaussement tardif identifie fréquemment une fibrose localisée aux points d’insertion du ventricule droit dans le septum. Cette zone où s’enchevêtrent les fibres issues des deux ventricules semble être particulièrement susceptible au développement de fibrose dans diverses cardiomyopathies ; elle n’est donc pas spécifique de la CMH et sa valeur pronostique est incertaine. Le rehaussement tardif est parfois détecté dans d’autres localisations myocardiques, et principalement dans les zones les plus hypertrophiées. À l’inverse de la fibrose de l’infarctus myocardique, homogène et de distribution sous-endocardique, le rehaussement de la CMH se distribue habituellement en patches irréguliers d’hyper-intensité variable. Il est tentant d’associer le degré de fibrose par rehaussement tardif à un pronostic plus défavorable ; cependant, bien que la présence de rehaussement tardif ait été associée à la présence de tachycardies ventriculaires non soutenue et à une fréquence accrue d’extrasystoles ventriculaires, une corrélation directe n’a pas été établie de façon satisfaisante entre la fibrose myocardique et la mort subite[51],[52],[53]. La présence de fibrose étendue a été associée avec une évolution vers la cardiopathie dilatée et la dysfonction systolique[54].
Cardiomyopathie dilatée[modifier | modifier le code]
Le volume ventriculaire gauche et sa fraction d’éjection sont mesurés avec précision et reproductibilité sur les séquences ciné. La cardiopathie ischémique est le principal diagnostic différentiel et le rehaussement tardif offre un outil pour différencier une cardiomyopathie dilatée d’une cardiopathie dilatée d’origine ischémique[55]. La présence de rehaussement sous-endocardique atteste d’épisodes ischémiques anciens et suggère une origine ischémique à la dysfonction ventriculaire. En l’absence de maladie coronarienne, le rehaussement sous-endocardique est en général absent, mais on peut observer, dans environ 35 % des cas de cardiomyopathie dilatée, un rehaussement linéaire de distribution medio-ventriculaire, correspondant histologiquement à une bande de fibrose. La présence d’une bande de fibrose linéaire a été associée à un pronostic plus défavorable dans la cardiomyopathie dilatée[56]. Bien qu’elle apporte des informations pronostiques utiles dans la cardiomyopathie dilatée, l’IRM n’est pas recommandée actuellement comme le moyen de référence pour exclure une maladie coronarienne sous-jacente selon les recommandations de 2006[57]. Relevons enfin la possibilité d’une évaluation de la déformation et de la synchronisation myocardique par les séquences de tagging, qui pourrait à l’avenir complémenter l’évaluation échocardiographique dans le bilan avant mise en œuvre d'une thérapie de resynchronisation[58].
Dysplasie arythmogène du ventricule droit (DAVD)[modifier | modifier le code]
Le diagnostic précoce de la DAVD est difficile à poser en raison d’une longue phase dormante initiale de la maladie ; il comprend plusieurs critères décrits en 1994 par l'ARVD Task Force[59], révisés au début de l’année 2010[60]. Ces critères, spécifiques mais relativement peu sensibles pour le diagnostic de DAVD, regroupent des anomalies morphologiques, ECG, histologiques et cliniques. L’IRM cardiaque est le procédé d’imagerie de choix du ventricule droit et permet d’évaluer de façon très précise son volume et sa fonction systolique globale, et de détecter des anomalies de la cinétique segmentaire. Les anomalies retenues comme critères majeurs ou mineurs de la maladie sont la présence soit d’une akinésie ou d’une dyskinésie régionale, soit d’une asynchronie de contraction du ventricule droit, pour autant qu’elles s’accompagnent d’une dilatation du ventricule ou d’une dysfonction systolique. Les nouvelles recommandations de la task force introduisent des seuils de normalité pour le volume du ventricule droit et sa fraction d’éjection, offrant une meilleure reproductibilité des critères diagnostiques. Rappelons que la recherche d’infiltration fibro-adipeuse du myocarde par IRM à l’aide de séquences T1 avec et sans saturation de graisse ne fait pas partie des critères diagnostiques de DAVD et que la présence d’infiltration doit être prouvée en histopathologie. Il est également important de souligner que le diagnostic de dysplasie arythmogène ne s’établit pas uniquement sur la base de la morphologie du ventricule droit en IRM cardiaque, mais qu’il requiert l’intégration de ce résultat avec d’autres données ECG, cliniques et histopathologiques.
Amyloïdose[modifier | modifier le code]
L’amyloïdose cardiaque consiste en l’accumulation dans l’espace interstitiel de diverses protéines – l’atteinte cardiaque est principalement liée à l’amyloïdose de type chaînes légère d’immunoglobulines (AL) ou de type Transthyrétine (TTR), en conformation insoluble de fibrilles amyloïdes, conduisant à une dysfonction diastolique puis à une cardiomyopathie restrictive. Dans les cas typiques, les séquences ciné montrent un épaississement homogène et concentrique du myocarde des deux ventricules, un épaississement des feuillets valvulaires, une dilatation des deux oreillettes et la présence d’un épanchement péricardique. La fraction d’éjection des ventricules est préservée jusque dans les phases tardives de la maladie, mais on peut observer déjà précocement une réduction marquée de la contraction longitudinale avec préservation de la contraction radiale. La cinétique de distribution du produit de contraste dans le myocarde est altérée en cas d’amyloïdose, permettant d’obtenir une orientation diagnostique non invasive et spécifique à l’aide des séquences de rehaussement tardif. On observe en effet une évacuation rapide du produit de contraste du pool sanguin avec un rehaussement des zones myocardiques les plus infiltrés par la protéine amyloïde, généralement sous-endocardiques[61]. La singularité de cette cinétique de distribution est la disparition très précoce du produit de contraste de la cavité ventriculaire, comme s’il était « aspiré » dans les tissus par la protéine amyloïde diffusément infiltrée. Le diagnostic d’amyloïdose peut être fortement suggéré à l’aide de séquences TI-scout (ou look-locker), des séquences de repérage consistant à répéter une acquisition en rehaussement tardif d’une coupe court axe du ventricule gauche, en incrémentant à chaque acquisition la valeur du temps d’inversion (TI), par exemple entre 80 ms et 400 ms. Les caractéristiques de l’amyloïdose dans cette séquence sont d’une part l’impossibilité de trouver un TI capable d’annuler complètement et de façon homogène le signal du myocarde, et d’autre part une séquence paradoxale d’annulation de signal, avec l’annulation de la majorité (> 50 %) du signal myocardique à des TI plus courts que celle du signal de la cavité ventriculaire[62]. L’image typique est celle d’un rehaussement diffus sous-endocardique en présence d’une cavité ventriculaire de signal hypo-intense (pour rappel, chez les patients sans amyloïdose, la cavité ventriculaire reste claire, d’intensité intermédiaire entre le myocarde de signal complètement annulé et les zones de fibrose hyperintenses). Il est important de rappeler qu’en cas de suspicion d’amyloïdose, ces séquences de rehaussement « tardif » doivent s’effectuer précocement (<4 minutes) après injection de gadolinium en raison de l’évacuation rapide du contraste dans les tissus, au contraire des séquences de rehaussement tardif standard, effectuées au moins 10 minutes après injection de gadolinium.
Hémochromatose[modifier | modifier le code]
Les séquences dédiées à l’hémochromatose en IRM permettent de mesurer le temps de relaxation T2* à partir d’acquisitions répétées en écho de gradient, en incrémentant à chaque acquisition la valeur du temps d’écho (TE). L’infiltration martiale du myocarde cause un déphasage plus rapide des spins des protons induisant une réduction du temps T2* proportionnelle à la sévérité de l’infiltration. Des valeurs de T2* inférieures à 10 ms ont été associées au développement d’insuffisance cardiaque[63] et il a été montré que l’initiation et l’intensification d’un traitement chélateur en fonction des indices mesurés en IRM induit une réduction de la mortalité cardiaque chez ces patients[64]. L’IRM est donc un outil central dans l’évaluation de la sévérité de la maladie et dans l’optimisation des traitements. Il faut souligner que la sévérité de l’infiltration myocardique n’est pas forcément corrélée à celle de l’infiltration hépatique et que le résultat d’une biopsie hépatique ne permet pas de présumer de la sévérité de l’atteinte myocardique ; cette constatation a son importance si l’on garde à l’esprit que le pronostic de ces patients est largement conditionnée par la sévérité de l’atteinte cardiaque.
Myocardite[modifier | modifier le code]
La myocardite est une atteinte inflammatoire du myocarde, d’origine le plus souvent virale ou post-virale (la maladie de Chagas, une infection parasitaire, représente un diagnostic différentiel important en Amérique du Sud). Le tableau clinique en phase aiguë associe fréquemment des douleurs thoraciques, des anomalies ECG de type péricardite et une élévation de la concentration sérique de troponine, attestant d’un dommage myocardique. La fonction systolique des ventricules est le plus souvent préservée ou légèrement diminuée, mais des atteintes fulminantes avec dysfonction systolique sévère et choc cardiogène sont possibles. La myocardite aiguë peut évoluer vers une résolution complète ou progresser vers une dysfonction systolique[65]. Il a été suggéré que la myocardite virale contribue de façon importante au développement de la cardiomyopathie dilatée jusque dans 60 % des cas[66],[67]. L’IRM cardiaque mesure avec précision les volumes ventriculaires et la fraction d’éjection. Des anomalies de la cinétique segmentaire sont occasionnellement détectées, de même que la présence d’épanchement péricardique. En IRM, les séquences de rehaussement tardif mettent en évidence une fibrose myocardique dont la distribution est typiquement sous-épicardique ou medio-ventriculaire et touche fréquemment la paroi latérale[68] ; dans les cas où la présentation clinique est équivoque, la distribution du rehaussement tardif aide à différencier une atteinte inflammatoire (rehaussement épicardique ou medio-ventriculaire) d’une atteinte ischémique (rehaussement sous-endocardique) ; dans une minorité de cas, le rehaussement est transmural, et l’IRM ne permet pas de distinguer les deux causes. Il a été suggéré que la localisation de la fibrose et de l’inflammation, ainsi que le pronostic étaient corrélés à l’étiologie virale : une atteinte sous-épicardique de la paroi inférolatérale était associée à la présence de génome de parvovirus B19 et à une résolution spontanée alors qu’une atteinte septale était associée au virus herpès HHV-6 (ou à l’association HHV-6 et parvovirus B19) avec un risque plus élevé de progression vers l’insuffisance cardiaque[69]. En phase aiguë, un œdème myocardique est fréquemment détecté à l’aide des séquences en pondération T2, de même qu’un hypersignal dans les séquences de rehaussement précoce après injection de gadolinium ; ces séquences sont proposées, en plus de l’étude des volumes et du rehaussement tardif, pour le diagnostic de la myocardite en IRM[70].
Sarcoïdose cardiaque[modifier | modifier le code]
La sarcoïdose est une maladie inflammatoire systémique impliquant le myocarde. Une atteinte myocardique est fréquente mais difficile à diagnostiquer dans les phases précoces de la maladie et n’est reconnue que dans une minorité des cas. L’atteinte cardiaque se manifeste par une dilatation ventriculaire avec dysfonction systolique progressive, ou par des arythmies ventriculaires. Alors que les atteintes tardives avec dysfonction ventriculaire et anomalies de la cinétique segmentaire peuvent être facilement reconnues à l’échocardiographie, l’IRM peut détecter une atteinte myocardique à un stade précoce[71], et guider le traitement immunosuppresseur afin de tenter de retarder la survenue de complications. Le rehaussement tardif permet la détection de patches hyperintenses d’inflammation et de fibrose myocardique. Les séquences pondérées en T2 détectent fréquemment un signal hyperintense dans ces mêmes zones en phase aiguë. La présence de patches de rehaussement tardif détecte une atteinte cardiaque de la sarcoidose avec plus de sensibilité que les critères cliniques actuellement recommandés (Japanese Ministry of Health JMH guidelines) et semble associée à un pronostic plus défavorable[72].
Fibrose endomyocardique[modifier | modifier le code]
Il s’agit d’une cardiopathie acquise, associée à un syndrome hyperéosinophile idiopathique, caractérisée par une inflammation de l’endocarde et la présence de thrombus comblant l’apex d’un ou des deux ventricules. La maladie peut évoluer vers une véritable fibrose de l’apex ventriculaire avec développement d’une cardiopathie restrictive. L’IRM montre sur les séquences ciné un ventricule de taille et de fonction systolique normales, ainsi que la présence d’un comblement de l’apex. Le rehaussement précoce et tardif permet d’identifier la présence de fibrose endocardique et de thrombus moulant l’apex ventriculaire[73].
Maladies du péricarde[modifier | modifier le code]
L’échocardiographie comme l’IRM détectent facilement un épanchement péricardique et mettent en évidence le cas échéant des signes de tamponnade. La péricardite constrictive est un diagnostic plus difficile à poser, nécessitant souvent l’association des résultats morphologiques (échocardiographie, IRM, CT), hémodynamiques et d’écho-Doppler (présence de variations respiratoires pathologiques des flux trans-valvulaires ou veineux hépatiques). Le CT-scan thoracique peut contribuer au diagnostic en détectant un épaississement du péricarde ou la présence de calcifications péricardiques. Un épaississement péricardique significatif (>4 mm) est suggestif d’une péricardite constrictive en présence d’une clinique compatible ; il faut toutefois souligner qu’un péricarde épaissi peut se rencontrer sans physiologie de constriction, et que jusqu’à 18 % des patients présentant une péricardite constrictive confirmée ont un péricarde d’épaisseur normale (<2 mm)[74]. En IRM, le péricarde se présente comme une ligne hypointense flanquée de deux bandes graisseuses hyperintenses – épicardique et péricardique — dans les séquences en pondération T1. Il est ainsi facile de mesurer l’épaisseur du péricarde mais les calcifications péricardiques ne sont pas détectées (signal nul). Dans les séquences de rehaussement tardif, le péricarde apparaît hyper-intense en cas d’inflammation active. Sur le plan morphologique, la péricardite constrictive se caractérise par un péricarde épaissi, des cavités cardiaques aplaties ou de forme tubulaire, et une dilatation importante de la veine cave inférieure et des veines sus-hépatiques[75]. L’IRM permet enfin de dépister une interférence entre le ventricule droit et le ventricule gauche durant le cycle respiratoire. Des séquences ultra-rapides et de faible résolution permettent l’acquisition d’une coupe myocardique complète lors de chaque battement cardiaque, offrant une évaluation de la fonction systolique en temps réel. Un déplacement brusque du septum interventriculaire en direction du ventricule gauche à l’initiation de l’inspirium, et un retour brusque en position normale à l’initiation de l’expirium sont caractéristiques d’une physiologie constrictive[76]. Ce signe est d’une aide précieuse pour le diagnostic de péricardite constrictive, en particulier chez les patients en fibrillation auriculaire pour lesquels l’évaluation des variations respiratoires des flux Doppler est particulièrement fastidieuse.
Tumeurs cardiaques[modifier | modifier le code]
Les tumeurs primaires du myocarde sont très rares, avec une incidence estimée à moins de 0,3 %, dont 75 % de tumeurs bénignes ; les tumeurs secondaires, ou métastases de tumeurs extracardiaques, sont en revanche plus fréquentes, d’une incidence au moins 20 fois plus élevée. De par sa capacité de caractériser les tissus mous, l’IRM cardiaque est un outil unique pour le diagnostic des tumeurs cardiaques. Des séries de coupes morphologiques en « sang noir » ou « sang clair » précisent l’anatomie et l’extension de la masse tumorale ainsi que sa relation avec les structures cardiaques et thoraciques. Des coupes ciné standard évaluent la fonction systolique des ventricules et détectent la présence d’épanchement péricardique. Pour la caractérisation tissulaire, on construit un plan coupant la masse tumorale de façon optimale, et l’on applique successivement différentes séquences afin d’en analyser sa composition. Le protocole idéal pour la caractérisation d’une masse myocardique n’est pas clairement défini, mais peut inclure des séquences en pondération T1 (comparaison de l’intensité de la masse tumorale avec l’intensité du myocarde normal, détection de contenu adipeux de signal hyperintense) associées ou non à une pré-impulsion de saturation de graisse, des séquences en pondération T2 (recherche d’œdème, pouvant suggérer une haute activité mitotique ou une composante kystique/myxomateuse), une séquence de perfusion de repos (évaluation de la vascularisation), l’analyse du rehaussement précoce (recherche de zones de thrombose ou de nécrose avasculaire) et de rehaussement tardif (recherche de fibrose ou de nécrose)[77].
Myxome de l’oreillette[modifier | modifier le code]
Il s’agit de la tumeur primaire cardiaque la plus fréquente. Elle est en général bénigne et se présente le plus souvent comme une masse gélatineuse, pédiculée, attachée au versant gauche du septum inter-auriculaire et flottant dans la cavité de l’oreillette gauche (75 %). Dans 20 % des cas, le myxome se situe dans l’oreillette droite, et rarement dans l’un ou l’autre ventricule. La croissance de cette tumeur est rapide. En IRM, le myxome est caractérisé par un signal intense en pondération T2, une bonne perfusion de repos et un rehaussement tardif hétérogène après injection de gadolinium. Un thrombus est parfois accolé à la masse tumorale, bien reconnaissable après injection de gadolinium[78].
Fibroélastome[modifier | modifier le code]
Le fibroélastome est une petite tumeur mobile et pédonculée, sise le plus souvent sur les valves cardiaques. Il est de signal hyperintense dans les séquences des rehaussement tardif après injection de gadolinium[79].
Lipome[modifier | modifier le code]
Situé le plus souvent au niveau du septum interauriculaire, le lipome peut être intra-myocardique dans une minorité de cas. De structure essentiellement cellulaire, le lipome présente un signal intense en pondération T1, qui s’annule complètement dans les séquences de saturation de graisse. Sa perfusion est peu marquée et son rehaussement tardif après injection de gadolinium est faible.
Fibrome[modifier | modifier le code]
Tumeur bénigne peu fréquente, le fibrome est le plus souvent intra-myocardique au niveau ventriculaire, et peut mimer une hypertrophie myocardique localisée ou une cardiomyopathie hypertrophique. L’intensité de son signal en T1 est très proche de celle du myocarde normal mais on observe un intense rehaussement tardif après injection de gadolinium. Le centre de la tumeur se rehausse souvent plus faiblement, probablement en raison d’une plus faible vascularisation[80].
Lymphome[modifier | modifier le code]
Il s’agit d’une tumeur myocardique maligne. Rarement primaire, en général en association avec le HIV, elle se rencontre plus fréquemment au niveau cardiaque comme métastase d’un lymphome d’autre origine. Elle est caractérisée par une ou plusieurs masses polylobées infiltrant le muscle cardiaque et situées en général au niveau des ventricules. Une compression des cavités cardiaques, de l’anneau tricuspide ou des veines caves peut être observée. Un épanchement péricardique est souvent associé. L’IRM cardiaque est utile pour délimiter l’extension intra-thoracique de la tumeur, mais la caractérisation tissulaire manque de spécificité. On observe un signal homogène en pondération T1 et un signal intense en pondération T2, reflétant l’œdème tumoral. La perfusion est importante et le rehaussement précoce et tardif souvent inhomogènes, variant selon leur degré de cellularité.
Sarcomes[modifier | modifier le code]
Il s’agit des tumeurs malignes primaires les plus fréquentes au niveau cardiaque. Les types histologiques les plus fréquents sont l’angiosarcome et le fibrosarcome. Ces tumeurs sont volumineuses, de croissance rapide, infiltrant le plus souvent le myocarde de l’oreillette et du ventricule droits. Un épanchement péricardique hémorragique est fréquemment associé. La caractérisation tissulaire du sarcome en IRM est peu spécifique : il n’est souvent pas possible de différencier un sarcome d’un lymphome cardiaque, bien que le signal du sarcome soit souvent décrit comme très hétérogène en pondération T1 en raison de fréquentes zones d’hémorragie intra-tumorale[81]. Un diagnostic par biopsie est essentiel afin d’orienter le traitement.
Métastases cardiaques et péricardiques[modifier | modifier le code]
Vingt à quarante fois plus fréquentes que les tumeurs malignes primaires, les néoplasies secondaires sont souvent multiples et associées à un volumineux épanchement péricardique, avec ou sans tamponnade. Les tumeurs primaires le plus souvent associées à des métastases cardiaques sont les cancers du poumon et du sein (invasion directe par continuité ou dissémination hématogène ou lymphatique), les cancers du rein et le carcinome hépatocellulaire (invasion de la veine cave inférieure), ainsi que le mélanome, le lymphome et les sarcomes (par dissémination hématogène)[82]. Les caractéristiques morphologiques suggestives de malignité sont une localisation autre que le ventricule ou l’oreillette gauche, un signal inhomogène, un aspect infiltratif, une dimension supérieure à 5 cm, la présence d’un épanchement péricardique ou pleural, et la présence de rehaussement après injection de gadolinium. Aucune de ces caractéristiques n’est diagnostique de malignité à elle seule, mais la combinaison de plusieurs de ces caractéristiques augmente la probabilité d’une origine maligne[83]. Rappelons enfin que grâce à son large champ d’imagerie (field of view), l’IRM cardiaque permet dans le même temps de détecter une tumeur intrathoracique extracardiaque, la présence de métastases pulmonaires ou un comblement tumoral de la veine cave inférieure. Ces informations permettent également de mieux orienter le diagnostic final.
Imagerie des gros vaisseaux[modifier | modifier le code]
L’IRM procure une imagerie complète de l’aorte thoracique permettant la détection d’anévrysmes, de coarctation ou de dissection. La sensibilité de l’IRM cardiaque pour la détection d’une dissection aortique est excellente et comparable à celle de l’angio-CT ; toutefois, l’accès plus restreint à l’IRM en urgence favorise souvent l’utilisation du CT en phase aiguë. L’absence d’exposition aux radiations fait en revanche de l’IRM le procédé d’imagerie de choix pour le suivi de ces patients. En l’absence de dissection, l’IRM permet d’identifier d’autres causes de syndrome aortique aigu, comme l’hématome intramural, ou l’ulcère aortique. Le protocole d’imagerie comprend des séries de coupes axiales en « sang noir » et en « sang clair », des séries de coupes sagittales obliques, suivant l’axe de l’arche aortique, pour préciser l’anatomie de l’aorte, ainsi qu’une angiographie de l’aorte thoracique[84]. En cas de dissection, l’angiographie confirme la perméabilité des branches aortiques et détermine leur relation avec la vraie ou la fausse lumière de l’aorte.
En cas de coarctation, l’IRM permet d’évaluer la sévérité de la sténose et l’abondance des vaisseaux collatéraux. La comparaison des débits en amont de la coarctation et au niveau de l’aorte diaphragmatique par cartographie de flux permet une quantification du flux collatéral. Si la coarctation a été traitée par stenting aortique, il est important de rappeler que la structure métallique du stent peut causer des artefacts de susceptibilité, particulièrement dans les séquences d’écho de gradient, rendant difficile l’évaluation de la perméabilité du stent. Le CT scan apporte un complément d’information important dans ces cas sélectionnés.
Ressources[modifier | modifier le code]
Les sociétés européenne[85] et américaine[86] d’IRM cardiaque émettent de multiples recommandations pour la bonne pratique de l’IRM cardiaque et la standardisation des techniques. Ces recommandations sont publiées dans la littérature médicale et décrivent le cursus reconnu de formation en IRM cardiaque[87] les indications[57], proposent des protocoles d’imagerie standard[88] et une systématique concernant la manière de rapporter les examens[89].
Notes et références[modifier | modifier le code]
- MRIsafety.com. MRI safety, bioeffects and patient management.
- (en) KDOQI CKD Guidelines
- « Wayback Machine », sur icnfdr.org (consulté le ).
- (en) Thomsen HS, European Society of Urogenital Radiology (ESUR). « ESUR guideline: gadolinium-based contrast media and nephrogenic systemic fibrosis. » Eur Radiol. 2007; 17: 2692-6.
- (en) MK. Stehling, NG. Holzknecht, G. Laub et al., « Single-shot T1- and T2-weighted magnetic resonance imaging of the heart with black blood: preliminary experience. », Magma 1996 ; 4: 231-40
- (en) RL. Greenman, JE. Shirosky, RV. Mulkern et al, « Double inversion black-blood fast spin-echo imaging of the human heart: a comparison between 1,5 T and 3,0 T. », J Magn Reson Imaging, 2003 ; 17: 648-55
- (en) H. Thiele, E. Nagel, I. Paetsch, et al., « Functional cardiac MR imaging with steady-state free precession (SSFP) significantly improves endocardial border delineation without contrast agents. », J Magn Reson Imaging, 2001 ; 14: 362-7.
- (en) TS. Sorensen, H. Körperich, GF. Greil et al., « Operator-independent isotropic three-dimensional magnetic resonance imaging for morphology in congenital heart disease: a validation study. », Circulation, 2004 ; 110: 163-9.
- (en) RS. Razavi, DL. Hill, V. Muthurangu et al., « Three-dimensional imaging of congenital cardiac anomalies. », Cardiol Young, 2003; 13: 461-5.
- (en) B. Giorgi, S. Dymarkowski, F. Maes et al., « Improved visualisation of coronary arteries using a new three-dimensional submillimeter coronary angiography sequence with balanced gradients. », Am J Roentgenol, 2002 ; 179: 901-10.
- (en) J. Henning, O. Speck, K. Scheffler, « Optimization of signal behavior in the transition to driven equilibrium in steady-state free precession sequences. », Magn Reson Med, 2002 ; 48: 801-9.
- (en) M. Francone, S. Dymarkowski, M. Kalantzi et al., « Real-time cine MRI of ventricular septal motion: a novel approach to assess ventricular coupling. », J Magn Reson Imaging, 2005 ; 21: 305-9.
- (en) OP. Simonetti, JP. Finn, RD. White et al., « Black blood T2-weighted inversion-recovery MR imaging of the heart »., Radiology, 2003 ; 199: 49-57.
- (en) LJ. Anderson, S. Holden, B. Davis et al., « Cardiovascular T2-star (T2*) magnetic resonance for early diagnosis of myocardial iron overload. », Eur Heart J, 2001 ; 22: 2171-9.
- M. Westwood, LJ. Anderson, DN. Firmin et al., « A single breath-hold multiechoT2* cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload. », J Magn Reson Imaging, 2003 ; 18: 33-9.
- (en) HJ. Weinmann, RC. Brasch, WR. Press et al., « Characteristics of Gadolinium-DTPA complex: a potential NMR contrast agent. », AJR Am J Roentgenol, 1983 ; 142: 619-24.
- (en) J. Schwitter, D. Nanz, S. Kneifel et al., « Assessment of myocardial perfusion in coronary artery disease by magnetic resonance. A comparison with positron emission tomography and coronary angiography. », Circulation, 2001; 103: 2230-5.
- (en) E. Nagel, C. Klein, I. Paetsch et al., « Magnetic resonance perfusion measurements for the noninvasive detection of coronary artery disease. », Circulation, 2003 ; 108: 432-7.
- (en) R. Nijveldt, MB. Hofman, A. Hirsch et al., « Assessment of microvascular obstruction and prediction of short-term remodeling after acute myocardial infarction: cardiac MR imaging study. », Radiology, 2009 ; 250: 363-70.
- J. Barkhausen, P. Hunold, H. Eggebrecht et al., « Detection and characterization of intracardiac thrombi on MR imaging. », AJR Am J Roentgenol, 2002 ; 179: 1539-44.
- (en) OP. Simonetti, RJ. Kim, DS. Fieno et al., « An improved MR imaging technique for the visualization of myocardial infarction. », Radiology, 2001 ; 218: 215-23.
- (en) RJ. Kim, DJ. Shah, RM. Judd, « How we perform delayed enhancement imaging. », J Cardiovasc Magn reson, 2003 ; 5: 505-14.
- (en) AM. Beek, HP. Kuhl, O. Bondarenko et al., « Delayed contrast-enhanced magnetic resonance imaging for the prediction of regional functional improvement after acute myocardial infarction. », J Am Coll Cardiol, 2003 ; 42: 895-901.
- (en) PJ. Kilner, PD. Gatehouse, DN. Firmin, « Flow measurement by magnetic resonance: a unique asset worth optimising. », J Cardiovasc Magn Reson, 2007; 9: 723-8.
- (en) C. Petitjean, N. Rougon, P. Cluzel, « Assessment of myocardial function. A review of quantification methods and results using tagged MRI. », J Cardiovasc Magn Reson, 2005 ; 7: 501-6.
- (en) LE. Hudsmith, S. Neubauer, « Magnetic resonance spectroscopy in myocardial disease. », JACC Cardiovascular Imaging, 2009 ; 2: 87-96.
- (en) A. Wagner, H. Marholdt, TA. Holly et al., « Contrast-enhanced MRI and routine single photon emission computed tomography (SPECT) perfusion imaging for detection of subendocardial myocardial infarcts : an imaging study. », Lancet, 2003 ; 361: 374-9.
- (en) RJ. Kim, E. Wu, A. Rafael et al., « The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. », N Engl J Med, 2000 ; 343: 1445-53.
- (en) KC. Wu, EA. Zerhouni, RM. Judd et al., « Prognostic significance of microvascular obstruction by magnetic resonance imaging in patients with acute myocardial infarction. », Circulation, 1998 ; 97: 765-72.
- (en) R. Nijveldt, A. Beek, A. Hirsch et al., « Functional recovery after acute myocardial infarction: a comparison between angiography, electrocardiography and cardiovascular magnetic resonance measures of microvascular injury. », J Am Coll Cardiol, 2008 ; 52: 181-9.
- (en) J. Wright, T. Adriaenssens, S. Dymarkowski et al., « Quantification of myocardial area at risk with T2-weighted CMR: comparison with contrast-enhanced CMR and coronary angiography. », JACC Cardiovasc Imaging, 2009 ; 2: 825-31.
- (en) JW. Weinsaft, RJ. Kim, M. Ross et al., « Contrast-enhanced anatomic imaging as compared to contrast-enhanced tissue characterization for detection of left ventricular thrombus. », JACC Cardiovasc Imaging, 2009 ; 2: 969-79.
- (en) C. Jahnke, I. Paetsch, K. Nehrke et al., « Rapid and complete coronary arterial tree visualization with magnetic resonance imaging: feasibility and diagnostic performance. », Eur Heart J, 2005 ; 26: 2313-9.
- (en) CM. Matter, M. Stuber, M. Nahrendorf, « Imaging of the unstable plaque: how far have we got. », Eur Heart J, 2009 ; 30: 2566-74.
- (en) AC. Pouleur, JB. le Polain de Waroux, J. Kefer et al., « Direct comparison of whole-heart navigator-gated magnetic resonance coronary angiography and 40- and 64-slice multidetector row computed tomography to detect the coronary artery stenosis in patients scheduled for conventional coronary angiography. », Circ Cardiovasc Imaging, 2008 ; 1: 114-21.
- (en) J. Schwitter, C. Wacker, A. van Rossum et al., « MR-Impact: comparison of perfusion-cardiac magnetic resonance with single-photon emission computed tomography for the detection of coronary artery disease in a multicentre, multivendor, randomized trial. », Eur Heart J, 2008 ; 29: 480-9.
- (en) W. Ingkanisorn, R. Kwong, N. Bohme et al., « Prognosis of negative adenosine stress magnetic resonance in patients presenting to an emergency department with chest pain. », J Am Coll Cardiol, 2006 ; 47: 1427-32.
- (en) C. Jahnke, E. Nagel, R. Gebker et al., « Prognostic value of cardiac magnetic resonance stress tests: adenosine stress perfusion and dobutamine stress wall motion imaging. », Circulation, 2007 ; 115: 1769-76.
- (en) G. Pilz, A. Jeske, M. Klos et al., « Prognostic value of normal adenosine-stress cardiac magnetic resonance imaging. », Am J Cardiol., 2008 ; 101: 1408-12.
- (en) DE. Kivelitz, PM. Dohmen, A. Lembcke et al., « Visualization of the pulmonary valve using cine MR imaging. », Acta Radiology, 2003 ; 44: 172-6.
- (en) DG. Devos, PJ. Kilner, « Calculations of cardiovascular shunts and regurgitation using magnetic resonance ventricular volume and aortic and pulmonary flow measurement. », Eur radiol, 2010 ; 20; 410-21.
- (en) KM. Chan, R. Wage, K. Symmonds et al., « Toward comprehensive assessment of mitral regurgitation using cardiovascular magnetic resonance. », J Cardiovasc Magn Reson, 2008 ; 10: 61.
- (en) AC. Eichenberger, R. Jenni R, GK. Schulthess et al., « Aortic valve pressure gradients in patients with aortic valve stenosis: quantification with velocity-encoded cine MR imaging. », AJR Am J Roentgenol, 1993 ; 160: 971-7.
- (en) SD. Caruthers, S. Jiuan Lin, P. Brown et al., « Practical value of cardiac magnetic resonance imaging for clinical quantification of aortic valve stenosis. Comparison with echocardiography. », Circulation 2003 ; 108: 2236-43.
- (en) AS. John, T. Dill, RR. Brandt et al., « Magnetic resonance to assess the aortic valve area in aortic stenosis. How does it compare to current diagnostic standards? », J Am Coll Cardiol, 2003 ; 42: 519-26.
- (en) PD. Gatehouse, MP. Rolf, MJ. Graves et al., « Flow measurement by cardiovascular magnetic resonance: a multi-centre, multi-vendor study of background phase-offset errors that can compromise the accuracy of derived regurgitant or shunt flow measurements. », J cardiovasc Magn Reson, 2010 ; 12: 5.
- (en) PJ. Kilner, T. Geva, H. Kaemmerer et al., « Recommendations for cardiovascular magnetic resonance in adults with congenital heart disease from the respective working groups of the European society of cardiology. », Eur Heart J, 2010 ; 31: 794-805.
- (en) C. Rickers, NM. Wilke, M. Jerosch-Herold et al., « Utility of cardiovascular magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. », Circulation, 2005 ; 112: 855-61.
- (en) JC. Moon, NG. Fisher, WJ. McKenna et al., « Detection of apical hypertrophic cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. », Heart, 2004 ; 90: 645-9
- (en) SE. Petersen, JB. Selvanayagam, JM. Francis et al., « Differentiation of athlete’s heart from pathological forms of cardiac hypertrophy by means of geometric indices derived from cardiovascular magnetic resonance. », J Cardiovasc Magn Reson, 2005 ; 7: 551-8.
- (en) JC. Moon, WJ. McKenna, JA. McCrohon et al., « Toward risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. », J Am Coll Cardiol, 2003 ; 41: 1561-7.
- (en) AS. Adabag, BJ. Maron, E. Appelbaum et al., « Occurrence and frequency of arrhythmia in hypertrophic cardiomyopathy in relation to delayed enhancement on cardiovascular magnetic resonance. », J Am Coll Cardiol, 2008 ; 51: 1369-74.
- (en) R. Rubinshtein, JF. Glockner, SR. Ommen et al., « Characteristics and clinical significance of late gadolinium enhancement by contrast-enhanced magnetic resonance imaging in patients with hypertrophic cardiomyopathy. », Circ Heart Fail, 2010 ; 3: 51-8.
- (en) MS. Maron, E. Appelbaum, CJ. Harrigan et al., « Clinical profile and significance of delayed enhancement in hypertrophic cardiomyopathy. », Circ Heart Fail, 2008 ; 1: 184-91.
- (en) J. McCrohon, JC. Moon, S. Prasad et al., « Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance. », Circulation, 2003 ; 108: 54-9
- (en) R. Assomull, S. Prasad, J. Lyne et al., « Cardiovascular magnetic resonance, fibrosis, and prognosis in dilated cardiomyopathy. », J Am Coll Cardiol, 2005 ; 48: 1977-85
- (en) RC. Hendel, MR. Patel, CM. Cramer et al., « ACCF/ACR/SCCT/SCMR/ASNC/ NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging. A report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group. », J Am Coll Cardiol, 2006 ; 48: 1475-97. Lire en ligne
- (en) KC. Bilchick, V. Dimaano, KC. Wu et al., « Cardiac magnetic resonance assessment of dyssynchrony and myocardial scar predicts function class improvement following cardiac resynchronization therapy. », JACC Cardiovasc Imaging, 2008 ; 1: 561-8.
- (en) WJ. McKenna, G. Thiene, A. Nava et al., « Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. », Br Heart J, 1994 ; 71: 215-8.
- (en) FI. Marcus, WJ. McKenna, D. Sherrill et al., « Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Proposed modifications of the Task Force Criteria. », Eur Heart J, 2010 ; 31: 806-14.
- (en) H. Vogelsberg, H. Mahrholdt, C. Deluigi et al., « Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. », J Am Coll Cardiol, 2008 ; 51: 1022-30.
- (en) A. Maceira, J. Joshi, SK. Prasad et al., « Cardiovascular magnetic resonance in cardiac amyloidosis. », Circulation, 2005 ; 111: 122-4.
- (en) P. Kirk, M. Roughton, B. Porter et al., « Cardiac T2* magnetic resonance for prediction of cardiac complications in thalassemaia major. », Circulation, 2009 ; 120: 1961-8.
- (en) B. Modell, M. Khan, M. Darlison et al., « Improved survival of thalassemia major in the UK and relation to T2* cardiovascular magnetic resonance. », J Cardiovasc Magn Reson, 2008 ; 10: 42.
- (en) LT. Cooper, « Myocarditis. », N Engl J Med, 2009 ; 360: 1526-38.
- (en) U. Kuhl, M. Pauschinger, B. Seeberg et al., « Viral persistence in the myocardium is associated with progressive cardiac dysfunction. », Circulation, 2005 ; 112: 1965-70.
- (en) U. Kuhl, M. Pauschinger, M. Noutsias et al., « High prevalence of viral genomes and multiple viral infections in the myocardium of adults with « idiopathic » left ventricular dysfunction. », Circulation, 2005 ; 111: 887-93.
- (en) H. Mahrholdt C. Goedecke, A. Wagner et al., « Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. », Circulation, 2004 ; 109: 1250-8.
- (en) H. Mahrholdt, A. Wagner, CC. Deluigi et al., « Presentation, patterns of myocardial damage, and clinical course of myocarditis. », Circulation, 2006 ; 114: 1581-90.
- (en) MG. Friedrich, U. Sechtem, J. Schulz-Menger et al., « Cardiovascular magnetic resonance in myocarditis: a JACC White Paper. », J Am Coll Cardiol, 2009 ; 53: 1475-87.
- (en) JP. Smedema, G. Snoep, MP. van Kroonenburgh et al., « The additional value of gadolinium-enhanced MRI to standard assessment for cardiac involvement in patients with pulmonary sarcoidosis. », Chest, 2005 ; 128: 1629-37.
- (en) MR. Patel, PJ. Cawley, JF. Heitner et al., « Detection of myocardial damage in patients with sarcoidosis. », Circulation, 2009 ; 120: 1969-77.
- (en) IS. Syed, MW. Martinez, DL. Feng et al., « Cardiac magnetic resonance imaging of eosinophilic endomyocardial disease. », Int J Cardiol, 2008 ; 126: e50-2.
- (en) DR. Talreja, WD. Edwards, GK. Danielson et al., « Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. », Circulation, 2003 ; 108: 1852-7.
- (en) J. Bogaert, M. Francone, « Cardiovascular magnetic resonance in pericardial diseases. », J Cardiovasc Magn Reson, 2009 ; 11: 14.
- (en) M. Francone, S. Dymarkowski, M. Kalantzi et al., « Assessment of ventricular coupling with real-time cine MRI and its value to differentiate constrictive pericarditis from restrictive cardiomyopathy. », Eur Radiol, 2006 ; 16: 944-51
- (en) DS. Fieno, R. Saouaf, LE. Thomson et al., « Cardiovascular magnetic resonance of primary tumors of the heart: a review. », J Cardiovasc Magn reson, 2006 ; 8: 839-53.
- (en) H. Matsuoka, M. Hamada, T. Honda et al., « Morphologic and histologic characterization of cardiac myxomas by magnetic resonance imaging. », Angiology, 1996 ; 47: 693-8.
- (en) DP. De Arenaza, M. Pietrani, JC. Moon et al., « Cardiac fibroelastoma: cardiovascular magnetic resonance characteristics. », J Cardiovasc Magn reson, 2007 ; 9: 621.
- (en) M. Funari, N. Fujita, WW. Peck et al., « Cardiac tumors: assessment with Gd-DTPA enhanced MR imaging. », J Comput Assist Tomogr, 1991 ; 15: 593-8.
- (en) AK. Best, RL. Dobson, AR. Ahmad, « Best cases from the AFIP. Cardiac hemangiosarcoma. », Radiographics, 2003 ; 23: S141-5.
- (en) C. Chiles, PK. Woodward, FR. Gutierrez et al., « Metastatic involvement of the heart and pericardium: CT and MR imaging. », Radiographics, 2001 ; 21: 439-49.
- (en) U. Hoffmann, S. Globits, V. Schima et al., « Usefulness of magnetic resonance imaging of cardiac and paracardiac masses. », Am J Cardiol, 2003 ; 92: 890-5
- (en) V. Russo, M. Renzulli, K. Buttazzi et al., « Acquired diseases of the thoracic aorta : role of MRI and MRA. », Eur Radiol, 2006 ; 16: 852-65.
- Site de l'EuroCMR
- SCMR
- (en) GM. Pohost, RJ. Kim, CM. Kramer et al., « Task force 12: Training in advanced cardiovascular imaging (Cadiovascular Mangetic resonance, CMR). Endorsed by the Society for Cardiovascular Magnetic Resonance. », J Am Coll Cardiol, 2006 ; 47: 910-4. [PDF]
- (en) CM. Cramer, J. Barkhausen SD. Flamm et al., « Standardized cardiovascular magnetic resonance imaging (CMR) protocols, society for cardiovascular magnetic resonance: board of trustees task force on standardized protocols. », J Cardiovasc Magn Reson, 2008 ; 10: 35.
- (en) WG. Hundley, D. Bluemke, JG. Bogaert et al., « Society for cardiovascular magnetic resonance guidelines for reporting cardiovascular magnetic resonance examinations. », J Cardiovasc Magn Reson, 2009 ; 11: 5.
Liens externes[modifier | modifier le code]
- Notice dans un dictionnaire ou une encyclopédie généraliste :

