Disiliciure de titane
| Disiliciure de titane | |||
| |||
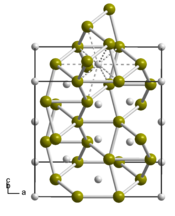
| __ Ti __ Si Structure cristalline du siliciure de titane |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
disiliciure de titane, |
||
| No CAS | |||
| No ECHA | 100.031.719 | ||
| No CE | 234-904-3 | ||
| No RTECS | XR2420000 | ||
| PubChem | 6336889 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | Si2Ti [Isomères] |
||
| Masse molaire[1] | 104,038 ± 0,002 g/mol Si 53,99 %, Ti 46,01 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 760 °C[2] | ||
| Masse volumique | 4,39 g/cm3[2] à 20 °C | ||
| Cristallographie | |||
| Système cristallin | Orthorhombique | ||
| Classe cristalline ou groupe d’espace | Fddd (no 70) |
||
| Précautions | |||
| SGH[2] | |||
| H228, H315, H319, H335, P210, P280, P312, P302+P352, P304+P340, P332+P313 et P337+P313 |
|||
| NFPA 704[2] | |||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le disiliciure de titane, parfois appelé simplement siliciure de titane, est un composé chimique de formule TiSi2. Il s'agit d'un solide noir à l'éclat métallique ayant une bonne conductivité électrique et thermique. Il cristallise dans le système orthorhombique selon le groupe d'espace Fddd (no 70) avec les paramètres a = 825,3 pm, b = 478,3 pm et c = 854,0 pm. Il est insoluble dans l'eau et les acides minéraux hormis l'acide fluorhydrique HF et est lentement soluble dans une solution d'hydroxyde de potassium KOH à 10 %.
Le disiliciure de titane TiSi2 ne doit pas être confondu avec d'autres siliciures de titane, tels que : TiSi1,8, cristallisé dans le groupe d'espace Cmcm (no 63) avec une masse volumique de 3,9 g/cm3 ; Ti3Si, avec une structure quadratique isotypique de celle de Ti3P ; Ti5Si4 avec une structure quadratique isotypique de celle de Zr5Si4 et un point de fusion de 2 120 °C ; TiSi avec une structure orthorhombique isotypique de celle du borure de fer FeB et un point de fusion de 1 760 °C[3]. Il existe également un siliciure de titane de formule Ti5Si3, qui fond à 2 130 °C[4],[5].
Il peut être obtenu en faisant réagir du titane ou de l'hydrure de titane TiH2 avec du silicium[3] :
Il est également possible de procéder par aluminothermie avec la combustion d'un mélange constitué par exemple d'aluminium, de soufre, de dioxyde de silicium SiO2 et de dioxyde de titane TiO2 ou d'hexafluorotitanate de potassium K2TiF6, par électrolyse d'une masse fondue de K2TiF6 et de TiO2, ou par réaction de titane avec du tétrachlorure de silicium SiCl4[3]. Une autre méthode consiste à faire réagir du tétrachlorure de titane TiCl4 avec du silane SiH4, du dichlorosilane SiH2Cl2 ou du silicium[6] :
- TiCl4 + 2 SiH4 ⟶ TiSi2 + 4 HCl + 2 H2 ;
- TiCl4 + 2 SiH2Cl2 + 2 H2 ⟶ TiSi2 + 8 HCl ;
- TiCl4 + 3 Si ⟶ TiSi2 + SiCl4.
Le disiliciure de titane est utilisé dans l'industrie des semiconducteurs, notamment dans le processus de saliciure[5]. Il est également étudié dans le craquage de l'eau par photocatalyse[7] pour la production d'hydrogène vert.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Titanium silicide, 99.5% (metals basis) », sur Alfa Aesar (consulté le ).
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1389. (ISBN 3-432-87813-3)
- « Fiche du composé Titanium silicide, 99.5% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) Lih J. Chen, Silicide Technology for Integrated Circuits (Processing), IET, 2004, p. 49 sqq. (ISBN 0-86341-352-8)
- (en) Hugh O. Pierson, Handbook of Chemical Vapor Deposition: Principles, Technology and Applications, 2e éd., William Andrew, 1999, p. 331. (ISBN 0-8155-1743-2)
- (en) Peter Ritterskamp, Andriy Kuklya, Marc-André Wüstkamp, Klaus Kerpen, Claudia Weidenthaler et Martin Demuth, « A Titanium Disilicide Derived Semiconducting Catalyst for Water Splitting under Solar Radiation—Reversible Storage of Oxygen and Hydrogen », Angewandte Chemie International Edition, vol. 46, no 41, , p. 7770-7774 (DOI 10.1002/anie.200701626, lire en ligne).







