Éther de phénol

En chimie, un éther de phénol (ou éther aromatique) est un composé organique dérivé du phénol (C6H5OH), où le groupe hydroxyle (-OH) est substitué par un groupe alcoxyle (-OR). Les éthers de phénol sont un sous-groupe de la famille des éther-oxydes, composés de formule générale R-O-R' ; dans le cas des éthers de phénol, au moins l'un des groupes R/R' étant un groupe aryle (définition large de la famille, comprenant tous les dérivés aryliques, par exemple les éthers de naphtol) ou un groupe phényle (définition restreinte aux seules dérivés phénylés).
Habituellement, les éthers de phénol sont synthétisés par condensation d'un phénol et d'un alcool ; cependant, d'autres réactions connues pour la synthèse des éthers peuvent également être appliquées aux éthers de phénol. L'anisole (C6H5OCH3) est l'éther de phénol le plus simple et constitue un précurseur polyvalent pour la production de parfums et de composés pharmaceutiques[1]. La vanilline et l'éthylvanilline sont des éthers de phénol couramment utilisés dans les arômes et parfums de vanille, tandis que l'éther diphénylique est couramment utilisé comme parfum de synthèse du géranium[2],[1]. Les éthers de phénol font partie de la structure chimique de divers médicaments, notamment la quinine, un médicament antipaludique, et le dextrométhorphane, un antitussif en vente libre.
Nomenclature[modifier | modifier le code]
Les éthers de phénol suivent la même nomenclature que les éther-oxydes classiques ; les éthers ont la structure R-O-R', mais dans le cas des éthers de phénol, au moins l'un des substituants est un groupe phényle (en abrégé Ph), ce qui signifie une structure générale simple de Ph-O-R'. En conséquence, en nomenclature IUPAC, les éthers de phénol auront souvent un nom de la forme d'« alcoxybenzène » ou « phénoxyalcane », alcoxy- ou -alcane désignant l'autre substituant organique de l'éther. La position (préfixe ou suffixe) du cycle benzénique dans la nom dépend du fait que l'autre alcane ait plus ou moins de carbones que le cycle benzénique lui-même, ou du fait que l'une des deux substituants porte un groupe prioritaire.
Par exemple, l'anisole (nom trivial) est l'éther de phénol formé par condensation du méthanol (CH3 OH) et du phénol (C6H5OH), pour une formule semi-développée globale C6H5-O-CH3 (ou Ph-O-CH3) ; étant donné que le groupe méthyle attaché à l'oxygène est plus petit que le cycle benzénique (un atome de carbone contre six), le benzène est prioritaire, est le nom systématique de la molécule est donc « méthoxybenzène ».
A contrario, l'éther de phénol issu de la condensation du nonan-5-ol et du phénol sera appelé « 5-phénoxynonane », le substituant nonanyle ayant un plus grand nombre d'atomes de carbone que le cycle benzénique (neuf contre six).

En revanche, si le substituant alkyle ou le phényle porte un groupe prioritaire, il deviendra prioritaire, peu importe lequel contient le plus d'atomes de carbone. Par exemple, si le groupe méthyle de l'anisole porte un groupe hydroxyle, il devient alors prioritaire et le nom systématique de la molécule devient « phénoxyméthanol ».
Les règles de priorités des substituants, et les dénominations des composés portant d'autres substituants sur le cycle aromatique suivent la nomenclature standard IUPAC.
Structure et propriétés[modifier | modifier le code]
Les éthers phénols, tout comme les éthers ordinaires, sont moins hydrophiles que leurs précurseurs, les phénols et les alcools, qui peuvent tous deux donner et accepter des liaisons hydrogène. Bien que les éthers de phénol sont toujours capables d'accepter des liaisons hydrogène via l'oxygène éthéré, ce qui permet leur légère solubilité dans les solvants polaires (l'eau et l'éthanol par exemple), la présence du cycle aromatique réduit leur solubilité dans de tels solvants. Par exemple, l'éther diéthylique (C2H5-O-C2H5) a une solubilité dans l'eau de 0,8 g l−1, quand l'éther diphénylique (Ph-O-Ph) a une solubilité de seulement 0,000 2 g l−1[3],[4].
La présence du noyau aromatique éloigne également les électrons de l'oxygène éthéré, ce qui rend l'hydrolyse d'un éther de phénol beaucoup plus difficile que celle d'un éther alkylique. L'oxygène éthéré doit être significativement nucléophile pour que l'éther puisse subir une hydrolyse catalysée par un acide.
Synthèse[modifier | modifier le code]
Les éthers de phénol peuvent être synthétisés par condensation d'un phénol et d'un alcool, catalysée par un acide (le terme « phénol » doit ici être compris au sens famille, comprennent le phénol lui-même, et tous ses dérivés substitués, notamment les benzènediols et autres polyphénols).

Cependant, comme toute synthèse croisée d'éther-oxydes (avec deux alcools différents), il y a risque de formation de sous-produits indésirés, en particulier par des phénomènes d'auto-condensation de l'alcool (par exemple, l'éthanol s'auto-condensant pour former de l'éther diéthylique). Une réaction plus utilisée car à meilleur rendement est la synthèse de Williamson, dans laquelle un phénol est converti par une base forte en ion phénolate, qui peut ensuite réagir avec un halogénure d'alkyle via une substitution nucléophile pour former l'éther de phénol désiré. Pour cette réaction, les halogénures d'alkyle primaires fonctionnent mieux, les halogénures d'alkyle secondaires et tertiaires ayant tendance à réagir par élimination bimoléculaire[5]. Cette synthèse d'éther supprime le risque d'auto-condensation et les rendements peuvent atteindre 95 % en laboratoire.

Les éthers bis-aryliques (tels que l'éther diphénylique) ne peuvent cependant pas être synthétisés par la synthèse de Williamson, car les halogénures d'aryle ne peuvent pas subir de substitution nucléophile. On peut cependant dans ce cas passer par une condensation d'Ullmann (en), une réaction faisant réagir un halogénure d'aryle avec un phénol pour former un éther bis-arylique en présence d'un catalyseur à base de cuivre, par exemple l'oxyde de cuivre(II)[6].

Applications[modifier | modifier le code]

Les éthers de phénol sont souvent utilisés dans la conception pharmaceutique en tant que substituant agissant comme accepteur de liaison hydrogène, mais pas comme donneur de liaison hydrogène ; cela permet à de nombreux médicaments oraux de suivre la règle des cinq de Lipinski (en)[7]. En remplaçant l'hydrogène acide du phénol par celui d'un groupe alkyle, la toxicité des phénols est également réduite ; la DL50 du phénol chez le rat lorsqu'il est administré par voie orale est de 317 mg/kg, contre 3 500 à 4 000 mg/kg pour l'anisole, son éther méthylique[8],[9]. De plus, les éthers de phénol sont nettement plus hydrophobes que les phénols et peuvent être plus facilement absorbés par le système digestif que le substituant phénol lui-même, et permettent la prise orale de ces médicaments[10]. Par exemple, l'oméprazole, un médicament oral qui traite le reflux acide, contient un substituant éther de phénol.
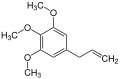
En raison du caractère hydrophobe accru des éthers de phénol par rapport aux phénols traditionnels, les éthers de phénol sont souvent présents dans les huiles essentielles des plantes[11]. On peut citer l'anéthol, un composé contenant un groupe éther phénol, qui est le principal composant de l'huile d'anis (vert ou étoilé), ou encore l'élémicine, un composé organique naturel contenant trois groupes éther de phénol, composant majeur des huiles de muscade et de macis[12].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phenol ether » (voir la liste des auteurs).
- Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Iwata, Miki, Fujita, Buysch et Garbe, Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 3527306730, DOI 10.1002/14356007.a19_313), « Phenol Derivatives »
- (en-US) « The Flavor Rundown: Natural vs. Artificial Flavors », Science in the News, (consulté le )
- « Diethyl ether | C4H10O | ChemSpider », www.chemspider.com (consulté le )
- « ICSC 0791 - DIPHENYL ETHER », www.inchem.org (consulté le )
- L. G. Wade, Organic chemistry, Glenview, IL, 9th, (ISBN 978-0-321-97137-1, OCLC 923017665)[page à préciser]
- Monnier et Taillefer, « Catalytic C-C, C-N, and C-O Ullmann-Type Coupling Reactions », Angewandte Chemie International Edition, vol. 48, no 38, , p. 6954–6971 (PMID 19681081, DOI 10.1002/anie.200804497)
- Lipinski, Lombardo, Dominy et Feeney, « Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings », Advanced Drug Delivery Reviews, vol. 46, nos 1–3, , p. 3–26 (PMID 11259830, DOI 10.1016/s0169-409x(00)00129-0)
- (en-US) « CDC - Immediately Dangerous to Life or Health Concentrations (IDLH): Phenol - NIOSH Publications and Products », www.cdc.gov, (consulté le )
- (en) PubChem, « Anisole », pubchem.ncbi.nlm.nih.gov (consulté le )
- Lipinski, « Lead- and drug-like compounds: the rule-of-five revolution », Drug Discovery Today: Technologies, vol. 1, no 4, , p. 337–341 (PMID 24981612, DOI 10.1016/j.ddtec.2004.11.007)
- (en) « ESSENTIAL OIL | Definition of ESSENTIAL OIL by Oxford Dictionary on Lexico.com also meaning of ESSENTIAL OIL » [archive du ], Lexico Dictionaries | English (consulté le )
- Chemistry of spices, Wallingford, UK, CABI Pub, (ISBN 978-1-84593-420-0, OCLC 646755829)[page à préciser]