« Cofacteur à molybdène » : différence entre les versions
m Formulation. |
|||
| Ligne 150 : | Ligne 150 : | ||
| supplement = |
| supplement = |
||
}}<!-- ----------------------------- Fin de l'infoboite ----------------------------- --> |
}}<!-- ----------------------------- Fin de l'infoboite ----------------------------- --> |
||
Le '''cofacteur à molybdène''', parfois abrégé en '''MoCo''', est un [[Cofacteur (biochimie)|cofacteur]] nécessaire à l'activité de certaines [[enzyme]]s telles que la [[xanthine oxydase]], la [[DSMO réductase]], la [[sulfite oxydase]], la [[nitrate réductase]], l'[[éthylbenzène hydroxylase]] {{nobr|({{N° EC|1|17|99|2}}),}} la [[glycéraldéhyde-3-phosphate déshydrogénase à ferrédoxine]] {{nobr|({{N° EC|1|2|7|6}})}} et l'[[arséniate réductase à glutarédoxine]] {{nobr|({{N° EC|1|20|4|1}}) |
Le '''cofacteur à molybdène''', parfois abrégé en '''MoCo''', est un [[Cofacteur (biochimie)|cofacteur]] nécessaire à l'activité de certaines [[enzyme]]s telles que la [[xanthine oxydase]], la [[DSMO réductase]], la [[sulfite oxydase]], la [[nitrate réductase]], l'[[éthylbenzène hydroxylase]] {{nobr|({{N° EC|1|17|99|2}}),}} la [[glycéraldéhyde-3-phosphate déshydrogénase à ferrédoxine]] {{nobr|({{N° EC|1|2|7|6}})}} et l'[[arséniate réductase à glutarédoxine]] {{nobr|({{N° EC|1|20|4|1}})}}<ref name="pmid16261263">{{en}} |
||
{{cite journal |
|||
| author = G. Schwarz |
|||
| title = Molybdenum cofactor biosynthesis and deficiency |
|||
| journal = Cell. Mol. Life Sci. |
|||
| volume = 62 |
|||
| issue = 23 |
|||
| pages = 2792-2810 |
|||
| year = 2005 |
|||
| month = décembre |
|||
| pmid = 16261263 |
|||
| doi = 10.1007/s00018-005-5269-y |
|||
| url = |
|||
| issn = |
|||
}}</ref>{{,}}<ref name="pmid18411266">{{en}} |
|||
{{cite journal |
|||
| author = B. Smolinsky, S. A. Eichler, S. Buchmeier, J. C. Meier, G. Schwarz |
|||
| title = Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis |
|||
| journal = J. Biol. Chem. |
|||
| volume = 283 |
|||
| issue = 25 |
|||
| pages = 17370–9 |
|||
| year = 2008 |
|||
| month = juin |
|||
| pmid = 18411266 |
|||
| doi = 10.1074/jbc.M800985200 |
|||
| url = |
|||
| issn = |
|||
}}</ref>. Chimiquement, ce cofacteur résulte de la formation d'un [[Complexe (chimie)|complexe]] entre un [[oxyde]] de [[molybdène]] et une [[molécule]] de [[molybdoptérine]], ou un dérivé — parfois assez éloigné — de molybdoptérine. |
|||
Les [[nitrogénase]]s, [[phylogénétique]]ment plus anciennes, sont les seules enzymes connues utilisant le molybdène mais sans molybdoptérine — elles utilisent à la place des [[Cluster fer-soufre|centres fer-soufre]], de structure très différente |
Les [[nitrogénase]]s, [[phylogénétique]]ment plus anciennes, sont les seules enzymes connues utilisant le molybdène mais sans molybdoptérine — elles utilisent à la place des [[Cluster fer-soufre|centres fer-soufre]], de structure très différente dans laquelle le molybdène est lié à d'autres atomes [[métal]]liques ; elles permettent à certaines [[bactérie]]s et [[cyanobactérie]]s de fixer l'[[Diazote|azote]] atmosphérique. |
||
Ce cofacteur peut revêtir diverses formes actives chez les [[procaryote]]s, tel que le ''bis(molybdoptérine guanine dinucléotide)molybdène'' ci-dessous : |
Ce cofacteur peut revêtir diverses formes actives chez les [[procaryote]]s, tel que le ''bis(molybdoptérine guanine dinucléotide)molybdène'' ci-dessous : |
||
Version du 12 juin 2011 à 08:02
| Cofacteur à molybdène | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 25202532 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H12MoN5O8PS2 [Isomères] |
| Masse molaire[1] | 521,29 ± 0,04 g/mol C 23,04 %, H 2,32 %, Mo 18,41 %, N 13,43 %, O 24,55 %, P 5,94 %, S 12,3 %, |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Modèle:GroupeEspace |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le cofacteur à molybdène, parfois abrégé en MoCo, est un cofacteur nécessaire à l'activité de certaines enzymes telles que la xanthine oxydase, la DSMO réductase, la sulfite oxydase, la nitrate réductase, l'éthylbenzène hydroxylase (EC ), la glycéraldéhyde-3-phosphate déshydrogénase à ferrédoxine (EC ) et l'arséniate réductase à glutarédoxine (EC )[2],[3]. Chimiquement, ce cofacteur résulte de la formation d'un complexe entre un oxyde de molybdène et une molécule de molybdoptérine, ou un dérivé — parfois assez éloigné — de molybdoptérine.
Les nitrogénases, phylogénétiquement plus anciennes, sont les seules enzymes connues utilisant le molybdène mais sans molybdoptérine — elles utilisent à la place des centres fer-soufre, de structure très différente dans laquelle le molybdène est lié à d'autres atomes métalliques ; elles permettent à certaines bactéries et cyanobactéries de fixer l'azote atmosphérique.
Ce cofacteur peut revêtir diverses formes actives chez les procaryotes, tel que le bis(molybdoptérine guanine dinucléotide)molybdène ci-dessous :
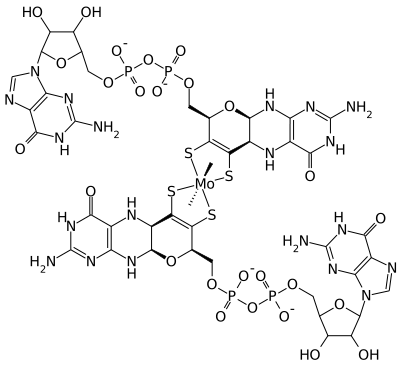
Structure du bis(molybdoptérine guanine dinucléotide)molybdène bactérien[4].
Le cofacteur à molybdène utilisé par la sulfite oxydase a encore une structure différente :

Structure du MoCo de la sulfite oxydase, avec un résidu cystéine lié à l'atome de molybdène[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) G. Schwarz, « Molybdenum cofactor biosynthesis and deficiency », Cell. Mol. Life Sci., vol. 62, no 23, , p. 2792-2810 (PMID 16261263, DOI 10.1007/s00018-005-5269-y)
- (en) B. Smolinsky, S. A. Eichler, S. Buchmeier, J. C. Meier, G. Schwarz, « Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis », J. Biol. Chem., vol. 283, no 25, , p. 17370–9 (PMID 18411266, DOI 10.1074/jbc.M800985200)
- (en) G. Schwarz, R. R. Mendel, M. W. Ribbe, « Molybdenum cofactors, enzymes and pathways » Le modèle {{Guillemets}} ne doit pas être utilisé dans l'espace encyclopédique, Nature, août 2009, 460 (7257) 839-847. DOI 10.1038/nature08302.


