« Méthacrylate de méthyle » : différence entre les versions
m Correction syntaxique (Espace manquant avant un lien) |
Rédaction. |
||
| Ligne 1 : | Ligne 1 : | ||
{{Infobox Chimie |
{{Infobox Chimie |
||
| nom = Méthacrylate de méthyle |
| nom = Méthacrylate de méthyle |
||
| image = |
| image = Methyl methacrylate 200.svg |
||
| |
| taille image = 150 |
||
| alternative = |
|||
| taille image = 150 |
|||
| image2 = |
|||
| légende = [[Fichier:methyl-methacrylate-skeletal.png|130px]][[Fichier:Methyl methacrylate-3d.png|130px]]<br /> Structure du méthacrylate de méthyle |
|||
| taille image2 = 200 |
|||
| alternative2 = |
|||
| images = <!--[[Fichier:|130px]][[Fichier:|130px]]<br>--> |
|||
| légende = Structure du méthacrylate de méthyle |
|||
<!-- Général --> |
<!-- Général --> |
||
| DCI = |
| DCI = |
||
| nomIUPAC = 2-méthylprop-2-énoate de méthyle |
| nomIUPAC = 2-méthylprop-2-énoate de méthyle |
||
| |
| nomSystematique = |
||
| synonymes = |
|||
| CAS = {{CAS|8|0|6|2|6}} |
|||
| |
| CAS = {{CAS|8|0|6|2|6}} |
||
| |
| ECHA = 100.001.180 |
||
| |
| EINECS = {{EINECS|2|0|1|2|9|7|1}} |
||
| RTECS = {{RTECS|OZ5075000}} |
|||
| DrugBank = |
|||
| ATC = {{ATC|}} {{ATCvet|}} |
|||
| PubChem = |
|||
| |
| DrugBank = |
||
| PubChem = {{CID|6658}}{{SID|}} |
|||
| NrE = |
|||
| |
| chEBI = 34840 |
||
| NrE = {{NrE|}} |
|||
| SMILES = C=C(C)C(=O)OC |
|||
| FEMA = {{FEMA|}} |
|||
| InChI = 1/C5H8O2/c1-4(2)5(6)7-3/h1H2,2-3H3 |
|||
| SMILES = CC(=C)C(=O)OC |
|||
| InChIKey = |
|||
| |
| InChI = |
||
| |
| InChIKey = |
||
| StdInChI = 1S/C5H8O2/c1-4(2)5(6)7-3/h1H2,2-3H3 |
|||
| apparence = liquide incolore, d'odeur caractéristique<ref name="ICSC">{{ICSC|80-62-6}}</ref>. |
|||
| StdInChIKey = VVQNEPGJFQJSBK-UHFFFAOYSA-N |
|||
| apparence = liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air<ref name="GESTIS">{{GESTIS|ZVG=13350|CAS=80-62-6|Nom=Methyl methacrylate|Date=16 avril 2022}}</ref> |
|||
<!-- Propriétés chimiques --> |
<!-- Propriétés chimiques --> |
||
| formule = |C=5|H=8|O=2 |
| formule = {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}}|C=5|H=8|O=2|cacher=oui <!--|exp=|categorisationAuto=désactivée--> |
||
| masseMol = |
| masseMol = |
||
| pKa = |
| pKa = {{pKa||T(°C)=|T(K)=}} |
||
| momentDipolaire = |
| momentDipolaire = {{unité/2||D}} |
||
| susceptibiliteMagnetique = |
| susceptibiliteMagnetique = |
||
| diametreMoleculaire = |
| diametreMoleculaire = {{unité/2||nm}} |
||
| indiceIode = |
| indiceIode = |
||
| indiceAcide = |
| indiceAcide = |
||
| indiceSaponification = |
| indiceSaponification = |
||
<!-- Propriétés physiques --> |
<!-- Propriétés physiques --> |
||
| TTransitionVitreuse = |
| TTransitionVitreuse = {{tmp||°C}} |
||
| fusion = {{tmp|-48|°C}}<ref name=" |
| fusion = {{tmp|-48|°C}}<ref name="GESTIS"/> |
||
| ebullition = {{tmp| |
| ebullition = {{tmp|101|°C}}<ref name="GESTIS"/> |
||
| solubilite = |
| solubilite = {{Unité|15|g/L}}<ref name="GESTIS"/> à {{tmp|20|°C}} |
||
| parametreSolubilite = <!-- {{Unité/2||MPa|1/2}} ({{température||°C}}) --> |
|||
| miscibilite = |
|||
| miscibilite = |
|||
| masseVolumique = {{unité/2|0.94|g||cm|-3}}<ref name="ICSC"/> |
|||
| |
| masseVolumique = {{Unité|0.94|g/cm3}}<ref name="GESTIS"/> à {{tmp|20|°C}} |
||
| |
| TAutoInflammation = {{tmp|430|°C}}<ref name="GESTIS"/> |
||
| pointEclair = {{tmp|10|°C}}<ref name="GESTIS"/> (coupelle ouverte),<br>{{tmp|2|°C}} (coupelle fermée) |
|||
| limitesExplosivite = {{unité/2|1.7|–=12.5|%vol}}<ref name="ICSC"/> |
|||
| limitesExplosivite = entre 1,7 % ({{unité|70|g/m3}}) et 12,5 % ({{unité|520|g/m3}})<ref name="GESTIS"/> |
|||
| pressionVapeur = {{unité/2|40|mbar}} à {{tmp|20|°C}}<br/>{{unité/2|66.7|mbar}} à {{tmp|30|°C}}<br/>{{unité/2|157|mbar}} à {{tmp|50|°C}} |
|||
| |
| pressionVapeur = {{unité|39.6|hPa}}<ref name="GESTIS"/> à {{tmp|20|°C}} |
||
| viscosite = {{unité|0.6|mPa||s}}<ref name="aa">{{Alfa Aesar|A13030|Methyl methacrylate, 99%, stab.|Date=16 avril 2022}}</ref> à {{tmp|20|°C}} |
|||
| pointCritique = |
|||
| |
| pointCritique = |
||
| pointTriple = |
|||
| conductivitéThermique = |
|||
| conductivitéThermique = {{Unité/2||W||m|-1|K|-1}} |
|||
| conductivitéÉlectrique = |
|||
| conductivitéÉlectrique = |
|||
| vitesseSon = |
|||
| vitesseSon = {{Unité/2||m||s|-1}} |
|||
<!-- Thermochimie --> |
<!-- Thermochimie --> |
||
| emsGaz = |
| emsGaz = {{Unité/2||J||K|-1|mol|-1}} |
||
| emsLiquide = |
| emsLiquide = {{Unité/2||J||K|-1|mol|-1}} |
||
| emsSolide = |
| emsSolide = {{Unité/2||J||K|-1|mol|-1}} |
||
| esfGaz = |
| esfGaz = {{Unité/2||kJ||mol|-1}} |
||
| esfLiquide = |
| esfLiquide = {{Unité/2||kJ||mol|-1}} |
||
| esfSolide = |
| esfSolide = {{Unité/2||kJ||mol|-1}} |
||
| enthFus = |
| enthFus = |
||
| enthVap = |
| enthVap = |
||
| capaciteTherm = |
| capaciteTherm = |
||
{{Infobox Chimie/Capacité thermique |
|||
{{Infobox Chimie/Capacité thermique|facteur=1E3|CpUnite=J·mol<sup>-1</sup>·K<sup>-1</sup>|etat=gaz|masseMol=100.1158|A=-25.526|B=6.0628E-1|C=-5.0627E-4|D=2.2388E-7|E=-4.2286E-11|Tmin=298|Tmax=1500|arrondi=0|graphique=|tailleGraphique=500px|ref=<ref name="Yaws">{{Ouvrage | langue=en | auteur1=Carl L. Yaws | titre=Handbook of Thermodynamic Diagrams | sous-titre=Organic Compounds C8 to C28 | volume=2 | lieu=Huston, Texas | éditeur=Gulf Pub. Co. | année=1996 | pages totales=396 | isbn=0-88415-858-6}}</ref>}} |
|||
| |
| facteur = 1E3 |
||
| CpUnite = J·mol<sup>-1</sup>·K<sup>-1</sup> |
|||
| PCI = |
|||
| etat = gaz |
|||
| masseMol = 100.1158 |
|||
| A = -25.526 |
|||
| B = 6.0628E-1 |
|||
| C = -5.0627E-4 |
|||
| D = 2.2388E-7 |
|||
| E = -4.2286E-11 |
|||
| Tmin = 298 |
|||
| Tmax = 1500 |
|||
| arrondi = 0 |
|||
| graphique = |
|||
| tailleGraphique = 500px |
|||
| ref = <ref name="Yaws"> |
|||
{{Ouvrage |
|||
| langue = en |
|||
| auteur1 = Carl L. Yaws |
|||
| titre=Handbook of Thermodynamic Diagrams |
|||
| sous-titre=Organic Compounds C8 to C28 |
|||
| volume=2 |
|||
| lieu=Huston, Texas |
|||
| éditeur=Gulf Pub. Co. |
|||
| année=1996 |
|||
| pages totales=396 |
|||
| isbn=0-88415-858-6 |
|||
}}</ref> |
|||
}} |
|||
| PCS = |
|||
| PCI = |
|||
<!-- Propriétés biochimiques --> |
<!-- Propriétés biochimiques --> |
||
| codons = |
| codons = |
||
| pHisoelectrique = |
| pHisoelectrique = |
||
| acideAmineEss = |
| acideAmineEss = |
||
<!-- Propriétés électroniques --> |
<!-- Propriétés électroniques --> |
||
| bandeInterdite = |
| bandeInterdite = |
||
| mobiliteElectronique = |
| mobiliteElectronique = |
||
| mobiliteTrous = |
| mobiliteTrous = |
||
| 1reEnergieIonisation = |
| 1reEnergieIonisation = |
||
| constanteDielectrique = |
| constanteDielectrique = |
||
<!-- Cristallographie --> |
<!-- Cristallographie --> |
||
| systemeCristallin = |
| systemeCristallin = |
||
| reseauBravais = |
| reseauBravais = |
||
| Pearson = |
| Pearson = {{SymbolePearson|}} |
||
| classe = <!-- '' ''{{surligner|}}'' '' ({{n°}})--> {{Infobox Chimie/Groupe espace||ref=}} |
|||
| classe = |
|||
| Schoenflies = |
| Schoenflies = |
||
| Strukturbericht = |
| Strukturbericht = |
||
| structureType = |
| structureType = |
||
| parametresMaille = |
| parametresMaille = |
||
| volume = |
| volume = |
||
| macle = |
| macle = |
||
<!-- Propriétés optiques --> |
<!-- Propriétés optiques --> |
||
| refraction = <!--<math>\textit{n}_{D}^{20}</math> = --> <!-- {{réfraction|T=|λ=|k=|}} --> |
|||
| refraction = |
|||
| birefringence = |
| birefringence = |
||
| dispersion = |
| dispersion = |
||
| polychroisme = |
| polychroisme = |
||
| fluorescence = <!-- λ<sub>excitation</sub> {{λ||nm}} ; <br>λ<sub>émission</sub> {{λ||nm}} --> |
|||
| fluorescence = |
|||
| absorption = |
| absorption = |
||
| transparence = |
| transparence = |
||
| pvrRotatoire = |
| pvrRotatoire = <!-- <math>\lbrack\alpha\rbrack_{D}^{25} = </math> --> |
||
| cteVerdet = |
| cteVerdet = |
||
<!-- Précautions --> |
<!-- Précautions --> |
||
| radioactif = |
| radioactif = |
||
| numeroIndex = {{indexCE|}} |
|||
| 67548EEC = |
|||
| SGHref = <ref name="GESTIS"/> |
|||
| 67548EECref = |
|||
| SGH = {{SGH|SGH02|SGH07|Dgr|H225|H315|H317|H335|P210|P233|P280|P302+P352|P304+P340|P403+P235}} |
|||
| symboles = Xi, F |
|||
| SIMDUTref = <ref name="Reptox">{{Reptox|CAS=80-62-6|Date=25 avril 2009}}</ref> |
|||
| numeroIndex = {{indexCE|607-035-00-6}} |
|||
| SIMDUT = {{SIMDUT/2| B2 = Liquide inflammable<br />point d'éclair = {{tmp|2|°C}} coupelle fermée (méthode non rapportée)| D2B = Matière toxique ayant d'autres effets toxiques <br />sensibilisation de la peau chez l'humain ; irritation des yeux chez l'animal<br /><br />Divulgation à 1,0% selon la liste de divulgation des ingrédients}} |
|||
| classificationCE = |
|||
| |
| NFPA704ref = <ref name="aa"/> |
||
| NFPA704 = {{NFPA 704|Health=2|Flammability=3|Reactivity=2|Other=}} |
|||
| s = S(2), S24, S37, S46 |
|||
| transportRef = |
| transportRef = <ref name="GESTIS"/> |
||
| transport = {{ADR|Kemler=339|ONU=1247|Classe=|CodeClassification= |
| transport = {{ADR|Kemler=339|ONU=1247|Classe=3|CodeClassification=|Etiquette=3|Etiquette2=|Etiquette3=|Emballage=II}} |
||
| CIRC = Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme<ref name="IARC"> |
|||
| NFPA704ref = |
|||
{{Lien web |
|||
| NFPA704 = {{NFPA 704|80-62-6}} |
|||
| url = http://monographs.iarc.fr/FR/Classification/crthgr03list.php |
|||
| SIMDUTref = <ref name="Reptox">{{Reptox|CAS=80-62-6|Date=25 avril 2009}}</ref> |
|||
| titre = Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme |
|||
| SIMDUT = {{SIMDUT/2| B2 = Liquide inflammable<br />point d'éclair = {{tmp|2|°C}} coupelle fermée (méthode non rapportée)| D2B = Matière toxique ayant d'autres effets toxiques <br />sensibilisation de la peau chez l'humain ; irritation des yeux chez l'animal<br /><br />Divulgation à 1,0% selon la liste de divulgation des ingrédients}} |
|||
| auteur = IARC Working Group on the Evaluation of Carcinogenic Risks to Humans |
|||
| SGHref = <ref name="SGH">Numéro index {{IndexCE|607-035-00-6}} dans le tableau 3.1 de l'annexe VI du [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:353:0001:1355:FR:PDF règlement CE N° 1272/2008] (16 décembre 2008)</ref> |
|||
| date = 16 janvier 2009 |
|||
| SGH = {{SGH|SGH02|SGH07|Dgr|H225|H335|H315|H317}} |
|||
| site = http://monographs.iarc.fr |
|||
| CIRC = Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme<ref>{{Lien web |
|||
| éditeur = CIRC |
|||
| url = http://monographs.iarc.fr/FR/Classification/crthgr03list.php |
|||
| titre = Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme |
|||
| auteur = IARC Working Group on the Evaluation of Carcinogenic Risks to Humans |
|||
| date = 16 janvier 2009 |
|||
| site = http://monographs.iarc.fr |
|||
| éditeur = CIRC |
|||
| consulté le = 22 août 2009 |
| consulté le = 22 août 2009 |
||
}}</ref> |
}}</ref> |
||
| inhalation = |
| inhalation = |
||
| peau = |
| peau = |
||
| yeux = |
| yeux = |
||
| ingestion = |
| ingestion = |
||
<!-- Écotoxicologie --> |
<!-- Écotoxicologie --> |
||
| DL50 = {{Unité|7870|mg/kg}}<ref name="GESTIS"/> (souris, [[Ingestion|oral]])<!-- <br> (souris, [[Injection intraveineuse|i.v.]]) <br> (souris, [[sous-cutané|s.c.]]) <br> (souris, [[intrapéritonéal|i.p.]]) --> |
|||
| DL50 = |
|||
| CL50 = |
| CL50 = |
||
| LogP = 1,38<ref name=" |
| LogP = 1,38<ref name="GESTIS"/> |
||
| DJA = 0 |
| DJA = {{unité|0.05|mg/kg}} p.c./jour<ref>[http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/hbct-jact/hbct-jact-fra.pdf Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires], publié par [http://www.hc-sc.gc.ca/index-fra.php Santé Canada]</ref> |
||
| ARFD = <!--mg/kg pc--> |
|||
| odorat = bas : {{unité/2|0.01|ppm}}<br />haut : {{unité/2|0.46|ppm}}<ref name="hazmap">{{Lien web|url=http://hazmap.nlm.nih.gov/cgi-bin/hazmap_search?queryx=80-62-6&tbl=TblAgents|titre=Methyl methacrylate|site=hazmap.nlm.nih.gov|consulté le=14 novembre 2009}}</ref> |
|||
| AOEL = <!--mg/kg par jour--> |
|||
| odorat = bas : {{unité|0.01|ppm}}<br>haut : {{unité|0.46|ppm}}<ref name="hazmap"> |
|||
{{Lien web |
|||
| url = http://hazmap.nlm.nih.gov/cgi-bin/hazmap_search?queryx=80-62-6&tbl=TblAgents |
|||
| titre = Methyl methacrylate |
|||
| site = hazmap.nlm.nih.gov |
|||
| consulté le = 14 novembre 2009 |
|||
}}</ref> |
|||
<!-- Données pharmacocinétiques --> |
<!-- Données pharmacocinétiques --> |
||
| CAM = |
| CAM = |
||
| biodisponibilite = |
| biodisponibilite = |
||
| liaisonProteique = |
| liaisonProteique = |
||
| metabolisme = |
| metabolisme = |
||
| demiVieDistrib = |
| demiVieDistrib = |
||
| demiVieElim = |
| demiVieElim = |
||
| stockage = |
| stockage = |
||
| excretion = |
| excretion = |
||
<!-- Considérations thérapeutiques --> |
<!-- Considérations thérapeutiques --> |
||
| classeTherapeutique = |
| classeTherapeutique = |
||
| voieAdministration = |
| voieAdministration = |
||
| grossesse = |
| grossesse = |
||
| conduiteAuto = |
| conduiteAuto = |
||
| precautions = |
| precautions = |
||
| antidote = |
| antidote = |
||
<!-- Caractère psychotrope --> |
<!-- Caractère psychotrope --> |
||
| categoriePsycho = |
| categoriePsycho = |
||
| modeConsommation = |
| modeConsommation = |
||
| autresNoms = |
| autresNoms = |
||
| risqueDependance = |
| risqueDependance = |
||
<!-- Composés apparentés --> |
<!-- Composés apparentés --> |
||
| autres = |
| autres = |
||
| autrescations = |
| autrescations = |
||
| autresanions = |
| autresanions = |
||
| isomères = |
| isomères = |
||
<!-- Supplément --> |
<!-- Supplément --> |
||
| supplement = |
| supplement = |
||
}}<!-- ----------------------------- Fin de l' |
}}<!-- ----------------------------- Fin de l'infoboîte ----------------------------- --> |
||
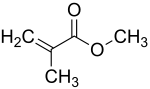
Le '''méthacrylate de méthyle''' ('''{{Abréviation|MMA|Methyl MethAcrylate}}''') est un [[composé chimique]] de [[Formule chimique|formule]] {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}}. C'est l'[[ester]] d'[[acide méthacrylique]] {{fchim|CH|2|{{=}}C(CH|3|)COOH}} et de [[méthanol]] {{fchim|CH|3|OH}}. Il se présente sous la forme d'un liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air. Il tend à [[Polymérisation|polymériser]], surtout s'il contient des impuretés. Cette polymérisation peut être amorcée de manière ciblée, par exemple en ajoutant des [[peroxyde]]s. La température croît brutalement par [[effet Trommsdorff]] et la pression doit être maîtrisée. L'[[enthalpie]] de polymérisation est de {{unité|-59|kJ/mol}} ou {{unité|-590|kJ/kg}}<ref name="978-3-86825-069-5">{{de}} Berufsgenossenschaft Rohstoffe und chemische Industrie, ''Polyreaktionen und polymerisationsfähige Systeme'', brochure {{nobr|R 008}}, édition de mai 2015, {{p.|26}}. {{ISBN|978-3-86825-069-5}}</ref>. |
|||
Le |
Le méthacrylate de méthyle est le [[monomère]] du [[polyméthacrylate de méthyle]] ({{Abréviation|PMMA|Poly(Methyl MethAcrylate)}}), [[homopolymère]] dont la production constitue l'essentiel de son utilisation<ref name="10.1002/14356007.a16_441.pub2"> |
||
{{Article |
|||
C’est un [[composé organique]] dont la [[formule semi-développée]] est CH<sub>2</sub>=C(CH<sub>3</sub>)CO<sub>2</sub>CH<sub>3</sub>. |
|||
| langue = en |
|||
| nom1 = William Bauer Jr. |
|||
| titre = Methacrylic Acid and Derivatives |
|||
| périodique = Ullmann's Encyclopedia of Industrial Chemistry |
|||
| volume = |
|||
| numéro = |
|||
| jour = 15 |
|||
| mois = octobre |
|||
| année = 2011 |
|||
| pages = |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_441.pub2 |
|||
| consulté le = 16 avril 2022 |
|||
| doi = 10.1002/14356007.a16_441.pub2 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref> ; il intervient également dans la production de [[copolymère]]s tels que le méthacrylate de méthyle-[[butadiène]]-[[styrène]] (MBS), utilisé pour modifier les propriétés du [[Polychlorure de vinyle|PVC]]. |
|||
== Production == |
|||
Cet [[ester]] [[méthyl]]ique de l’[[acide méthacrylique]] est un [[monomère]] qui se présente sous la forme d’un liquide incolore utilisé pour la fabrication de verres [[Transparence|transparent]]s et de [[Matière plastique|plastique]]s en [[polyméthacrylate de méthyle]] (PMMA). |
|||
Compte tenu des volumes de méthacrylate de méthyle produits dans le monde, de nombreuses méthodes ont été développées pour sa production à partir de [[Précurseur (chimie)|précurseurs]] à deux ou quatre atomes de carbone<ref name="10.1002/14356007.a16_441.pub2"/>{{,}}<ref name="10.1039/c8cs00117k"> |
|||
==Production== |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Mohammad Jaber Darabi Mahboub, Jean-Luc Dubois, Fabrizio Cavani, Mohammad Rostamizadeh et Gregory S. Patience |
|||
| titre = Catalysis for the synthesis of methacrylic acid and methyl methacrylate |
|||
| périodique = Chemical Society Reviews |
|||
| volume = 47 |
|||
| numéro = 20 |
|||
| jour = 13 |
|||
| mois = septembre |
|||
| année = 2018 |
|||
| pages = 7703-7738 |
|||
| url texte = https://pubs.rsc.org/en/content/articlelanding/2018/CS/C8CS00117K |
|||
| consulté le = 16 avril 2022 |
|||
| doi = 10.1039/c8cs00117k |
|||
| pmid = 30211916 |
|||
| bibcode = |
|||
}}</ref>. Deux voies de synthèse sont principalement utilisées. |
|||
=== Par la cyanhydrine d'acétone === |
|||
Les principaux producteurs mondiaux sont [[Cyro]], [[Arkema]], [[BASF]], [[Dow Chemical]], [[Polyméthacrylate de méthyle|Lucite]], [[Celanese]] et [[Rohm and Haas]], [[Mitsubishi Rayon]] et [[Sumitomo]]. {{refnec|Aux [[États-Unis]] en 1993, la production s'élevait à 600 000 tonnes par an (t/a) et la production mondiale a été estimée à 3,2 millions de t/a en 2005.}} |
|||
La [[cyanhydrine d'acétone]] {{fchim|(CH|3|)C(OH)C≡N}}, souvent notée ACH, est obtenue par [[Réaction de condensation|condensation]] d'[[acétone]] {{fchim|(CH|3|)C{{=}}O}} et de [[cyanure d'hydrogène]] HCN. Elle est [[Hydrolyse|hydrolysée]] en présence d'[[acide sulfurique]] {{fchim|H|2|SO|4}} pour former un [[organosulfate]] de {{Lien|langue=en|trad=Methacrylamide|fr=méthacrylamide}} {{fchim|CH|2|{{=}}C(CH|3|)CONH|2}}<ref name="10.15227/orgsyn.029.0061"> |
|||
Pour sa fabrication, la plupart des fabricants utilisent la voie de la [[cyanohydrine d'acétone]] (ACH), pour laquelle l’[[acétone]] et le [[cyanure d'hydrogène]] servent de matières premières. La cyanohydrine qui est un produit intermédiaire est convertie par l'[[acide sulfurique]] en [[ester]] [[sulfate|sulfaté]] du [[méthacrylamide]], dont l'[[hydrolyse]] donne du [[bisulfate d’ammonium]] et de l’[[acide méthacrylique]] qui, estérifié avec du [[méthanol]], donne le méthacrylate de méthyle. Certains producteurs asiatiques commencent avec l'[[Méthylpropène|isobutène]], ou son équivalent, le [[2-méthylpropan-2-ol|tert-butanol]], qui est oxydé en [[méthacroléine]] ([[acroléine]] [[méthyl]]ée), et de nouveau oxydé en acide méthacrylique ensuite estérifié par le [[méthanol]] pour former le méthacrylate de méthyle. Le [[propène]] peut être [[carbonyl]]é en présence d'acides en [[acide isobutanoïque]], qui subit ultérieurement une [[déshydrogénation]]<ref>William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441. Article Online Posting Date: June 15, 2000</ref>. |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Richard H. Wiley et Walter E. Waddey |
|||
| titre = Methacrylamide |
|||
| périodique = Organic Syntheses |
|||
| volume = 29 |
|||
| numéro = |
|||
| jour = |
|||
| mois = |
|||
| année = 1949 |
|||
| pages = 61 |
|||
| url texte = http://orgsyn.org/Content/pdfs/procedures/CV3P0560.pdf |
|||
| consulté le = 16 avril 2022 |
|||
| doi = 10.15227/orgsyn.029.0061 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. La [[méthanolyse]] de cet [[ester]] donne du {{Lien|langue=en|trad=Ammonium bisulfate|fr=bisulfate d'ammonium}} {{fchim|NH|4|HSO|4}} et du méthacrylate de méthyle. Cette voie de synthèse produit au final des quantités importantes de [[sulfate d'ammonium]] {{fchim|(NH|4|)|2|SO|4}} comme [[sous-produit]]. |
|||
:[[Acétone|{{fchim|(CH|3|)C{{=}}O}}]] + [[Cyanure d'hydrogène|HCN]] ⟶ [[Cyanhydrine d'acétone|{{fchim|(CH|3|)C(OH)C≡N}}]] ; |
|||
:[[Cyanhydrine d'acétone|{{fchim|(CH|3|)C(OH)C≡N}}]] + [[Acide sulfurique|{{fchim|H|2|SO|4}}]] ⟶ {{fchim|(CH|3|)|2|C(OSO|2|OH)CONH|2}}. |
|||
L'ester est en fait produit initialement sous forme d'[[adduit]] {{fchim|(CH|3|)|2|C(OSO|2|OH)CONH|2|·H|2|SO|4}} avec l'acide sulfurique, qui est ensuite [[Clivage (chimie)|clivé]] par [[craquage]], puis méthanolysée : |
|||
La découverte d’une nouvelle technique de production du MMA utilisant comme catalyseur la [[phosphine]] et du [[Palladium (chimie)|palladium]] a été annoncée. Le processus Alpha de Lucite utilise l’[[éthylène]], du [[monoxyde de carbone]] (CO) et du [[méthanol]] (CH<sub>3</sub>OH) comme matières premières pour produire du [[propanoate de méthyle]], qui se combine ensuite avec le [[Méthanal|formaldéhyde]] (HCHO) pour produire du MMA et de l'eau<ref>http://www.chemsystems.com/reports/search/docs/abstracts/0405-2_abs.pdf</ref>. |
|||
:{{fchim|(CH|3|)|2|C(OSO|2|OH)CONH|2}} + [[Méthanol|{{fchim|CH|3|OH}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + {{Lien|langue=en|trad=Ammonium bisulfate|fr=Bisulfate d'ammonium|texte={{fchim|NH|4|HSO|4}}}}. |
|||
Ce mode de synthèse a fait l'objet de nombreuses optimisations<ref name="10.1016/S0926-860X(01)00810-9"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Koichi Nagai |
|||
| titre = New developments in the production of methyl methacrylate |
|||
| périodique = Applied Catalysis A: General |
|||
| volume = 221 |
|||
| numéro = 1-2 |
|||
| jour = 30 |
|||
| mois = novembre |
|||
| année = 2001 |
|||
| pages = 367-377 |
|||
| url texte = https://www.sciencedirect.com/science/article/abs/pii/S0926860X01008109 |
|||
| consulté le = 16 avril 2022 |
|||
| doi = 10.1016/S0926-860X(01)00810-9 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. |
|||
=== Par le propanoate de méthyle === |
|||
Le [[propanoate de méthyle]] {{fchim|CH|3|CH|2|COOCH|3}} est obtenu par {{Lien|langue=en|trad=Carboalkoxylation|fr=carboalcoxylation}} d'[[éthylène]] {{fchim|CH|2|{{=}}CH|2}}<ref name="978-1-4614-4259-2">{{en}} Scott D. Barnicki, « Chapter 10. Synthetic Organic Chemicals », James A. Kent, ''Handbook of Industrial Chemistry and Biotechnology'', {{12e|{{éd.}}}}, 2012, Springer, New York. {{ISBN|978-1-4614-4259-2}}</ref> : |
|||
:[[Éthylène|{{fchim|C|2|H|4}}]] + [[Monoxyde de carbone|CO]] + [[Méthanol|{{fchim|CH|3|OH}}]] ⟶ [[Propanoate de méthyle|{{fchim|CH|3|CH|2|COOCH|3}}]]. |
|||
La synthèse du propanoate de méthyle est réalisée dans un réacteur à réservoir agité en continu à une température et une pression modérées en utilisant un agencement d'agitation et de mélange gaz-liquide spécifiques. Dans un deuxième groupe de réactions, le propanoate de méthyle est [[Réaction de condensation|condensé]] avec le [[formaldéhyde]] HCHO en une seule étape de réaction hétérogène pour former le méthacrylate de méthyle : |
|||
:[[Propanoate de méthyle|{{fchim|CH|3|CH|2|COOCH|3}}]] + [[Formaldéhyde|HCHO]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + [[Eau|{{fchim|H|2|O}}]]. |
|||
La réaction du propanoate de méthyle avec le formaldéhyde est réalisée sur un lit fixe de [[catalyse]]ur en [[oxyde de césium]] {{fchim|CsO|2}} sur [[Dioxyde de silicium|silice]] {{fchim|SiO|2}}, qui permet d'obtenir une bonne [[Sélectivité (chimie)|sélectivité]] du méthacrylate de méthyle à partir du propanoate de méthyle. Il se forme des résidus de composés plus lourds et peu volatils qui empoisonnent le catalyseur, résidus qui sont facilement nettoyés afin de permettre la régénération du catalyseur et la restauration de la production. Le méthacrylate de méthyle est séparé de l'eau, du propanoate de méthyle du formaldéhyde par une première [[distillation]], tandis que l'eau et le propanoate de méthyle sont recyclés par [[Réaction de déshydratation|déshydratation]] du formaldéhyde. Le méthacrylate de méthyle est purifié à plus de 99,9 % par {{Lien|langue=en|trad=Vacuum distillation|fr=distillation sous vide}}. |
|||
=== Autres voies de synthèse === |
|||
==== Par le propanal ==== |
|||
L'[[éthylène]] {{fchim|C|2|H|4}} est d'abord [[Hydroformylation|hydroformylé]] pour donner du [[propanal]] {{fchim|CH|3|CH|2|CHO}}, qui est ensuite [[Réaction de condensation|condensé]] avec du [[formaldéhyde]] HCHO pour produire de la [[méthacroléine]] {{fchim|CH|2|{{=}}C(CH|3|)CHO}}. La condensation est catalysée par une [[amine secondaire]]. L'[[oxydation]] à l'[[air]] de la méthacroléine en [[acide méthacrylique]] {{fchim|CH|2|{{=}}C(CH|3|)COOH}} complète la synthèse de l'acide<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:[[Propanal|{{fchim|CH|3|CH|2|CHO}}]] + [[Formaldéhyde|HCHO]] ⟶ [[Méthacroléine|{{fchim|CH|2|{{=}}C(CH|3|)CHO}}]] + [[Eau|{{fchim|H|2|O}}]] ; |
|||
:[[Méthacroléine|{{fchim|CH|2|{{=}}C(CH|3|)CHO}}]] + 1⁄2 [[Dioxygène|{{fchim|O|2}}]] ⟶ [[Acide méthacrylique|{{fchim|CH|2|{{=}}C(CH|3|)COOH}}]]. |
|||
==== À partir de l'acide isobutyrique ==== |
|||
L'[[acide isobutyrique]] {{fchim|(CH|3|)|2|CHCOOH}} est obtenu par [[hydrocarboxylation]] du [[propylène]] {{fchim|CH|2|{{=}}CHCH|3}} en présence de [[fluorure d'hydrogène]] comme [[catalyse]]ur : |
|||
:[[Propylène|{{fchim|CH|2|{{=}}CHCH|3}}]] + [[Monoxyde de carbone|CO]] + [[Eau|{{fchim|H|2|O}}]] ⟶ [[Acide isobutyrique|{{fchim|(CH|3|)|2|CHCOOH}}]]. |
|||
La [[déshydrogénation]] oxydante de l'acide isobutyrique donne l'[[acide méthacrylique]] {{fchim|CH|2|{{=}}C(CH|3|)COOH}} selon une réaction catalysée par des oxydes métalliques<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:[[Acide isobutyrique|{{fchim|(CH|3|)|2|CHCOOH}}]] + 1⁄2 [[Dioxygène|{{fchim|O|2}}]] ⟶ [[Acide méthacrylique|{{fchim|CH|2|{{=}}C(CH|3|)COOH}}]] + [[Eau|{{fchim|H|2|O}}]]. |
|||
==== Par le méthylacétylène ==== |
|||
Le [[propyne]] {{fchim|HC≡CCH|3}}, ou ''méthylacétylène'', est converti en méthacrylate de méthyle par la [[chimie de Reppe]] en une étape avec un rendement de 99 % à l'aide d'un [[catalyse]]ur dérivé d'[[acétate de palladium(II)]] {{fchim|(CH|3|COO)|2|Pd}}, [[Ligand (chimie)|ligands]] [[phosphine]] {{fchim|PH|3}} et [[Acide de Brønsted|acides de Brønsted]]<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:[[Propyne|{{fchim|HC≡CCH|3}}]] + [[Monoxyde de carbone|CO]] + [[Méthanol|{{fchim|CH|3|OH}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}}. |
|||
==== Par l'isobutylène ==== |
|||
Les réactions par la oxydation directe consistent en une oxydation en deux étapes d'[[isobutylène]] {{fchim|CH|2|{{=}}C(CH|3|)|2}} ou d'[[Alcool tert-butylique|alcool {{nobr|''tert''-butylique}}]] {{fchim|(CH|3|)|3|COH}} avec de l'[[air]] pour produire de l'[[acide méthacrylique]] {{fchim|CH|2|{{=}}C(CH|3|)COOH}} et une [[estérification]] par le [[méthanol]] {{fchim|CH|3|OH}} pour produire le méthacrylate de méthyle<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:[[Isobutylène|{{fchim|CH|2|{{=}}C(CH|3|)|2}}]] + [[Dioxygène|{{fchim|O|2}}]] ⟶ [[Méthacroléine|{{fchim|CH|2|{{=}}C(CH|3|)CHO}}]] + [[Eau|{{fchim|H|2|O}}]] ; |
|||
:[[Méthacroléine|{{fchim|CH|2|{{=}}C(CH|3|)CHO}}]] + 1⁄2 [[Dioxygène|{{fchim|O|2}}]] ⟶ [[Acide méthacrylique|{{fchim|CH|2|{{=}}C(CH|3|)COOH}}]] ; |
|||
:[[Acide méthacrylique|{{fchim|CH|2|{{=}}C(CH|3|)COOH}}]] + [[Méthanol|{{fchim|CH|3|OH}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + [[Eau|{{fchim|H|2|O}}]]. |
|||
==== Par le méthacrylonitrile ==== |
|||
Le {{Lien|langue=en|trad=Methacrylonitrile|fr=méthacrylonitrile}} {{fchim|CH|2|{{=}}C(CH|3|)C≡N}} peut être produit par [[ammoxydation]] à partir d'[[isobutylène]] {{fchim|CH|2|{{=}}C(CH|3|)|2}} : |
|||
:[[Isobutylène|{{fchim|CH|2|{{=}}C(CH|3|)|2}}]] + [[Ammoniac|{{fchim|NH|3}}]] + 3⁄2 [[Dioxygène|{{fchim|O|2}}]] ⟶ {{Lien|langue=en|trad=Methacrylonitrile|fr=Méthacrylonitrile|texte={{fchim|CH|2|{{=}}C(CH|3|)C≡N}}}} + 3 [[Eau|{{fchim|H|2|O}}]]. |
|||
Cette étape est analogue à la voie industrielle vers l'[[acrylonitrile]] {{fchim|CH|2|{{=}}CHC≡N}}, un [[Composé chimique|composé]] apparenté. Le méthacrylonitrile peut être [[Réaction d'hydratation|hydraté]] en {{Lien|langue=en|trad=Methacrylamide|fr=méthacrylamide}} {{fchim|CH|2|{{=}}C(CH|3|)CONH|2}} par l'[[acide sulfurique]] {{fchim|H|2|SO|4}} : |
|||
:{{Lien|langue=en|trad=Methacrylonitrile|fr=Méthacrylonitrile|texte={{fchim|CH|2|{{=}}C(CH|3|)C≡N}}}} + [[Acide sulfurique|{{fchim|H|2|SO|4}}]] + [[Eau|{{fchim|H|2|O}}]] ⟶ {{Lien|langue=en|trad=Methacrylamide|fr=Méthacrylamide|texte={{fchim|CH|2|{{=}}C(CH|3|)CONH|2}}}}·[[Acide sulfurique|{{fchim|H|2|SO|4}}]] ; |
|||
:{{Lien|langue=en|trad=Methacrylamide|fr=Méthacrylamide|texte={{fchim|CH|2|{{=}}C(CH|3|)CONH|2}}}}·[[Acide sulfurique|{{fchim|H|2|SO|4}}]] + [[Méthanol|{{fchim|CH|3|OH}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + {{Lien|langue=en|trad=Ammonium bisulfate|fr=Bisulfate d'ammonium|texte={{fchim|NH|4|HSO|4}}}}. |
|||
[[Mitsubishi Gas Chemical Company|Mitsubishi Gas Chemicals]] a proposé d'hydrater le méthacrylonitrile en méthacrylamide sans utiliser d'acide sulfurique puis de l'estérifier par du [[formiate de méthyle]] {{fchim|HCOOCH|3}} pour obtenir le méthacrylate de méthyle<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:{{Lien|langue=en|trad=Methacrylonitrile|fr=Méthacrylonitrile|texte={{fchim|CH|2|{{=}}C(CH|3|)C≡N}}}} + [[Eau|{{fchim|H|2|O}}]] ⟶ {{Lien|langue=en|trad=Methacrylamide|fr=Méthacrylamide|texte={{fchim|CH|2|{{=}}C(CH|3|)CONH|2}}}} ; |
|||
:{{Lien|langue=en|trad=Methacrylamide|fr=Méthacrylamide|texte={{fchim|CH|2|{{=}}C(CH|3|)CONH|2}}}} + [[Formiate de méthyle|{{fchim|HCOOCH|3}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + [[Formamide|{{fchim|HCONH|2}}]] ; |
|||
:[[Formamide|{{fchim|HCONH|2}}]] ⟶ [[Ammoniac|{{fchim|NH|3}}]] + [[Monoxyde de carbone|CO]]. |
|||
==== Estérification de la méthacroléine ==== |
|||
[[Asahi Kasei|Asahi Chemical]] a développé un procédé reposant sur l'estérification oxydante directe de la [[méthacroléine]] {{fchim|CH|2|{{=}}C(CH|3|)CHO}}, qui ne produit pas de sous-produits tels que le {{Lien|langue=en|trad=Ammonium bisulfate|fr=bisulfate d'ammonium}} {{fchim|NH|4|HSO|4}}. La matière première est l'[[Alcool tert-butylique|alcool {{nobr|''tert''-butylique}}]], comme dans la méthode par oxydation directe. Dans la première étape, la méthacroléine est produite de la même manière que dans le processus d'oxydation directe par oxydation catalytique en phase gazeuse et est simultanément oxydée et estérifiée dans du méthanol liquide pour obtenir directement le méthacrylate de méthyle<ref name="10.1016/S0926-860X(01)00810-9"/> : |
|||
:[[Méthacroléine|{{fchim|CH|2|{{=}}C(CH|3|)CHO}}]] + [[Méthanol|{{fchim|CH|3|OH}}]] + 1⁄2 [[Dioxygène|{{fchim|O|2}}]] ⟶ {{fchim|CH|2|{{=}}C(CH|3|)COOCH|3}} + [[Eau|{{fchim|H|2|O}}]]. |
|||
==Utilisations== |
==Utilisations== |
||
| Ligne 188 : | Ligne 356 : | ||
Ce composé organique est également présent dans certains médicaments, dans la liste des excipients. (par exemple dans la RITALINE L.P. 20mg) |
Ce composé organique est également présent dans certains médicaments, dans la liste des excipients. (par exemple dans la RITALINE L.P. 20mg) |
||
== Notes et références == |
|||
==Références== |
|||
<references/> |
|||
{{Références}} |
|||
== Liens externes == |
|||
==Liens externes== |
|||
* [http://www.chemicalland21.com/arokorhi/industrialchem/functional%20Monomer/METHYL%20METHACRYLATE.htm Chemical data on Chemicalland] |
* [http://www.chemicalland21.com/arokorhi/industrialchem/functional%20Monomer/METHYL%20METHACRYLATE.htm Chemical data on Chemicalland] |
||
* [http://www.epa.gov/chemfact/methy-sd.txt US Environmental Protection Agency, 1994 data] |
* [http://www.epa.gov/chemfact/methy-sd.txt US Environmental Protection Agency, 1994 data] |
||
| Ligne 200 : | Ligne 370 : | ||
* [http://www.bamm.net Basic Acrylic Monomer Manufacturers (BAMM)] |
* [http://www.bamm.net Basic Acrylic Monomer Manufacturers (BAMM)] |
||
==Liens en français== |
== Liens en français == |
||
*{{fr}} [https://www.cdc.gov/niosh/ipcsnfrn/nfrn0300.html Fiche internationale de sécurité] |
*{{fr}} [https://www.cdc.gov/niosh/ipcsnfrn/nfrn0300.html Fiche internationale de sécurité] |
||
| Ligne 208 : | Ligne 378 : | ||
{{DEFAULTSORT:Methacrylate de methyle}} |
{{DEFAULTSORT:Methacrylate de methyle}} |
||
[[Catégorie:Monomère]] |
|||
[[Catégorie:Ester de méthyle]] |
[[Catégorie:Ester de méthyle]] |
||
[[Catégorie:Ester méthacrylique]] |
[[Catégorie:Ester méthacrylique]] |
||
[[Catégorie:Monomère]] |
|||
Version du 16 avril 2022 à 18:30
| Méthacrylate de méthyle | |
| |
| Structure du méthacrylate de méthyle | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthylprop-2-énoate de méthyle |
| No CAS | |
| No ECHA | 100.001.180 |
| No CE | 201-297-1 |
| No RTECS | OZ5075000 |
| PubChem | 6658 |
| ChEBI | 34840 |
| SMILES | |
| InChI | |
| Apparence | liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air[1] |
| Propriétés chimiques | |
| Formule | CH2=C(CH3)COOCH3 |
| Masse molaire[2] | 100,115 8 ± 0,005 2 g/mol C 59,98 %, H 8,05 %, O 31,96 %, |
| Propriétés physiques | |
| T° fusion | −48 °C[1] |
| T° ébullition | 101 °C[1] |
| Solubilité | 15 g/L[1] à 20 °C |
| Masse volumique | 0,94 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 430 °C[1] |
| Point d’éclair | 10 °C[1] (coupelle ouverte), 2 °C (coupelle fermée) |
| Limites d’explosivité dans l’air | entre 1,7 % (70 g/m3) et 12,5 % (520 g/m3)[1] |
| Pression de vapeur saturante | 39,6 hPa[1] à 20 °C |
| Viscosité dynamique | 0,6 mPa s[3] à 20 °C |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[1] | |
| H225, H315, H317, H335, P210, P233, P280, P302+P352, P304+P340 et P403+P235 |
|
| SIMDUT[6] | |
  B2, D2B, |
|
| NFPA 704[3] | |
| Transport[1] | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[5] | |
| Écotoxicologie | |
| DL50 | 7 870 mg/kg[1] (souris, oral) |
| LogP | 1,38[1] |
| DJA | 0,05 mg/kg p.c./jour[7] |
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,46 ppm[8] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le méthacrylate de méthyle (MMA) est un composé chimique de formule CH2=C(CH3)COOCH3. C'est l'ester d'acide méthacrylique CH2=C(CH3)COOH et de méthanol CH3OH. Il se présente sous la forme d'un liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air. Il tend à polymériser, surtout s'il contient des impuretés. Cette polymérisation peut être amorcée de manière ciblée, par exemple en ajoutant des peroxydes. La température croît brutalement par effet Trommsdorff et la pression doit être maîtrisée. L'enthalpie de polymérisation est de −59 kJ/mol ou −590 kJ/kg[9].
Le méthacrylate de méthyle est le monomère du polyméthacrylate de méthyle (PMMA), homopolymère dont la production constitue l'essentiel de son utilisation[10] ; il intervient également dans la production de copolymères tels que le méthacrylate de méthyle-butadiène-styrène (MBS), utilisé pour modifier les propriétés du PVC.
Production
Compte tenu des volumes de méthacrylate de méthyle produits dans le monde, de nombreuses méthodes ont été développées pour sa production à partir de précurseurs à deux ou quatre atomes de carbone[10],[11]. Deux voies de synthèse sont principalement utilisées.
Par la cyanhydrine d'acétone
La cyanhydrine d'acétone (CH3)C(OH)C≡N, souvent notée ACH, est obtenue par condensation d'acétone (CH3)C=O et de cyanure d'hydrogène HCN. Elle est hydrolysée en présence d'acide sulfurique H2SO4 pour former un organosulfate de méthacrylamide CH2=C(CH3)CONH2[12]. La méthanolyse de cet ester donne du bisulfate d'ammonium NH4HSO4 et du méthacrylate de méthyle. Cette voie de synthèse produit au final des quantités importantes de sulfate d'ammonium (NH4)2SO4 comme sous-produit.
- (CH3)C=O + HCN ⟶ (CH3)C(OH)C≡N ;
- (CH3)C(OH)C≡N + H2SO4 ⟶ (CH3)2C(OSO2OH)CONH2.
L'ester est en fait produit initialement sous forme d'adduit (CH3)2C(OSO2OH)CONH2·H2SO4 avec l'acide sulfurique, qui est ensuite clivé par craquage, puis méthanolysée :
Ce mode de synthèse a fait l'objet de nombreuses optimisations[13].
Par le propanoate de méthyle
Le propanoate de méthyle CH3CH2COOCH3 est obtenu par carboalcoxylation d'éthylène CH2=CH2[14] :
- C2H4 + CO + CH3OH ⟶ CH3CH2COOCH3.
La synthèse du propanoate de méthyle est réalisée dans un réacteur à réservoir agité en continu à une température et une pression modérées en utilisant un agencement d'agitation et de mélange gaz-liquide spécifiques. Dans un deuxième groupe de réactions, le propanoate de méthyle est condensé avec le formaldéhyde HCHO en une seule étape de réaction hétérogène pour former le méthacrylate de méthyle :
- CH3CH2COOCH3 + HCHO ⟶ CH2=C(CH3)COOCH3 + H2O.
La réaction du propanoate de méthyle avec le formaldéhyde est réalisée sur un lit fixe de catalyseur en oxyde de césium CsO2 sur silice SiO2, qui permet d'obtenir une bonne sélectivité du méthacrylate de méthyle à partir du propanoate de méthyle. Il se forme des résidus de composés plus lourds et peu volatils qui empoisonnent le catalyseur, résidus qui sont facilement nettoyés afin de permettre la régénération du catalyseur et la restauration de la production. Le méthacrylate de méthyle est séparé de l'eau, du propanoate de méthyle du formaldéhyde par une première distillation, tandis que l'eau et le propanoate de méthyle sont recyclés par déshydratation du formaldéhyde. Le méthacrylate de méthyle est purifié à plus de 99,9 % par distillation sous vide.
Autres voies de synthèse
Par le propanal
L'éthylène C2H4 est d'abord hydroformylé pour donner du propanal CH3CH2CHO, qui est ensuite condensé avec du formaldéhyde HCHO pour produire de la méthacroléine CH2=C(CH3)CHO. La condensation est catalysée par une amine secondaire. L'oxydation à l'air de la méthacroléine en acide méthacrylique CH2=C(CH3)COOH complète la synthèse de l'acide[13] :
- CH3CH2CHO + HCHO ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH.
À partir de l'acide isobutyrique
L'acide isobutyrique (CH3)2CHCOOH est obtenu par hydrocarboxylation du propylène CH2=CHCH3 en présence de fluorure d'hydrogène comme catalyseur :
- CH2=CHCH3 + CO + H2O ⟶ (CH3)2CHCOOH.
La déshydrogénation oxydante de l'acide isobutyrique donne l'acide méthacrylique CH2=C(CH3)COOH selon une réaction catalysée par des oxydes métalliques[13] :
- (CH3)2CHCOOH + 1⁄2 O2 ⟶ CH2=C(CH3)COOH + H2O.
Par le méthylacétylène
Le propyne HC≡CCH3, ou méthylacétylène, est converti en méthacrylate de méthyle par la chimie de Reppe en une étape avec un rendement de 99 % à l'aide d'un catalyseur dérivé d'acétate de palladium(II) (CH3COO)2Pd, ligands phosphine PH3 et acides de Brønsted[13] :
Par l'isobutylène
Les réactions par la oxydation directe consistent en une oxydation en deux étapes d'isobutylène CH2=C(CH3)2 ou d'alcool tert-butylique (CH3)3COH avec de l'air pour produire de l'acide méthacrylique CH2=C(CH3)COOH et une estérification par le méthanol CH3OH pour produire le méthacrylate de méthyle[13] :
- CH2=C(CH3)2 + O2 ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH ;
- CH2=C(CH3)COOH + CH3OH ⟶ CH2=C(CH3)COOCH3 + H2O.
Par le méthacrylonitrile
Le méthacrylonitrile CH2=C(CH3)C≡N peut être produit par ammoxydation à partir d'isobutylène CH2=C(CH3)2 :
- CH2=C(CH3)2 + NH3 + 3⁄2 O2 ⟶ CH2=C(CH3)C≡N + 3 H2O.
Cette étape est analogue à la voie industrielle vers l'acrylonitrile CH2=CHC≡N, un composé apparenté. Le méthacrylonitrile peut être hydraté en méthacrylamide CH2=C(CH3)CONH2 par l'acide sulfurique H2SO4 :
- CH2=C(CH3)C≡N + H2SO4 + H2O ⟶ CH2=C(CH3)CONH2·H2SO4 ;
- CH2=C(CH3)CONH2·H2SO4 + CH3OH ⟶ CH2=C(CH3)COOCH3 + NH4HSO4.
Mitsubishi Gas Chemicals a proposé d'hydrater le méthacrylonitrile en méthacrylamide sans utiliser d'acide sulfurique puis de l'estérifier par du formiate de méthyle HCOOCH3 pour obtenir le méthacrylate de méthyle[13] :
- CH2=C(CH3)C≡N + H2O ⟶ CH2=C(CH3)CONH2 ;
- CH2=C(CH3)CONH2 + HCOOCH3 ⟶ CH2=C(CH3)COOCH3 + HCONH2 ;
- HCONH2 ⟶ NH3 + CO.
Estérification de la méthacroléine
Asahi Chemical a développé un procédé reposant sur l'estérification oxydante directe de la méthacroléine CH2=C(CH3)CHO, qui ne produit pas de sous-produits tels que le bisulfate d'ammonium NH4HSO4. La matière première est l'alcool tert-butylique, comme dans la méthode par oxydation directe. Dans la première étape, la méthacroléine est produite de la même manière que dans le processus d'oxydation directe par oxydation catalytique en phase gazeuse et est simultanément oxydée et estérifiée dans du méthanol liquide pour obtenir directement le méthacrylate de méthyle[13] :
- CH2=C(CH3)CHO + CH3OH + 1⁄2 O2 ⟶ CH2=C(CH3)COOCH3 + H2O.
Utilisations
La principale utilisation du méthacrylate de méthyle est la production de matière plastique acrylique en polyméthacrylate de méthyle. Le méthacrylate de méthyle est aussi utilisé pour la production du copolymères du méthacrylate de méthyle-butadiène-styrène (MBS), utilisé comme modificateur du polychlorure de vinyle (PVC).
Les polymères du méthacrylate de méthyle et les copolymères sont utilisés pour fabriquer des peintures à l'eau. Ils servent également à la formulation d’adhésifs.
Une application récente est l'utilisation de films pour empêcher la lumière des écrans LCD d'ordinateurs et de téléviseurs de diffuser de manière non directionnelle.
Le méthacrylate de méthyle est également utilisé pour préserver de la corrosion les moulages anatomiques d’organes, comme le cœur et les artères coronaires.
Il est également utilisé pour la formation d'ongles artificiels.
Ce composé organique est également présent dans certains médicaments, dans la liste des excipients. (par exemple dans la RITALINE L.P. 20mg)
Notes et références
- Entrée « Methyl methacrylate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Methyl methacrylate, 99%, stab. », sur Alfa Aesar (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Méthacrylate de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- « Methyl methacrylate », sur hazmap.nlm.nih.gov (consulté le )
- (de) Berufsgenossenschaft Rohstoffe und chemische Industrie, Polyreaktionen und polymerisationsfähige Systeme, brochure R 008, édition de mai 2015, p. 26. (ISBN 978-3-86825-069-5)
- (en) William Bauer Jr., « Methacrylic Acid and Derivatives », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a16_441.pub2, lire en ligne)
- (en) Mohammad Jaber Darabi Mahboub, Jean-Luc Dubois, Fabrizio Cavani, Mohammad Rostamizadeh et Gregory S. Patience, « Catalysis for the synthesis of methacrylic acid and methyl methacrylate », Chemical Society Reviews, vol. 47, no 20, , p. 7703-7738 (PMID 30211916, DOI 10.1039/c8cs00117k, lire en ligne)
- (en) Richard H. Wiley et Walter E. Waddey, « Methacrylamide », Organic Syntheses, vol. 29, , p. 61 (DOI 10.15227/orgsyn.029.0061, lire en ligne)
- (en) Koichi Nagai, « New developments in the production of methyl methacrylate », Applied Catalysis A: General, vol. 221, nos 1-2, , p. 367-377 (DOI 10.1016/S0926-860X(01)00810-9, lire en ligne)
- (en) Scott D. Barnicki, « Chapter 10. Synthetic Organic Chemicals », James A. Kent, Handbook of Industrial Chemistry and Biotechnology, 12e éd., 2012, Springer, New York. (ISBN 978-1-4614-4259-2)
Liens externes
- Chemical data on Chemicalland
- US Environmental Protection Agency, 1994 data
- Intox Cheminfo data
- SRI Consulting PEP report
- Methacrylate Producers Association (MPA)
- National Pollutant Inventory - Methyl methacrylate fact sheet
- Basic Acrylic Monomer Manufacturers (BAMM)







