Chlorure d'américium(III)
Apparence
| Chlorure d'américium(III) | |
| |
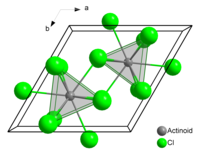
| Structure du chlorure d'américium(III) : __ Am3+ __ Cl− | |
| Identification | |
|---|---|
| No CAS | |
| SMILES | |
| InChI | |
| Apparence | cristaux roses opaques |
| Propriétés chimiques | |
| Formule | AmCl3 [Isomères] |
| Masse molaire[1] | 349 g/mol Am 69,65 %, Cl 30,48 %, |
| Propriétés physiques | |
| T° fusion | 715 °C[2] |
| T° ébullition | 850 °C[3] |
| Masse volumique | 5,87 g·cm-3[3] |
| Cristallographie | |
| Système cristallin | Hexagonal |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | (no 176) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure d'américium(III) ou trichlorure d'américium est le composé chimique constitué d'américium et de chlore de formule AmCl3. Il forme des cristaux roses hexagonaux.
À l'état solide, chaque atome d'américium a neuf atomes de chlore comme proches voisins, approximativement à la même distance[4],[5].
L'hexahydrate a une structure cristalline monoclinique avec : a = 970,2 pm, b = 656,7 pm et c = 800,9 pm ; β = 93° 37' ; groupe d'espace : P2/n[6].
Réactions
[modifier | modifier le code]Une méthode d'électroraffinage (en) utilisant du chlorure d'américium(III) a été étudiée pour le séparer des mélanges d'actinides, puisque l'énergie libre de Gibbs standard de formation du chlorure d'américium(III) est très différente des autres chlorures d'actinides[7].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Americium(III) chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dale L. Perry et Sidney L. Phillips, Handbook of Inorganic Compounds, Boca Raton/New York/London (etc.), CRC Press, (ISBN 0-8493-8671-3, lire en ligne), p. 15
- « Chemistry: Periodic Table: americium: compound data (americium (III) chloride) », WebElements (consulté le )
- (en) L. B. Asprey, T. K. Keenan et F. H. Kruse, « Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium », Inorg. Chem., vol. 4, no 7, , p. 985–986 (DOI 10.1021/ic50029a013).
- (en) A. F. Wells, Structural Inorganic Chemistry, Oxford, Oxford Science Publications, , 5e éd., 1382 p. (ISBN 0-19-855370-6).
- (en) John H. Burns et Joseph Richard Peterson, « The Crystal Structures of Americium Trichloride Hexahydrate and Berkelium Trichloride Hexahydrate », Inorg. Chem., vol. 10, no 1, , p. 147–151 (DOI 10.1021/ic50095a029).
- (en) Nuclear Energy Agency, Proceedings of the Workshop on Pyrochemical Separations, Avignon, France, OECD Publishing, , 336 p. (ISBN 92-64-18443-0, lire en ligne).



