Chlorure de cadmium
| Chlorure de cadmium | ||

| ||
 | ||
| __ Cd2+ __ Cl− | ||
| Identification | ||
|---|---|---|
| No CAS | (anhydre) (monohydrate) (hémipentahydrate) (hydrate) |
|
| No ECHA | 100.030.256 | |
| No CE | 233-296-7 | |
| No RTECS | EV0175000 | |
| PubChem | 24947 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores, solide blanc en masse, hygroscopique, inodore[1] | |
| Propriétés chimiques | ||
| Formule | CdCl2 | |
| Masse molaire[2] | 183,317 ± 0,012 g/mol Cd 61,32 %, Cl 38,68 %, |
|
| Propriétés physiques | ||
| T° fusion | 568 °C[1] | |
| T° ébullition | 960 °C[1] | |
| Solubilité | 1,4 kg·l-1 (eau, 20 °C)[1] | |
| Masse volumique | 4,05 g·cm-3[1] | |
| Pression de vapeur saturante | 13 hPa (656 °C)[3] | |
| Cristallographie | ||
| Système cristallin | Trigonal | |
| Classe cristalline ou groupe d’espace | (no 166) |
|
| Paramètres de maille | a = 3,85 Å c= 17,46 Å |
|
| Précautions | ||
| SGH[3] | ||
| H301, H330, H340, H350, H360FD, H372, H410, P201, P260, P273, P284, P310 et P301+P310 |
||
| NFPA 704[3] | ||
| Transport[1] | ||
| Classification du CIRC | ||
| Groupe 1 | ||
| Écotoxicologie | ||
| DL50 | 10 mg/kg (grenouille, intramusculaire)[4] 63 mg/kg (cochon d'inde, oral)[5] |
|
| LogP | 5[3] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le chlorure de cadmium est un composé chimique inorganique constitué de cadmium et de chlore, de formule CdCl2.
Propriétés physiques et chimiques[modifier | modifier le code]
C'est un solide blanc anhydre à fins cristaux rhombiques incolores, mais hygroscopique, très soluble dans l'eau et légèrement soluble dans l'éthanol.
Même s'il est considéré comme un solide ionique, ses liaisons Cl-Cd ont un fort caractère covalent. Sa structure cristalline rhomboédrique, constituée de couches ioniques à deux dimensions est une référence pour décrire d'autres structures cristallines.
Le chlorure de cadmium se dissout bien dans l'eau et dans les autres solvants polaires. Dans l'eau sa très grande solubilité s'explique en partie par la formation de complexes ioniques tel que [CdCl4]2−., ce qui donne à CdCl2 un caractère d'acide de Lewis doux[13] :
- CdCl2 + 2 Cl− → [CdCl4]2−
Avec de grands cations, il est possible d'isoler l'ion [CdCl5]3− qui a une structure de bipyramide trigonale[14].
Il existe aussi le chlorure de cadmium monohydrate (CdCl2.H2O) et hémipentahydrate (CdCl2.5H2O)[15].
Synthèse ou préparation[modifier | modifier le code]
Le chlorure de cadmium anhydre peut être préparé par réaction entre le dichlore anhydre ou le chlorure d'hydrogène gazeux sur du cadmium métallique chauffé :
- Cd métal + 2 HCl gaz → CdCl2 vapeurs condensées en masses cristallines + H2
De l'acide chlorhydrique peut être utilisé pour former du CdCl2 ionisé et hydraté, puis par réaction avec le métal, l'oxyde de cadmium ou le carbonate de cadmium.
- Cd dissous dans HCl, chauffé à évaporation + 2 HCl gaz → CdCl2 vapeurs condensées en masses cristallines + H2
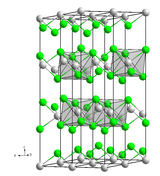
Structure cristalline[modifier | modifier le code]
Le chlorure de cadmium possède un système trigonal du groupe d'espace avec les paramètres a = 3,85 Å et c = 17,46 Å[16]. Cette structure est constituée d'un empilement compact cubique des anions chlorure où les ions cadmium viennent s'insérer dans les sites octaédriques entre deux couches d'anions chlorure (séquence ABCABC, coordination de type 6:3). Les ions cadmium dans ces sites octaédriques sont ainsi entourés de six ions chlorure, et chaque ion chlorure forme le sommet d'un pyramide trigonale dont la base est formée par trois ions cadmium.
Cette structure est une structure de référence en cristallographie et sert à décrire un grand nombre de chlorures de métaux de transition, notamment le chlorure de manganèse(II), le chlorure de fer(II) ou le chlorure de zinc, mais aussi le chlorure de magnésium, le bromure de zinc et l'iodure de nickel(II)[17].
Les halogénures de cadmium, comme CdCl2, CdBr2 ou CdI2, présentent des lacunes sur leurs sites octaédriques, ce qui explique leur facilité à former des couches minces (très utile pour dévoiler ou utiliser leurs propriétés physico-chimiques).
Utilisation[modifier | modifier le code]
Le chlorure de cadmium est un absorbeur de sulfure d'hydrogène. Les solutions de chlorure de cadmium absorbent le sulfure d'hydrogène. Il est d'ailleurs utilisé dans la production artificielle de sulfure de cadmium, utilisé comme « jaune de cadmium », un pigment jaune brillant inorganique stable, qui a servi pour les taxis de New-York.
- CdCl2 ou autres solutions de sels de cadmium+ H2S gaz→ CdS poudre jaune + 2 HCl aqueux
En laboratoire, CdCl2 anhydre peut être utilisé pour la préparation d'organocadmiens de type R2Cd, où R est un aryle ou un alkyle primaire. Ces composés furent utilisés pour la synthèse de cétones à partir de chlorures d'acyle[18] :
- CdCl2 + 2 RMgX → R2Cd + MgCl2 + MgX2
- R2Cd + R'COCl → R'COR + CdCl2
De tels réactifs ont été largement supplantés par les organocuprates beaucoup moins toxiques.
Le chlorure de cadmium peut servir de catalyseur dans la réaction de Biginelli qui produit des 3,4-dihydropyrimidin-2(1H)-ones[19].
Le chlorure de cadmium est aussi utilisé dans les photocopieurs, en microscopie, en photographie, en teinture et galvanoplastie. Il a été utilisé dans l'impression de cotonnades, type calicot.
Sécurité[modifier | modifier le code]
Le chlorure de cadmium est une substance très toxique et dangereuse pour l'environnement. Il est cancérogène, mutagène et peut avoir des effets sur la reproduction. Il a un effet toxique aigu puissant et irritant pour les voies respiratoires après inhalation des vapeurs ou d'aérosols. L'intoxication chronique provoque des dommages aux reins, au foie et aux poumons. Une caractéristique visuelle de l'intoxication au cadmium est la formation d'un ourlet jaune sur le collet de la dent due à la présence de composés sulfurés du cadmium.
Notes et références[modifier | modifier le code]
- Entrée « Cadmium chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 septembre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Cadmium chloride, consultée le 22 septembre 2012.
- Comparative Biochemistry and Physiology, C: Pharmacology, Toxicology and Endocrinology. Vol. 85, Pg. 249, 1986.Pubmed
- Food Research. Vol. 7, Pg. 313, 1942
- Nippon Eiseigaku Zasshi. Japanese Journal of Hygiene. Vol. 32, Pg. 472, 1977 Pubmed
- Toxicology and Applied Pharmacology. Vol. 53, Pg. 510, 1980 https://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Search&db=pubmed&term=6770496 Pubmed
- Acta Pharmacologica et Toxicologica. Vol. 48, Pg. 108, 1981 Pubmed
- Evaluation of the Impact of Cadmium on the Health of Man, Oxford, UK. Pergamon Press Ltd., 1978Vol. -, Pg. 67, 1978.
- EHP, Environmental Health Perspectives. Vol. 28, Pg. 89, 1979 Pubmed
- Toxicology and Applied Pharmacology. Vol. 41, Pg. 667, 1977 Pubmed
- Quarterly Bulletin--Association of Food and Drug Officials of the United States. Vol. 15, Pg. 122, 1951.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, FL, CRC Press, , 87e éd. (ISBN 0-8493-0594-2), p. 4–67; 1363
- D.E. Partin, M. O'Keeffe: The Structures and Crystal Chemistry of Magnesium Chloride and Cadmium Chloride. In: Journal of solid state chemistry. 1991, 95, S. 176-183, DOI 10.1016/0022-4596(91)90387-W.
- (de) Erwin Riedel, Christoph Janiak: Anorganische Chemie, 7e édition, 2007, de Gruyter, (ISBN 978-3-11-018903-2), S. 138.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- A. Venkat Narsaiah, A. K. Basak, K. Nagaiah: Cadmium Chloride: An Efficient Catalyst for One-Pot Synthesis of 3,4-Dihydropyrimidin-2(1H)-ones. In: Synthesis. 2004, 8, S. 1253-1256, DOI 10.1055/s-2004-822383.
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Cadmium chloride » (voir la liste des auteurs) et en allemand « Cadmiumchlorid » (voir la liste des auteurs).









