Anatomie de la barrière hémato-encéphalique
Le rôle de la barrière hémato-encéphalique est d'isoler le cerveau des substances indésirables qui peuvent se trouver dans la circulation sanguine, tout en permettant le passage de nutriments indispensables au fonctionnement du cerveau (20 % du métabolisme général de l'organisme), ainsi que l'évacuation des déchets produits par ce fonctionnement. Par conséquent, une attention toute particulière est portée, dans l'anatomie de la barrière hémato-encéphalique, aux éléments constitutifs de l'étanchéité entre le capillaire et l'espace cérébral, ainsi qu'aux éléments susceptibles de transport actif ou passif des matières entre ces deux espaces.
De la lumière du capillaire aux neurones, on trouve ainsi successivement l'endothélium du capillaire avec toutes ses spécificités d'étanchéité, sa lame basale, les péricytes, qui assurent un contrôle sur les échanges, et enfin les astrocytes, qui recouvrent presque toute la surface avec leurs pieds, et qui se chargent d'effectuer les transports directs entre capillaire et neurones.
Vue générale[modifier | modifier le code]


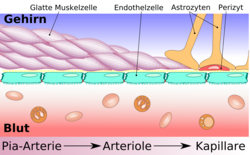
L'élément essentiel de la barrière hémato-encéphalique est constitué par les cellules endothéliales avec leurs jonctions serrées. Mais deux autres types de cellules sont également importants, tant du point de vue de la fonction que celui de la naissance et de la croissance de la barrière hémato-encéphalique : les péricytes et les astrocytes[1]. Les interactions entre cellules endothéliales, péricytes et astrocytes sont plus étroites qu'entre tous autres types de cellules. Ces trois types de cellules forment ensemble la barrière hémato-encéphalique de la plupart des vertébrés, la barrière hémato-encéphalique cellulaire[2],[3]. Les données anatomiques qui suivent se rapportent à la barrière hémato-encéphalique des vertébrés. La barrière hémato-encéphalique gliale de certains vertébrés et de beaucoup d'invertébrés sera abordée séparément à la fin de cette section (voir infra).
L'endothélium[modifier | modifier le code]
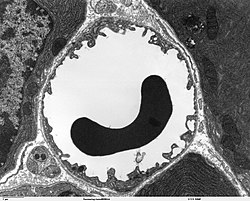
Les capillaires sont tapissés – comme les vaisseaux périphériques – de cellules endothéliales. L'endothélium des capillaires périphériques possède, pour l'échange de l'eau et des matières qui y sont dissoutes ou en suspension entre le sang et le liquide intercellulaire du tissu environnant, des ouvertures (fenêtres) d'environ 50 nm de diamètre et des fentes entre cellules de 0,1 à 1 µm de large. Entre les cellules endothéliales du cerveau, il n'y a au contraire aucun fenestrage, ni fente intercellulaire[4], ce pourquoi on parle aussi d'un « endothélium continu »[5]. La membrane cellulaire du côté de l’intérieur du capillaire (« luminale ») diffère considérablement du point de vue de la composition en protéines de celle de la membrane du côté du tissu interstitiel (« apicale »).
La quantité de vésicules de pinocytose, qui permettent l'endocytose de substances dissoutes, est très faible dans l'endothélium du cerveau[6],[7].
Par contraste, le nombre des mitochondries est environ de 5 à 10 fois plus élevé que dans les capillaires périphériques. Ceci indique le besoin élevé en énergie de l'endothélium – entre autres pour les processus de transport actif – et un métabolisme élevé[8]. La barrière hémato-encéphalique se montre donc une barrière non seulement physique, mais encore métabolique, ou plutôt enzymatique[9],[10],[11],[12],[13]. Dans la membrane cellulaire de l'endothélium, on trouve une série d'enzymes en quantité particulièrement élevée, comme dans les cellules du parenchyme. Ces enzymes comprennent notamment la γ-Glutamyltransférase, la phosphatase alcaline et la glucose-6-phosphatase. Les enzymes métaboliques comme la catéchol-0-méthyltransférase, la monoaminooxydase ou le cytochrome P450 sont également actives en relativement haute concentration dans l'endothélium[14],[15],[16] De cette manière, beaucoup de substances sont métabolisées avant ou pendant leur transport intracellulaire[9]. Les cellules endothéliales sont minces, de 0,3 jusqu'au plus 0,5 µm. Par comparaison, les entérocytes, cellules épithéliales de l'intestin, sont bien plus épaisses, de 17 à 30 µm[17]. Le rapport du cholestérol aux phospholipides se situe, comme pour les autres cellules endothéliales à 0,7[18]. Les processus de simple diffusion à travers la membrane cellulaire sont donc aussi rapides au niveau de la barrière hémato-encéphalique que dans les autres épithéliums[19]. Les cellules endothéliales présentent sur leurs membranes une quantité d'aquaporines pour la régulation de la quantité d'eau au sein du cerveau. Ces canaux spécialisés permettent une libre diffusion des molécules d'eau dans les deux sens[20].
L'absence de fenestrages et le manque de vésicules pinocytotiques représentent l'aspect passif de la barrière hémato-encéphalique. Cet effet de barrière peut être quantifié par sa résistance électrique. Chez un rat adulte et sain, la résistance monte à environ 1 500 à 2 000 Ω cm2. Par opposition, la valeur pour des capillaires de tissu musculaire est d'environ 30 Ω cm2[21].
Les systèmes de transport actifs de l’endothélium décrits plus loin en plus grand détail constituent la partie active de la barrière hémato-encéphalique.
Les jonctions serrées[modifier | modifier le code]
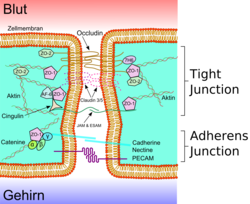

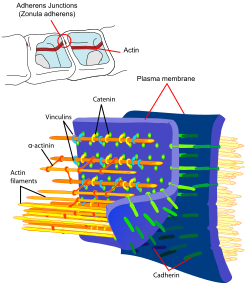
Les cellules endothéliales sont liées ensemble par de solides liaisons, appelées jonctions serrées. Ces jonctions contribuent substantiellement à la fonction de la barrière hémato-encéphalique[22],[23]. Elles ferment pratiquement complètement la voie de transport paracellulaire, c'est-à-dire l'échange de matières entre les membranes de deux cellules endothéliales voisines[24],[25],[26].
Plusieurs protéines membranaires comme l'occludine, diverses claudines et molécules d'adhésion de jonction (JAM sous leur sigle anglophone) relient les cellules endothéliales dans la région apicale des parois cellulaires latérales en bandes de protéines qui font un tour complet, et se connectent en jonctions serrées, qui interdisent largement le transport de matières entre les membranes cellulaires endothéliales[27] Les liaisons protéine-protéine travaillent comme des sécurités en parallèle, c'est-à-dire perdent leur efficacité dès que l'une cède.
Les cellules endothéliales de la barrière hémato-encéphalique expriment surtout deux des 24 claudines connues, la C-5 et la C-12. La C-5 est considérée comme la plus importante des molécules d'adhésion de cellules dans la barrière hémato-encéphalique[28]. La désactivation du gène CLDN5 qui code la claudine-5, conduit chez les souris ainsi modifiées à ce que la barrière hémato-encéphalique devient perméable aux molécules de masse molaire inférieure à 800 g/mol. Les animaux ainsi génétiquement modifiés meurent dans les quelques heures qui suivent leur naissance[29].
Par fixation, l'endothélium montre ses deux faces très différentes : la face luminale, du côté du sang, et la face abluminale, du côté du cerveau[3].
La lame basale[modifier | modifier le code]

Les cellules endothéliales sont complètement entourées par une couche protéique, la lame basale[5]. Cette double couche épaisse de 40 à 50 nm n'est visible qu'au microscope électronique. Elle est constituée essentiellement de collagène de type IV, de protéoglycanes-héparan-sulfate, de laminine, de fibronectine et autres protéines de la matrice extracellulaire. Cette lame basale touche la membrane plasmatique des pieds astrocytaires[7],[24].
Les péricytes[modifier | modifier le code]

Les péricytes, tout d'abord nommés « cellules de Rouget »dans la littérature ancienne, d'après leur découvreur Charles-Marie Benjamin Rouget (1824–1904)[30], sont une partie importante de la barrière hémato-encéphalique[31]. Trois propriétés sont prééminentes dans ce contexte : leur possibilité de contraction, la régulation de l'endothélium, et leur activité de macrophages[32].
Environ 20 % de la surface externe de l'endothélium des capillaires cérébraux est couvert de péricytes relativement petits, de forme ovale. Une cellule endothéliale sur 2 à 4 est en contact avec un péricyte[3]. Les péricytes en contact avec deux cellules endothéliales sont donc privilégiés[33],[34]. Les péricytes se trouvent sur presque tous les artérioles, veinules et capillaires – non seulement sur l'endothélium cérébral. La couverture de l'endothélium avec des péricytes est directement corrélée avec l'étanchéité des jonctions serrées. Dans les capillaires fenestrés, comme dans les muscles squelettiques, le rapport entre cellules endothéliales et péricytes tourne autour de 100[35],[36].
Comme l'endothélium, les péricytes sont aussi entourés d'une lame basale[5].
Le contact cellulaire endothélium-péricyte[modifier | modifier le code]

Ces complexes protéiques en forme de canal sont un des types de liaisons qui relient les péricytes aux cellules endothéliales.
Les péricytes sont solidement amarrés aux cellules endothéliales. Il y a au moins trois sortes de contacts entre ces deux types de cellules. Ce sont les jonctions communicantes (complexes protidiques formant un canal), les plaques d'adhésion focales et les invaginations Peg-and-Socket[32]. Les jonctions communicantes relient directement par leur canal les deux cytoplasmes, en permettant l'échange d'ions et de petites molécules entre les deux types de cellules[37]. Les plaques d'adhésion focales assurent un solide ancrage mécanique des péricytes avec l'endothélium[38]. Les invaginations Peg-and-Socket consistent en protubérances entrelacées de deux cellules interconnectées[39]. Ce type de contact entre cellules contribue aussi apparemment à l'ancrage des péricytes sur l'endothélium[32].
Les deux types de cellules s'influencent réciproquement en raison de leurs mitoses et probablement aussi en raison de l'expression phénotypique des gènes[40].
Contraction[modifier | modifier le code]
Les péricytes comportent une haute proportion de la protéine de structure contractile, l'actine. Ils peuvent donc changer le diamètre des capillaires par leurs prolongements, et donc régulariser localement la pression sanguine[41],[42].
Propriétés macrocytiques[modifier | modifier le code]
Les péricytes des capillaires cérébraux sont apparemment les seuls à présenter une propriété spéciale. Ils y fonctionnent comme macrophages. On trouve donc dans le cytoplasme des péricytes beaucoup de lysosomes, et montrent in vivo la capacité d'absorption de traceurs solubles, apportés par le sang ou le liquide cérébro-spinal, et qui autrement ne sont absorbés que par les macrophages. Dans les cultures de tissus, on a démontré la capacité des péricytes à la phagocytose[43],[44] et à la présentation d'antigène[45],[46],[32]
Ces propriétés de macrocytes sont une « deuxième ligne de défense » contre les molécules neurotoxiques, qui ont déjà franchi la couche endothéliale en direction du cerveau[47]. C'est pourquoi les péricytes contribuent substantiellement à l'immunité du système nerveux central. Par ailleurs, ils participent, via ces propriétés, au développement de certaines maladies, et particulièrement les maladies auto-immunes. On discute aussi d'une participation indirecte à la maladie d'Alzheimer[48],[49].
Autres propriétés des péricytes cérébraux[modifier | modifier le code]
Les péricytes régulent la division cellulaire et la différenciation des cellules endothéliales. Elles proviennent de cellules précurseurs (cellules progéniteurs), issues de cellules souches adultes pluripotentes, qui peuvent se différencier en ostéoblastes, adipocytes, chodrocytes ou cellules analogues à des fibroblastes[40]. Certains auteurs classent les péricytes dans les cellules pluripotentes[30].
Les péricytes synthétisent tout un ensemble d'agonistes vasoactifs[36] et jouent un rôle important lors de la formation de nouveaux vaisseaux (angiogenèse)[50],[40].
Les astrocytes[modifier | modifier le code]
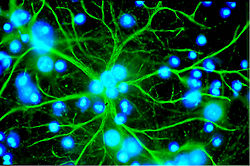


Les astrocytes sont des cellules en étoile de la famille des macroglies, significativement plus grandes que les péricytes. Ils font partie du système nerveux central, et sont capables de division encore après la naissance. Chez les vertébrés supérieurs, ils n'ont aucune fonction directe de barrière, bien qu'ils couvrent les capillaires du cerveau à 99 % avec leurs pieds[3],[51]. Ils sont cependant en interaction immédiate avec les cellules endothéliales[52]. Les astrocytes induisent sur les cellules endothéliales des vaisseaux cérébraux la fonction de barrière hémato-encéphalique. Ceci a été démontré par des expériences de transplantation : des capillaires cérébraux transplantés dans des organes périphériques se sont comportés comme les capillaires « normaux » voisins, en développant par exemple des fenestrages. Inversement, des capillaires périphériques transplantés dans le système nerveux central prennent l'aspect local, avec des jonctions serrées[53],[1]. Cette influence des astrocytes sur l'aspect des cellules endothéliales se montre aussi dans des expériences in vitro : dans des cultures simultanées d'astrocytes et de cellules endothéliales, les endothéliums se montrent plus serrés que dans des cultures pures de cellules endothéliales[1].
Les astrocytes répandent un ensemble d'hormones, qui peuvent moduler la perméabilité de l'endothélium en l'espace de secondes ou de minutes[54]. En sens inverse, les cellules endothéliales sécrètent du facteur inhibiteur de la leucémie (LIF), une cytokine du groupe des interleukines 6, qui induit la différenciation des astrocytes[54]. La distance entre les pieds d'astrocytes et les cellules endothéliales et péricytes n'est que de 20 nm[55],[3].
La fonction principale des astrocytes est cependant l'alimentation des neurones, ainsi que la régulation de la concentration ionique extracellulaire[54],[56]. Une grande partie du cholestérol présent dans le cerveau est produit par les astrocytes. Le cholestérol ne peut pas traverser la barrière hémato-encéphalique, et il faut donc le synthétiser sur place. On trouve dans le cerveau environ 25 % du cholestérol du corps entier ; essentiellement dans la myéline qui gaine les axones des neurones[57].
Les pieds des astrocytes forment un contact en filigrane de rosettes sur les cellules endothéliales. Cet arrangement est important pour l'influence réciproque et la communication entre les deux types de cellules. C'est ainsi qu'une diffusion libre est rendue possible entre les cellules endothéliales et le parenchyme cérébral[54].
Les maladies qui concernent directement ou indirectement les astrocytes, comme la maladie d'Alzheimer ou les astrocytomes, peuvent altérer substantiellement les fonctions de la barrière hémato-encéphalique, en raison de leur interaction étroite.
Domaines du cerveau sans barrière hémato-encéphalique[modifier | modifier le code]


Tous les capillaires du cerveau ne font pas partie de la barrière hémato-encéphalique. Par exemple, les régions cérébrales qui déversent dans le sang des substances neuroendocrines (hormones), ou encore qui ont une fonction sensorielle – par exemple des zones réceptrices de certaines hormones peptidiques – ne peuvent pas avoir de barrière hémato-encéphalique. C'est le cas pour six organes circumventriculaires. L'épiphyse, l'éminence médiane, la neurohypophyse, l'area postrema, l'organe vasculaire de la lame terminale (OVLT) et l'organe subfornical présentent des capillaires fenestrés. Par exemple, c'est ainsi que les neurones de l'area postrema peuvent détecter des substances toxiques, et déclencher un besoin de vomir dans le centre du vomissement. L'organe subcommissural est le seul des organes circumventriculaires qui présente une barrière hémato-encéphalique[58]. Pour protéger les tissus cérébraux avoisinants, les organes circumventriculaires sont entourés de tanycytes. Ce sont des épendymocytes spéciaux, avec des jonctions serrées très étanches[59].
Données sur la barrière hémato-encéphalique[modifier | modifier le code]
C'est un réseau de plus de 100 milliards de capillaires, dont la longueur totale avoisine 600 km pour un adulte, qui parcourt tout le cerveau[19]. La distance moyenne entre ces vaisseaux est de 40 µm[60]. Les zones différentes du cerveau sont irriguées très différemment. La densité de capillaires est maximale dans le cortex cérébral, avec 300 à 800/mm² de tissu[1].
La surface totale des vaisseaux sanguins du cerveau se situe entre 12[61] et 20 m2[62]. Environ 610 ml de sang coulent par minute par ces vaisseaux, à une vitesse moyenne de 1 mm/s. La pression moyenne du sang est de 15 à 35 Torr(mmHg)[8].
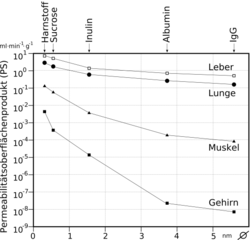
Le temps moyen de passage (Mean transit time – MTT) est de 5 s. Par comparaison, dans l'intestin, où la surface des vaisseaux présente 180 m2, ce temps s'élève à environ 40 heures[63],[64] et dans le foie – avec 70 m2 – de 30 s[65],[66],[67].
Développement de la barrière hémato-encéphalique[modifier | modifier le code]
Jusqu'à la fin du xxe siècle, on est parti de l'hypothèse que chez les fœtus et les nouveau-nés la barrière hémato-encéphalique n'est pas encore complètement constituée (« immature ») ou même absente. Les insuffisances méthodologiques des premières expériences physiologiques sont la cause de cette idée, encore largement répandue : on injectait des colorants pour les protéines, ou encore des protéines, dans les fœtus animaux comme marqueurs. Les premières expériences remontent à 1920[68]. Dans ces expériences, on démontrait la présence des marqueurs dans le cerveau ou dans le liquide cérébro-spinal, chez les fœtus, tandis qu'on ne pouvait pas les détecter chez les adultes. Cependant, le volume des injections pouvait aller jusqu'au volume du sang des animaux[69], ou bien dépassait par un facteur 2 la capacité de fixation des protéines de plasma[70]. Dans les deux cas, la pression osmotique est si élevée qu'elle peut partiellement déchirer les délicats capillaires embryonnaires[71]. Dans des expériences avec des volumes de marqueur réduits, on ne constate plus de passage de marqueur dans le cerveau[72],[73],[74].
Si l'on considère les molécules marqueurs internes au corps, comme l'albumine, l'α-1-fœtoprotéine ou la transferrine, que l'on trouve en très haute concentration dans le plasma pendant le stade embryonnaire très précoce, ces molécules se retrouvent aussi dans l'espace extracellulaire du cerveau à ce stade[75]. Le transporteur d'efflux Glycoprotéine P est déjà présent dans les endothéliums embryonnaires[76]. La barrière hémato-encéphalique est donc bien présente au stade prénatal. Ceci n'exclut cependant pas les modifications pendant le développement embryonnaire, spécialement pour les jonctions serrées. Celles-ci sont déjà présentes entre les cellules endothéliales au stade le plus avancé, mais se développent progressivement[74].
Pour les petites molécules polaires, comme l'inuline ou le saccharose, la perméabilité de la barrière hémato-encéphalique prénatale ou néonatale est significativement plus élevée que chez l'adulte[77],[78],[79]. On peut observer le même effet aussi sur les ions[80]. Le transport des acides aminés à travers la barrière hémato-encéphalique embryonnaire est également significativement renforcé – sans doute en raison des grands besoins pour le développement ultérieur du cerveau[81],[82],[83]. La même considération vaut pour l'hormone insuline[84],.
Par ailleurs, le cerveau embryonnaire développe des barrières morphologiques supplémentaires, qui ne sont plus présentes dans le cerveau adulte. Par exemple, on trouve dans le cerveau embryonnaire, à la surface entre le liquide cérébro-spinal et le tissu nerveux, des jonctions en bride sur l'épendyme interne[85][pas clair].
La barrière hémato-encéphalique dans le règne animal et au cours de l'évolution[modifier | modifier le code]
Au cours de l'évolution, le tissu nerveux des invertébrés et des vertébrés est devenu plus important, plus complexe, et a pris un rôle plus central dans chaque organisme. Cela a permis d'améliorer constamment la coordination des fonctions du corps. Et, ainsi que le montre la théorie de l’évolution, cela conduit à un avantage sélectif. Par contre, une masse cérébrale toujours plus grande et complexe demande un approvisionnement toujours meilleur, ainsi qu'un dispositif d'élimination des déchets. Ceci est effectué chez les invertébrés supérieurs, par exemple dans l’ordre des decapoda ou la classe des céphalopoda, ainsi que chez tous les vertébrés, à un réseau de capillaires à branches multiples dans le cerveau. La formation d'une barrière de protection contre les xénobiotiques, les toxines et autres substances néfastes pour le système nerveux devient alors un autre avantage sur le plan évolutif[86],[2].
Beaucoup d'invertébrés n'ont pas de barrière hémato-encéphalique. Cela signifie que leurs endothéliums ne sont que partiellement recouverts, ou lacunaires. Chez les invertébrés qui possèdent une barrière hémato-encéphalique, comme, chez les insectes, les crustacés et les céphalopodes[87], elle est exclusivement de nature gliale[88]. On parle dans ce cas d'une « barrière hémato-encéphalique gliale »[89].
L'organisme modèle drosophile développe par exemple une barrière hémato-encéphalique gliale[90].
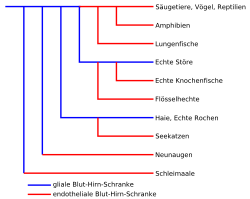
Tous les vertébrés vivant sur la Terre ont une barrière hémato-encéphalique, et presque tous montrent la barrière décrite en détail ci-dessus, où les jonctions serrées des cellules endothéliales apportent une contribution essentielle à l’effet de barrière. Ce n'est que dans le super-ordre des elasmobranchii, comprenant notamment les requins et les raies, et dans la famille des esturgeons vrais, que la barrière hémato-encéphalique est exercée par des astrocytes périvasculaires. On en déduit que quand, au cours de l'évolution, l'endothélium est devenu suffisamment étanche, il a pris le rôle de barrière. La barrière hémato-encéphalique gliale est donc considérée comme la forme primitive. Dans la famille des polypteridae et la sous-classe des dipneustes, la barrière hémato-encéphalique est réalisée par des jonctions serrées de l'épithélium. Par contre chez les vrais esturgeons elle est formée par une enveloppe complexe de cellules gliales, sans jonctions serrées visibles.
Aujourd'hui encore, on trouve chez certains vertébrés des éléments de la barrière gliale. Par exemple dans l'enveloppe gliale de la moelle épinière non vascularisée de la lamproie[91], de même que chez les mammifères dans certaines structures de l’épendyme telles que les tanycytes. Ces derniers tout spécialement dans les organes circum-ventriculaires, dans le plexus choroideus et dans l’épithélium pigmentaire de la rétine[92]. Les astrocytes sont aussi chez les mammifères en principe capables d'établir entre eux des jonctions serrées. Ceci se voit entre autres dans les cellules gaines olfactives, qui entourent les axones pendant leur croissance[93],[2].
Des différences structurelles dans le phénotype de la barrière hémato-encéphalique gliale chez les invertébrés, on peut en outre déduire que ce genre de barrières sont apparues au cours de l'évolution à plusieurs reprises, et de façon indépendante. Les barrières endothéliales offraient un avantage significatif dans la sélection – sans doute en raison de la séparation plus stricte de fonctions entre l'endothélium et les astrocytes. La pression évolutive réelle est probablement issue de la nécessité de l'homéostasie[88]. On peut supposer que la barrière hémato-encéphalique a vu le jour au cours de l'évolution au moins six fois, et que tous les vertébrés avaient il y a 400 à 500 Ma une barrière gliale[2].
Références[modifier | modifier le code]
- (en) T. J. Raub, S. L. Kuentzel et G. A. Sawada, « Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells. », Exp. Cell Res., vol. 199, , p. 330–340 (PMID 1347502).
- (en) M. Bundgaard et N. J. Abbott, « All vertebrates started out with a glial blood-brain barrier 4-500 million years ago. », Glia, no 56, , p. 699–708 (PMID 18338790).
- (en) W. M. Pardridge, « Molecular biology of the blood–brain barrier. », Mol. Biotechnol., vol. 30, , p. 57–69 (PMID 15805577) (article de revue).
- (en) J. C. Lee, « Evolution in the concept of the blood-brain barrier phenomen. », dans Progress in neuropathology, vol. 1, Verlag Grune und Stratton, (ISBN 0-88167-188-6), p. 84–145.
- (de) M. Pavelka et J. Roth, Funktionelle Ultrastruktur., Springer Verlag, , 334 p. (ISBN 978-3-211-83563-0 et 3-211-83563-6), p. 234–235.
- .
- (en) B. T. Hawkins et T. P. Davis, « The blood-brain barrier/neurovascular unit in health and disease. », Pharmacol. Rev., vol. 57, , p. 173–185 (PMID 15914466) (article de revue).
- (de) Björn Bauer, « In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen. », Dissertation, Ruprecht-Karl-Universität Heidelberg, (lire en ligne).
- (de) Stephanie Nobmann, « Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke », Ruprecht-Karls-Universität Heidelberg, (consulté le ).
- (en) R. S. el-Bacha et A. Minn, « Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain. », Cell. Mol. Biol., vol. 45, , p. 15–23 (PMID 10099836).
- (en) M. Chat, C. Bayol-Denizot, G. Suleman, F. Roux et A. Minn, « Drug metabolizing enzyme activities and superoxide formation in primary and immortalized rat brain endothelial cells. », Life Sci., vol. 62, , p. 151–163 (PMID 9488113).
- (en) A. Minn, J.F. Ghersi-Egea, R. Perrin, B. Leininger et G. Siest, « Drug metabolizing enzymes in the brain and cerebral microvessels. », Brain Res. Brain Res. Rev., vol. 116, , p. 65–82 (PMID 1907518).
- (en) Y. Takakura, K.L. Audus et R.T. Borchardt, « Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells. », Adv. Pharmacol., vol. 22, , p. 137–165 (PMID 1958501) (article de revue).
- (en) S. Méresse, M.P. Dehouck, P. Delorme, M. Bensaïd, J.P. Tauber, C. Delbart, J.C. Fruchart et R. Cechelli, « Bovine brain endothelial cells expres tight junctions and monoamine oxidase activity in long-term culture. », J. Neurochem., vol. 53, , p. 1363–1371 (PMID 2571674).
- (en) R. Perrin, A. Minn, J.F. Ghersi-Egea, M.C. Grassiot et G. Siest, « Distribution of cytochrom P450 activities towards alkoxyresorufin derivates in rat brain regions, subcellular fractions and isolated cerebral microvessels. », Biochem. Pharmacol., vol. 40, , p. 2145–2151 (PMID 2242042).
- (en) R. Bendayan, G. Lee et M. Bendayan, « Functional expression and localization of P-glycoprotein at the blood brain barrier. », Microsc. Res. Tech., vol. 57, , p. 365–380 (PMID 12112443) (article de revue.
- (en) Y. Su et P. J. Sinko, « Drug delivery across the blood-brain barrier: why is it difficult? how to measure and improve it? », Expert Opin. Drug Deliv., vol. 3, , p. 419–435 (PMID 16640501) (article de revue).
- (en) H. Fischer, R. Gottschlich et A. Seelig, « Blood–brain barrier permeation: molecular parameters governing passive diffusion. », J. Membr. Biol., vol. 165, , p. 201–211 (PMID 9767674).
- (en) U. Fagerholm, « The highly permeable blood–brain barrier: an evaluation of current opinions about brain uptake capacity. », Drug Discov. Today, vol. 12, , p. 1076–1082 (PMID 18061888).
- (en) Beatrice Nico, Antonio Frigeri, Grazia Paola Nicchia, Fabio Quondamatteo, Rainer Herken, Mariella Errede, Domenico Ribatti, Maria Svelto et Luisa Roncali, « Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier. », J. Cell Sci., vol. 114, , p. 1297–1307 (PMID 11256996, lire en ligne).
- (en) Arthur M. Bott, Hazel C. Jones et N. Joan Abbot, « Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. », J. Physiol., vol. 429, , p. 47–62 (PMID 2277354).
- (en) P. Claude et D. A. Goodenough, « Fracture faces of zonae occludentes from tight and leaky epithelia. », J. Cell Biol., vol. 58, , p. 390–400 (PMID 4199658, lire en ligne).
- (en) Hartwig Wolburg, Jochen Neuhaus, Uwe Kniesel, Bodo Krauß, Eva-Maria Schmid, Mücella Öcalan, Catherine Farrell et Werner Risau, « Modulation of tight junction structure in blood-brain barrier endothelial cells. Effects of tissue culture, second messengers and cocultured astrocytes. », J. Cell Sci., vol. 107, , p. 1347–1357 (PMID 7929640, lire en ligne).
- (en) H.B. Newton, « Advances in strategies to improve drug delivery to brain tumors. », Expert Rev. Neurother., vol. 6, , p. 1495–1509 (PMID 17078789) (Article de revue).
- (en) J. L. Madara, « Tight junction dynamics: is paracellular transport regulated ? », Cell, Cell Press, Elsevier, vol. 53, , p. 497–498 (PMID 3286009).
- (en) H. C. Bauer et al., « Proteins of the tight junctions in the blood-brain barrier », dans Blood-spinal Cord and Brain Barriers in Health and Disease, , p. 1–10.
- (en) R. Cecchelli, V. Berezowski, S. Lundquist, M. Culot, M. Renftel, M.P. Dehouck et L. Fenart, « Modelling of the blood–brain barrier in drug discovery and development. », Nat. Rev. Drug Discov., vol. 6, , p. 650–661 (PMID 17667956)(Article de revue).
- (en) Karl Matter et Maria S. Balda, « Holey barrier: claudins and the regulation of brain endothelial permeability. », J. Cell Biol., vol. 161, , p. 459–460 (PMID 12743096, lire en ligne).
- (en) Takehiro Nitta, Masaki Hata, Shimpei Gotoh, Yoshiteru Seo, Hiroyuki Sasaki, Nobuo Hashimoto, Mikio Furuse et Shoichiro Tsukita, « Size-selective loosening of the blood–brain barrier in claudin-5-deficient mice. », J. Cell Biol., vol. 161, , p. 653–660 (PMID 12743111, lire en ligne).
- (en) Paula Dore-Duffy, « Pericytes: pluripotent cells of the blood brain barrier. », Curr. Pharm. Des., vol. 14, , p. 1581–1593 (PMID 18673199).
- (en) Roumen Balabanov et Paula Dore-Duffy, « Role of the CNS microvascular pericyte in the blood-brain barrier. », J. Neurosci. Res., Wiley, vol. 53, , p. 637–644 (PMID 9753191) (article de revue).
- (en) H.K. Rucker, H.J. Wynder et W.E. Thomas, « Cellular mechanisms of CNS pericytes. », Brain Res. Bull., vol. 51, , p. 363–369 (PMID 10715555).
- (en) Paula A. D'Amore, « Culture and Study of Pericytes », dans Cell Culture Techniques in Heart and Vessel Research, (ISBN 3-540-51934-3), p. 299.
- (en) N. Joan Abbott, « Neurobiology: Glia and the blood-brain barrier. », Nature, Nature Publishing Group, vol. 325, , p. 195 (ISSN 0028-0836, PMID 3808015).
- (en) Char-Huei Laia et Kuo-Hsing Kuo, « The critical component to establish in vitro BBB model: Pericyte. », Brain Res. Brain Res. Rev., Elsevier, vol. 50, , p. 258–265 (PMID 16199092) (article de revue).
- (en) David Shepro et Nicole M. L. Morel, « Pericyte physiology. », The FASEB Journal, vol. 7, , p. 1031–1038 (PMID 8370472, lire en ligne) (article de revue).
- (en) K. Fujimoto, « Pericyte-endothelial gap junctions in developing rat cerebral capillaries: A fine structural study. », Anat. Rec., vol. 242, , p. 562–565 (PMID 7486026)
- (en) L. Díaz-Flores, R. Gutiérrez, H. Varela, N. Rancel et F. Valladares, « A review of their morphological and functional characteristics. », Histol. Histopath., vol. 6, , p. 269–286 (PMID 1802127) (article de revue).
- (en) D. E. Sims, « Recent advances in pericyte biology—Implications for health and disease. », Can. J. Cardiol., vol. 7, , p. 431–443 (PMID 1768982) (article de revue).
- (en) D. E. Sims, « Diversity within pericytes. », Clin. Exp. Pharmacol. Physiol., Wiley, vol. 27, , p. 842–846 (PMID 11022980) (article de revue).
- (en) Ira M. Herman et Patricia A. D'Amore, « Microvascular pericytes contain muscle and nonmuscle actins. », J. Cell Biol., vol. 101, , p. 43–52 (PMID 3891763, lire en ligne).
- (en) Karen K. Hirschi et Patricia A. D’Amore, « Pericytes in the microvasculature. », Cardiovasc. Res., vol. 32, , p. 687–698 (PMID 8915187, lire en ligne) (article de revue).
- (en) M. Mato, S. Ookawara, M. Sugamata et E. Aikawa, « Evidence for the possible function of the fluorescent granular perithelial cells in brain as scavengers of high-molecular-weight waste products. », Experientia, vol. 40, , p. 399–402 (PMID 6325229).
- (en) Roumen Balabanov, Ruth Washington, Jarmila Wagnerova et Paula Dore-Duffy, « CNS microvascular pericytes express macrophage-like function, cell surface integrin alpha M, and macrophage marker ED-2. », Microvasc. Res., vol. 52, , p. 127–142 (PMID 8901442).
- (en) William F. Hickey et H. Kimura, « Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo. », Science, American Association for the Advancement of Science (États-Unis), vol. 239, , p. 290–292 (PMID 3276004).
- (en) Z. Fabry, M. Sandor, TF Gajewski, J. A. Herlein, M. M. Waldschmidt, R. G. Lynch et M. N. Hart, « Differential activation of Th1 and Th2 CD4+ cells by murine brain microvessel endothelial cells and smooth muscle/pericytes. », J. Immunol., vol. 151, , p. 38–47. (PMID 8100844).
- (en) D. Krause, J. Kunz et R. Dermietzel, « Cerebral pericytes - a second line of defense in controlling blood-brain barrier peptide metabolism. », Adv. Exp. Med. Biol., vol. 331, , p. 149–152 (PMID 8101424).
- (en) W. Eric Thomas, « Brain macrophages: on the role of pericytes and perivascular cells. », Brain Res. Brain Res. Rev., Elsevier, vol. 31, , p. 42–57 (PMID 10611494) (article de revue).
- (en) Costantino Iadecola, « Neurovascular regulation in the normal brain and in Alzheimer’s disease. », Nat. Rev. Neurosci., Nature Publishing Group, vol. 5, , p. 347–360 (PMID 15100718)(article de revue).
- (en) Britta Engelhardt, « Development of the blood-brain barrier. », Cell Tissue Res., Springer Verlag, vol. 314, , p. 119–129 (PMID 12955493) (article de revue).
- (en) Conrad E. Johanson, « Permeability and vascularity of the developing brain: cerebellum vs. cerebral cortex. », Brain Res., Elsevier, vol. 190, , p. 3–16 (PMID 6769537).
- (en) Jochen Neuhaus, Werner Risau et Hartwig Wolburg, « Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture. », Ann. N. Y. Acad. Sci., Wiley, vol. 633, , p. 578–580 (PMID 1789585).
- (en) P. A. Stewart et M. J. Wiley, « Developing nervous tissue induces formation of blood-brain barrier characteristics in invading endothelial cells: a study using quail–chick transplantation chimeras. », Dev. Biol., Elsevier, vol. 84, , p. 183–192 (PMID 7250491).
- (en) N. Joan Abbott, « Astrocyte-endothelial interactions and blood-brain barrier permeability. », J. Anat., Wiley, vol. 200, , p. 629–638 (PMID 12162730, lire en ligne).
- (en) Olaf B. Paulson et Eric A. Newman, « Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? », Science, American Association for the Advancement of Science (États-Unis), vol. 237, , p. 896–898 (PMID 3616619, lire en ligne).
- (en) N. Joan Abbott, Lars Rönnbäck et Elisabeth Hansson, « Astrocyte-endothelial interactions at the blood-brain barrier. », Nat. Rev. Neurosci., vol. 7, , p. 41–53 (PMID 16371949) (article de revue).
- (en) Ingemar Bjorkhem et Steve Meaney, « Brain Cholesterol: Long Secret Life Behind a Barrier. », Arterioscler. Thromb. Vasc. Biol., vol. 24, , p. 806–815 (PMID 14764421) (article de revue).
- (en) Henri M. Duvernoy et Pierre-Yves Risold, « The circumventricular organs: an atlas of comparative anatomy and vascularization. », Brain Res. Rev., Elsevier, vol. 56, , p. 119–147 (PMID 17659349) (article de revue).
- (en) C. Lohmann, « Die Blut-Hirn-Schranke in vitro: Regulation der Permeabilität durch Matrixmetalloproteasen. », Dissertation, Westfälische Wilhelms-Universität Münster, (lire en ligne).
- (en) W. M. Pardridge, Peptide Drug Delivery to the Brain., New York, Raven Press, , 357 p. (ISBN 0-88167-793-0), p. 123.
- (en) Win L. Chiou et Abhijit Barve, « Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats. », Pharm. Res., Elsevier, vol. 15, , p. 1792–1795 (PMID 9834005).
- (en) Jay T. Goodwin et David E. Clark, « In silico predictions of blood-brain barrier penetration: considerations to "keep in mind". », J. Pharmacol. Exp. Ther., American Society for Pharmacology and Experimental Therapeutics, vol. 315, , p. 477–483 (PMID 15919767, lire en ligne) (article de revue).
- (en) S. L. Lindstedt et P. J. Schaeffer, « Use of allometry in predicting anatomical and physiological parameters of mammals. », Lab. Anim., vol. 36, , p. 1–19 (PMID 11833526).
- (en) R. W. Leggett et L. R. Williams, « A proposed blood circulation model for reference man. », Health Phys., vol. 69, , p. 187–201 (PMID 7622365).
- (en) Stefan Willmann, Walter Schmitt, Jörg Keldenich, Jörg Lippert et Jennifer B. Dressman, « A physiological model for the estimation of the fraction dose absorbed in humans. », J. Med. Chem., ACS Publications, vol. 47, , p. 4022–4031 (PMID 15267240).
- (en) Urban Fagerholm, Monica Johansson et Hans Lennernäs, « Comparison between permeability coefficients in rat and human jejunum. », Pharm. Res., vol. 13, , p. 1336–1342 (PMID 8893271).
- (en) R. W. Leggett, « Suggested reference values for regional blood volumes in humans. », Health Phys., vol. 60, , p. 139–154 (PMID 1989937).
- (en) G. B. Wislocki, « Experimental studies on fetal absorption. I. The vitally stained fetus. », Contrib. Embryol. Carnegie Inst., vol. 5, , p. 45–52.
- (en) S. Wakai et N. Hirokawa, « Development of the blood–brain barrier to horseradish peroxidase in the chick embryo. », Cell Tissue Res., vol. 195, , p. 195–203 (PMID 737715).
- (en) Werner Risau, Rupert Hallmann et Ursula Albrecht, « Differentiation-dependent expression of proteins in brain endothelium during development of the blood–brain barrier. », Dev. Biol., Elsevier, vol. 117, , p. 537–545 (PMID 2875908).
- (en) M. L. Reynolds, C. A. Evans, E. O. Reynolds, N. R. Saunders, G. M. Durbin et J. S. Wigglesworth, « Intracranial haemorrhage in the preterm sheep fetus. », Early Hum. Dev., vol. 3, , p. 163–186 (PMID 575326).
- L. Stern et R. Peyrot, « Le fonctionnement de la barrière hémato-encéphalique aux divers stades de développement chez les diverses espèces animales. », Comptes Rendus des Sociétés de Biologie (Paris), vol. 96, , p. 1124–1126.
- L. Stern, « Le fonctionnement de la barrière hémato-encéphalique chez les nouveau-nés. », Comptes Rendus Soc. Biol. (Paris), vol. 100, , p. 231–233.
- (en) N. R. Saunders, M. D. Habgood et K. M. Dziegielewska, « Barrier mechanisms in the brain, II. Immature brain. », Clin. Exp. Pharmacol. Physiol, Wiley, vol. 26, , p. 85–91 (PMID 10065326).
- (en) N. R. Saunders, « Development of the blood–brain barrier to macromolecules », dans M. B. Segal, The Fluids and Barriers of the Eye and Brain, MacMillan, (ISBN 0-8493-7707-2), p. 128–155.
- (en) U. Schumacher et Kjeld Mollgård, « The multidrug resistance P-glycoprotein (Pgp, MDR1) is an early marker of blood–brain barrier development in the microvessels of the developing human brain. », Histochem. Cell Biol., Springer Verlag, vol. 108, , p. 179–182 (PMID 9272437).
- (en) K. M. Dziegielewska, C. A. Evans, D. H. Malinowska, K. Møllgård, J. M. Reynolds, M. L. Reynolds et N. R. Saunders, « Studies of the development of brain barrier systems to lipid insoluble molecules in fetal sheep. », J. Physiol., vol. 292, , p. 207–231 (PMID 490348).
- (en) R. K. Ferguson et D. M. Woodbury, « Penetration of 14C-inulin and 14C-sucrose into brain, cerebrospinal fluid and skeletal muscle of developing rats. », Exp. Brain Res., vol. 7, , p. 181–194 (PMID 5795246).
- (en) M. D. Habgood, G. WA. Knott et K. M. Dziegielewska, « The nature of the decrease in blood–cerebrospinal fluid barrier exchange during postnatal brain development in the rat. », J. Physiol., vol. 468, , p. 73–83 (PMID 8254533, lire en ligne).
- (en) C. E. Johanson, « Ontogeny of the blood–brain barrier », dans E. A. Neuwelt, Implications of the Blood–Brain Barrier and Its Manipulation, Plenum Press, , p. 157–198.
- (en) L. D. Braun, E. M. Cornford et W. H. Oldendorf, « Newborn rabbit blood–brain barrier is selectively permeable and differs substantially from the adult. », J. Neurochem., vol. 34, , p. 147–152147–152 (PMID 7452231).
- (en) E. M. Cornford, L. D. Braun et W. H. Oldendorf, « Developmental modulations of blood–brain barrier permeability as an indicator of changing nutritional requirements in the brain. », Pediatr. Res., vol. 16, , p. 324–328 (PMID 7079003)
- (en) D. P. Brenton et R. M. Gardiner, « Transport of L-phenylalanine and related amino acids at the ovine blood–brain barrier. », J. Physiol., vol. 402, , p. 497–514 (PMID 3236248, lire en ligne).
- (en) H. J. Frank, T. Jankovic-Vokes, W. M. Pardridge et W. L. Morris, « Enhanced insulin binding to blood–brain barrier in vivo and to brain microvessels in vitro in newborn rabbits. », Diabetes, vol. 34, , p. 728–733 (PMID 3894116).
- (en) N. R. Saunders, G. W. Knott et K. M. Dziegielewska, « Barriers in the immature brain. », Cell Mol. Neurobiol., vol. 20, , p. 29–40 (PMID 10690500) (article de revue).
- (en) N. Joan Abbott et M. Bundgaard, « Electron-dense tracer evidence for a blood-brain barrier in the cuttlefish, Sepia officinalis. », J. Neurocytol., vol. 21, , p. 276–294 (PMID 1588347).
- (en) N. Joan Abbott et Y. Pichon, « The glial blood-brain barrier of crustacea and cephalopods: a review. », J. Physiol. (Paris), vol. 82, , p. 304–313 (PMID 3332691).
- (en) N. Joan Abbott, « Dynamics of CNS barriers: evolution, differentiation, and modulation. », Cell Mol. Neurobiol., vol. 25, , p. 5–23 (PMID 15962506).
- (en) N. Joan Abbott, « Comparative physiology of the blood-brain barrier », dans M. W. B. Bradbury, Physiology and pharmacology of the bloodbrain barrier, Springer Verlag, (ISBN 0-387-54492-5), p. 371–396.
- (en) Tobias Stork, Daniel Engelen, Alice Krudewig, Marion Silies, Roland J. Bainton et Christian Klämbt1, « Organization and function of the blood-brain barrier in Drosophila. », J. Neurosci., vol. 28, , p. 587–597 (PMID 18199760, lire en ligne).
- (en) J. Fraher et E. Cheong, « Glial-Schwann cell specialisations at the central-peripheral nervous system transition of a cyclostome: An ultrastructural study. », Acta Anat., vol. 154, , p. 300–314 (PMID 8773716).
- (en) N. Joan Abbott et al., « Comparative physiology of the blood-brain barrier », dans A. J. Suckling u. a., The blood-brain barrier in health and disease, Ellis Horwood, , p. 52–72.
- (en) F. Miragall, D. Krause, U. de Vries et R. Dermietzel, « Expression of the tight junction protein ZO-1 in the olfactory system: Presence of ZO-1 on olfactory sensory neurons and glial cells. », J. Comp. Neurol., vol. 341, , p. 433–448 (PMID 8201022).
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Blut-Hirn-Schranke » (voir la liste des auteurs).
- Extraits du cours de PCEM1 du Pr Bertrand Bloch (PU-PH) sur le tissu nerveux, Université Victor Segalen, Bordeaux 2.
- (en) D. Kobiler, Blood-brain Barrier., Springer Verlag, (ISBN 0-306-46708-9).
- (en) W. M. Pardridge, Introduction to the Blood-brain Barrier., Cambridge University Press, (ISBN 0-521-58124-9).
- (en) M. Bradbury, The Concept of a Blood-Brain Barrier., Wiley-Interscience, (ISBN 0-471-99688-2).
- (de) Peter Uwe Brenner, « Die Struktur der Blut-Hirn- und der Blut-Liquor-Schranke. – Eine Literaturstudie – », Thèse de doctorat, Ludwig Maximilans Universität München, (lire en ligne).
