Nylon 6
| Nylon 6 | |

| |
| Monomère de Nylon 6 | |
| Identification | |
|---|---|
| Nom UICPA | poly(azépan-2-one), poly(hexano-6-lactame) |
| Nom systématique | poly[azanediyl(1-oxohexane-1,6-diyle)] |
| Synonymes |
polyamide 6, polycaprolactame, PA6, poly-ε-caproamide, Perlon, etc. |
| No CAS | |
| No ECHA | 100.124.824 |
| No CE | 607-506-6 |
| Propriétés chimiques | |
| Formule | –[NHCH2CH2CH2CH2CH2CO]n– |
| Masse molaire | 113,16 g/mol par monomère |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le Nylon 6, polyamide 6 ou polycaprolactame, est un polymère de la classe des polyamides. Il a été développé en 1938 chez IG Farben pour reproduire les propriétés du Nylon — c'est-à-dire du Nylon 66 — sans enfreindre son brevet de production. Contrairement à la plupart des autres Nylons, il ne s'agit pas d'un polymère de condensation car on le produit au moyen d'une polymérisation par ouverture de cycle d'ε-caprolactame. Son développement a été structurant pour les textiles en fibre synthétique et il est distribué sous de nombreuses dénominations, comme Perlon en Allemagne, Nylatron, Capron, Duréthane, etc.
Synthèse[modifier | modifier le code]
Polymérisation en chaîne hydrolytique[modifier | modifier le code]
La réaction commence avec l'acide ε-aminocaproïque. On l'obtient à partir d'ε-caprolactame par ouverture de cycle amorcée par hydrolyse initiale en ajoutant de petites quantités d'eau :
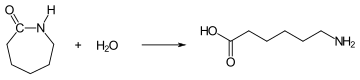
L'acide ε-aminocaproïque réagit avec l'ε-caprolactame pour former des liaisons amide pour former du polycaprolactame :

La polymérisation en chaîne se produit avec l'ouverture du cycle au niveau du groupe amino terminal de la chaîne en croissance[1]. Dans les procédés continus ou discontinus, la réaction a lieu dans la plage de 260 à 280 °C. Le temps de réaction est de 8 à 10 heures. Les monomères restants sont dégazés du produit fondu sous vide ou éliminés des granulés par lavage à l'eau[2].
Polymérisation en chaîne anionique[modifier | modifier le code]
Cette polymérisation est relativement compliquée[3]. Pour l'amorçage, l'ε-caprolactame est converti en anion avec des alcoolates, des amines primaires ou secondaires ; l'ajout de caprolactame conduit à la formation d'un caprolactame N-acylé qui constitue l'extrémité active de la chaîne polymérique en croissance :
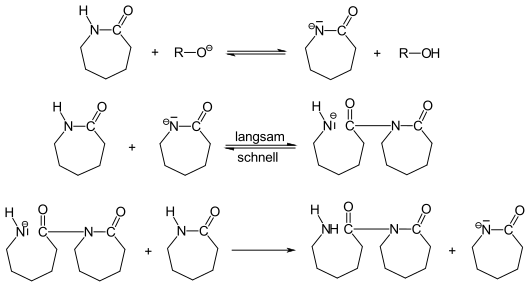

La formation des extrémités actives des chaînes de polymère en croissance est assez lente et peut être accélérée à l'aide d'anhydrides d'acides, de chlorures d'acyle ou d'isocyanates, comme illustré ci-dessous pour ces deux derniers cas :

La polymérisation en chaîne, exothermique, a lieu en quelques minutes de 120 à 150 °C sous atmosphère d'azote[2].
Polycondensation[modifier | modifier le code]
Le polyamide 6 peut également être produit par polycondensation de l'acide ε-aminocaproïque :

Propriétés et utilisations[modifier | modifier le code]
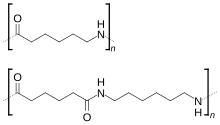
Les liaisons amide –CO–NH– du Nylon 6 sont toutes orientées dans le même sens C→N, contrairement à celles du Nylon 66, qui sont alternées. Les fibres de Nylon 6 ont une ténacité (6 à 8,5 gf/D), une résistance et une élasticité élevées. Leur masse volumique est de 1,14 g/cm3. Elles ont un point de fusion de 215 °C et peuvent résister à la chaleur généralement jusqu'à 150 °C[4]. Elles ne peuvent être froissées et sont très résistantes à l'abrasion et aux agressions chimiques telles qu'aux acides et aux bases. Les fibres peuvent absorber jusqu'à 2,4 % d'eau, bien que cela diminue leur résistance à la traction. La température de transition vitreuse du Nylon 6 est de 47 °C.
Les bactéries des genres Flavobacterium et Pseudomonas peuvent dégrader les oligomères de Nylon 6, mais pas les longues chaînes de polymère. Certains champignons de la pourriture fibreuse peuvent également dégrader le Nylon 6 par oxydation. Cependant, le Nylon 6 est sensiblement moins biodégradable que les polyesters aliphatiques. Certaines sources attribuent cette difficulté aux nombreuses interactions interchaînes par liaisons hydrogène qui bloqueraient l'action des microorganismes[5].
Le polyamide 6 est généralement blanc mais peut être teint dans un bain de solution pour obtenir des produits de couleurs différentes. Il est employé comme fibre synthétique sous diverses dénominations telles que Nylon 6 ou Perlon[6]. De nombreux composants coulés et extrudés sont fabriqués à partir de polycaprolactame. Sa ténacité et sa résistance à l'usure font qu'il est utilisé en génie mécanique pour réaliser des engrenages et des vis à faible charge ; ses bonnes propriétés de glissement le font également utiliser pour réaliser des paliers lisses et les plaques à charge élevée.
Le polyamide 6 est employé comme matériau de support en chromatographie, sur couche mince et sur colonne[7].
Notes et références[modifier | modifier le code]
- (de) Bernd Tieke, Makromolekulare Chemie: Eine Einführung, 3e éd., Wiley, 2014, p. 117. (ISBN 978-3-527-33216-8)
- (de) Wolfgang Kaiser, Kunststoffchemie für Ingenieure, 3e éd., Carl Hanser, Munich, 2011, p. 363. (ISBN 978-3-446-43047-1)
- (de) Bernd Tieke, Makromolekulare Chemie: Eine Einfhrung, 3e éd., Wiley, 2014, p. 112f. (ISBN 978-3527332168)
- (en) Mohammed Zillane Patwary, « Polyamid Fiber », sur textilefashionstudy.com, (consulté le ).
- (de) Karl-Heinz Lautenschläger et Werner Schröter, Taschenbuch der Chemie, Harri Deutsch, 2007. (ISBN 978-3-817-11761-1)
- (de) Reinhard Mattisek, Gabriele Steiner et Markus Fischer, Lebensmittelanalytik, 4e éd., Springer, 2010. (ISBN 978-3-540-92205-6)
