Répétition ankyrine
| Pfam | PF00023 |
|---|---|
| InterPro | IPR002110 |
| SMART | SM00248 |
| PROSITE | PDOC50088 |
| SCOP | 1awc |
| SUPERFAMILY | 1awc |
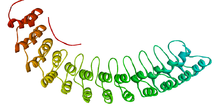
Une répétition ankyrine est une configuration particulière des protéines consistant en 33 résidus d'acides aminés formant deux hélices α séparées par des boucles. Ces domaines sont très répandus, un peu chez les bactéries et les archées, mais surtout chez les eucaryotes. Ils sont absents de la plupart des virus, à l'exception des Poxviridae. Ils sont définis par leur structure et non par leur séquence dans la mesure où aucune séquence particulière n'a été associée aux répétitions ankyrine. La plupart des protéines qui contiennent ce type de structures possèdent de quatre à six répétitions ankyrine, l'ankyrine elle-même en ayant 24, le record étant probablement les 34 répétitions d'une protéine exprimée par Giardia lamblia[2].
Les répétitions ankyrine se replient généralement ensemble pour former une structure unique en forme de solénoïde linéaire appelée domaine de répétitions ankyrine. Ces domaines constituent l'une des plateformes les plus courantes assurant les interactions protéine-protéine. Elles interviennent dans un grand nombre de protéines aux fonctions diverses, principalement chez les eucaryotes. Les exemples provenant de procaryotes et de virus résultent peut-être de transferts horizontaux de gènes[3].
Cette structure a été observée dans des protéines assurant des fonctions très diverses, comme l'initiation de la transcription, la régulation du cycle cellulaire, le transport d'ions, la transduction de signal et les protéines du cytosquelette.
Notes et références
[modifier | modifier le code]- (en) Peter Michaely, Diana R. Tomchick, Mischa Machius et Richard G. W. Anderson, « Crystal structure of a 12 ANK repeat stack from human ankyrinR », The EMBO Journal, vol. 21, no 23, , p. 6387-6396 (PMID 12456646, PMCID 136955, DOI 10.1093/emboj/cdf651, lire en ligne)
- (en) Leila K. Mosavi, Tobin J. Cammett, Daniel C. Desrosiers et Zheng‐yu Peng, « The ankyrin repeat as molecular architecture for protein recognition », Protein Science, vol. 13, no 6, , p. 1435-1448 (PMID 15152081, PMCID 2279977, DOI 10.1110/ps.03554604, lire en ligne)
- (en) Peer Bork, « Hundreds of ankyrin-like repeats in functionally diverse proteins: Mobile modules that cross phyla horizontally? », Proteins, vol. 17, no 4, , p. 363-374 (PMID 8108379, DOI 10.1002/prot.340170405, lire en ligne)