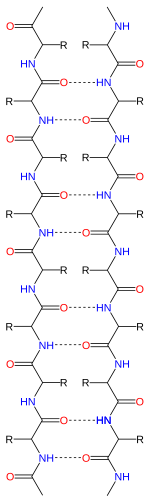
Feuillet bêta
Les feuillets β ou feuillets β plissés est la deuxième forme de structure secondaire régulière observée dans les protéines, avec une fréquence de présence plus faible que les hélices α. Les feuillets β sont constitués de brins bêta (brins β) reliés latéralement par au moins deux ou trois liaisons hydrogène entre des atomes du squelette carboné de la chaine polypeptidique pour former un plan plissé (comme un accordéon), généralement tordu. Un brin β est une partie de la chaine polypeptidique formé en moyenne de trois à dix acides aminés dont la chaine carbonée principale est étendue. L'association de nombreux feuillets β est observée dans l'agrégation de protéines, dans de nombreuses maladies humaines, notamment les amyloses telles que la maladie d'Alzheimer.

Découverte[modifier | modifier le code]
La première structure des feuillets β est proposée par William Astbury dans les années 1930, après des observations indiquant des changements très importants des clichés diffraction de rayon X de fibres de laine ou de cheveux humides lors de leur étirement. Il propose l'existence de liaisons hydrogène entre des brins β parallèles ou anti-parallèles. Son modèle est cependant limité par l'absence de contraintes géométriques des acides aminés par le fait qu'il ne connaissait pas le caractère plan de la liaison peptidique. En 1951, Linus Pauling et Robert Corey présentent un modèle plus élaboré basé sur des considérations théoriques[1].
Structure et organisation[modifier | modifier le code]

Géométrie[modifier | modifier le code]

La majorité des brins β sont placés côte à côte et forme de nombreuses liaisons hydrogène entre les brins voisins. Les groupes NH du squelette polypeptidique d'un brin s'associent aux groupes C=O du squelette polypeptidique du brin adjacent, les chaines latérales d'acides aminés successifs dans un brin β sont orientées alternativement d'un côté puis de l'autre du feuillet β. Les différents brins β associés pour former un feuillet β sont organisés de telle sorte que les atomes Cα des acides aminés soient adjacents et leurs chaines latérales pointent dans la même direction. Les plis observés dans les brins β ont pour origine la nature tétraédrique du carbone Cα ; la distance entre un Cαi d'un acide aminé et un Cαi+2 d'un acide aminé situé à deux positions est de 6 Å alors que la distance entre deux acides aminés en position trans complète est normalement de 7,6 Å (2 × 3,8 Å). La distance moyenne entre les atomes Cα de deux acides aminés liés par une liaison hydrogène de brins adjacents est de 5 Å.
Les brins β sont rarement parfaitement parallèles, ils présentent une torsion en raison de la chiralité des chaines latérales. Les angles dièdres préférentiels sont (φ, ψ) = (-135 °, 135 °) et correspondent à la région supérieure gauche du diagramme de Ramachandran, ces angles sont cependant assez différents de la conformation la plus étendue possible (φ, ψ) = (-180 °, 180 °). La torsion est associée aux fluctuations alternatives des angles dièdres pour éviter que les brins β au sein de feuillet de grande taille ne s'évasent vers l'extérieur et fragilisent la structure secondaire. Un exemple de la présence d'une forte torsion entre deux brins β peut être observée dans la BPTI (en).
Liaisons hydrogène[modifier | modifier le code]
La chaine polypeptidique est orientée par la présence aux extrémités du N-terminale et du C-terminale, les brins β sont donc également orientés. Dans les représentations topologiques l'orientation des brins est modélisée par une flèche pointant vers l'extrémité C-terminale. Les brins β adjacents peuvent s'organiser de façon parallèle, antiparallèle ou mixte.
Un feuillet β antiparallèle dispose de brins β orientés en sens inverse, l'extrémité N-terminale de l'un est adjacent à l'extrémité C-terminale de son voisin. Cette organisation permet d'obtenir une stabilité inter-brin renforcée, les liaisons hydrogène sont alignées avec les axes des liaisons des groupes C=O et NH ce qui correspond à leur orientation préférentielle. Les angles dièdres des carbones du squelette polypeptidique des brins β organisés en feuillet antiparallèle sont en moyenne de (φ, ψ) = (-140°, 135°). Dans cette configuration, les deux acides aminés opposés, portant le Cαi et le Cαj, situés sur des brins β liés par des liaisons hydrogène forment une paire de liaisons hydrogène de part et d'autre des carbones Cα.
Un feuillet β parallèle est formé de brins β dont l'extrémité N-terminale est orientée dans le même sens. Cette configuration est moins stable que la configuration antiparallèle car les liaisons hydrogène inter-brins ne sont pas alignés avec le C=O et le NH. Les angles dièdres des acides aminés impliqués dans un feuillet β parallèle sont en moyenne de (φ, ψ) = (-120°, 115°). Les feuillets β parallèles sont en général formés de plus de cinq brins β, suggérant qu'un plus petit nombre de brins β rend les feuillets β parallèles instables. La formation des feuillets β parallèles est rendue plus complexe par la nécessité pour le N-terminale et le C-terminale de la séquence peptidique d'être alignés. Des études récentes indiquent que les feuillets β parallèles peuvent s'associer pour former des séquences amyloïdiques.
Dans les structures en feuillet β, les deux acides aminés portant le Cαi et le Cαj, en face à face situés sur des brins β adjacents ne sont pas liés par des liaisons hydrogène. En revanche, il existe des liaisons hydrogène entre l'acide aminé portant le Cαi et les acides aminés portant les Cαj-1 et Cαj+1, par contre l'acide aminé portant le Cαj est libre de réaliser ou non des liaisons hydrogène avec d'autres résidus.
Acides aminés impliqués dans les feuillets β[modifier | modifier le code]
Les acides aminés aromatiques (tyrosine, tryptophane et phénylalanine) et les acides aminés dotés de chaines latérales ramifiées (thréonine, valine et isoleucine) sont principalement trouvés au cœur des feuillets β. La proline est trouvée aux extrémités des brins vraisemblablement pour éviter l'agrégation entre protéines et la formation d'amyloïde[2].
Motifs structurels classiques[modifier | modifier le code]

Le motif structurel le plus simple impliquant des brins β est le motif en épingle à cheveux, dans lequel deux brins β antiparallèles sont reliés par une courte boucle de deux à cinq acides aminés. L'un de ces acides aminés est souvent une glycine ou une proline qui, par leur structure, peuvent disposer de valeurs d'angles dièdres compatibles avec une boucle courte. Les brins β peuvent également être liés par des boucles plus longues pouvant dans certains cas contenir des hélices α.
Clé grecque[modifier | modifier le code]

Le motif structurel en clé grecque est composé de quatre brins β antiparallèles adjacents et de leurs boucles de liaison. Trois des brins β antiparallèles sont reliés par des épingles à cheveux, tandis que le quatrième brin, adjacent au troisième, est relié au premier brin par une boucle plus longue. Ce type de structure se forme facilement pendant le processus de repliement des protéines[3],[4]. Le nom de ce motif fait référence à un motif décoratif grec.
Motif β-α-β[modifier | modifier le code]
Le caractère chiral des chaines latérales des acides aminés provoque une torsion droite des brins β, la boucle reliant deux brins β parallèles a tendance à s'orienter à droite, cette orientation est favorisée par la torsion naturelle des brins β formant le feuillet β (voir les parties II B et III C,D[5]). Cette boucle peut être assimilée parfois à une hélice α, dans ce cas le motif prend le nom de β-α-β. Ce motif peut se répéter dans une protéine pour former une structure tertiaire, fréquemment observée, appelée tonneau TIM.

Zoom de la protéine de surface A de Borrelia burgdorferi complexée avec un anticorps monoclonal murin.
Plan β (β-meander)[modifier | modifier le code]
L'association de deux ou plusieurs brins β antiparallèles consécutifs reliés entre eux par des boucles en épingle à cheveux est appelée plan β ou β-meander. Ce motif est commun et peut être trouvé dans plusieurs architectures structurelles comme les tonneaux β et les hélices β.

Boucle Psi[modifier | modifier le code]
La boucle Ψ est un motif structural composé de deux brins antiparallèles, un troisième brin s'insérant entre les deux premiers se liant à eux par des liaisons hydrogène[6]. Quatre topologies de brins ont été identifiées pour des boucles Ψ par Hutchinson. Ce motif est rarement observé, son arrangement particulier limite sa formation lors du repliement des protéines. La première boucle Ψ a été identifiée dans la famille de la protéase aspartique[7].
Topologie structurale[modifier | modifier le code]
La topologie structurale des feuillets β indique l'ordre des brins β de la chaine polypeptidique liés par des liaisons hydrogène. Par exemple la flavodoxine est une protéine est composée d'un feuillet β formé de 5 brins β parallèles avec une topologie 21345, les brins 2 et 5 sont les brins β extérieurs au feuillet β. Le brin 2 est lié par liaisons hydrogène au brin 1, lui-même lié au brin 3 qui est lié par liaisons hydrogène au brin 4 en interaction par liaison hydrogène au brin 5. En utilisant un système similaire, le motif structurel en clé grecque a une topologie 4123. Un feuillet β peut ainsi être décrit par le nombre de brins le composant, sa topologie et l'orientation parallèle ou antiparallèle des brins.
Les feuillets β peuvent être ouverts, ils possèdent alors deux brins β de bord (comme dans le cas de la flavodoxine ou dans les immunoglobulines) ou être fermés et appelés tonneau β (comme les tonneaux TIM). Dans la forme tonneau β, les brins le composant sont très souvent soumis à une forte torsion. Les feuillets β ouverts sont souvent très incurvés et se replient sur eux-mêmes (comme dans le cas du domaine SH3 (en)) ou ont des formes de fer-à-cheval (comme dans le cas de l'inhibiteur de ribonucléase). Les feuillets β ouverts peuvent s'associer face-à-face (cas du domaine d'immunoglobuline (en)) ou côte à côte formant un feuillet β plus grand.
Caractéristiques dynamiques[modifier | modifier le code]
Les feuillets β au sein des protéines peuvent générer un mouvement à basse fréquence semblable au mouvement d'un accordéon, cette variation structurale peut être observée par spectroscopie Raman[8].
Hélices parallèles β[modifier | modifier le code]


Une hélice parallèle β est formée de la répétition de deux ou trois brins β reliés par de courtes boucles, ces unités de répétition se superposent l'une au-dessus de l'autre et les feuillets β superposés sont organisés de façon parallèle. Dans les hélices β gauche, les brins sont simples et sans torsion, les surfaces formées sont pratiquement plates et forment un prisme régulier (voir schéma de l'anhydrase carbonique). L'enzyme synthétisant le lipide A (lpxA) ou les protéines d'insectes antigel sont d'autres exemples de cette structure[9]. Les hélices β droites comme la pectate lyase présentent des sections transversales moins régulières, la partie moins régulière est souvent impliquée dans un site actif ou un site de liaison[10].
Feuillets β et pathologies[modifier | modifier le code]
Certaines protéines, sous forme monomérique, possédant des structures désordonnées ou formées majoritairement d'hélices peuvent s'associer, voir leur structure se modifier, comme les β amyloïdes (voir plaque amyloïde) et former des structures oligomériques riches en feuillets β associées à des états pathologiques. L'amyloïde β sous forme oligomérique est considérée comme cause de la maladie d'Alzheimer. Sa structure n'a pas encore été déterminée dans son intégralité, mais les données récentes suggèrent qu'il peut posséder une structure inhabituelle en hélice β à deux brins[11].
Les chaînes latérales hydrophobes des acides aminés trouvés dans une structure en feuillet β peuvent sur une face du feuillet et les chaines latérales d'acides aminés hydrophiles sur l'autre face et forment ainsi une interface entre un environnement polaire et un environnement apolaire[12].
La pathogénicité du prion (protéine responsable de la maladie de Creutzfeldt-Jakob) est due à la transformation d'une hélice alpha en feuillet bêta.[référence nécessaire]
Notes et références[modifier | modifier le code]
- (en) Pauling et RB Corey, « Configurations of Polypeptide Chains With Favored Orientations Around Single Bonds : Two New Pleated Sheets. », Proceedings of the National Academy of Sciences of the United States of America, vol. 37, no 11, , p. 729-740 (PMID 16578412, PMCID 1063460)
- (en) JS Richardson et DC Richardson, « Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation », Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no 5, , p. 2754–2759 (PMID 11880627, PMCID 122420, DOI 10.1073/pnas.052706099)
- Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- EG Hutchinson et JM Thornton, « The Greek key motif : extraction, classification and analysis », Protein Engineering, vol. 6, no 3, , p. 233–245 (PMID 8506258, DOI 10.1093/protein/6.3.233)
- (en) JS Richardson, « Anatomy and Taxonomy of Protein Structures », Advances in Protein Chemistry, vol. 34, , p. 167–339 (ISBN 0-12-034234-0, DOI 10.1016/s0065-3233(08)60520-3)
- (en) EG Hutchinson et JM Thornton, « PROMOTIF--a program to identify and analyze structural motifs in proteins », Protein Science : A Publication of the Protein Society, vol. 5, no 2, , p. 212–220 (PMID 8745398, PMCID 2143354, DOI 10.1002/pro.5560050204)
- EG Hutchinson et JM Thornton, « HERA--a program to draw schematic diagrams of protein secondary structures », Proteins, vol. 8, no 3, , p. 203–212 (PMID 2281084, DOI 10.1002/prot.340080303)
- (en) PC Painter, LE Mosher et C Rhoads, « Low-frequency modes in the Raman spectra of proteins », Biopolymers, vol. 21, no 7, , p. 1469–1472 (PMID 7115900, DOI 10.1002/bip.360210715)
- YC Liou, A Tocilj, PL Davies et Z Jia, « Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein », Nature, vol. 406, no 6793, , p. 322–324 (PMID 10917536, DOI 10.1038/35018604)
- (en) Carl Branden et John Tooze, Introduction to Protein Structure, New York, Garland, , 20–32 p. (ISBN 0-8153-2305-0)
- (en) R Nelson, MR Sawaya, M Balbirnie, AØ Madsen, C Riekel, R Grothe et D Eisenberg, « Structure of the cross-beta spine of amyloid-like fibrils », Nature, vol. 435, no 7043, , p. 773–778 (PMID 15944695, PMCID 1479801, DOI 10.1038/nature03680)
- (en) S Zhang, T Holmes, C Lockshin et A Rich, « Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane », Proceedings of the National Academy of Sciences of the United States of America, vol. 90, no 8, , p. 3334–3338 (PMID 7682699, PMCID 46294, DOI 10.1073/pnas.90.8.3334)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Beta sheet » (voir la liste des auteurs).