Plomb tétraéthyle
| Tétraéthylplomb | |
| |
| Identification | |
|---|---|
| Synonymes |
Plomb tétraéthyle |
| No CAS | |
| No ECHA | 100.000.979 |
| No CE | 201-075-4 |
| Apparence | liquide visqueux, incolore, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
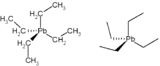
| Formule | C8H20Pb [Isomères] |
| Masse molaire[2] | 323,4 ± 0,1 g/mol C 29,71 %, H 6,23 %, Pb 64,07 %, |
| Propriétés physiques | |
| T° fusion | −136,8 °C[1] |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 200 °C[1] |
| Solubilité | dans l'eau : très faible[1] |
| Masse volumique | 1,7 g·cm-3[1] |
| T° d'auto-inflammation | supérieure à 110 °C[1] |
| Point d’éclair | 93 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | en volume % dans l'air : 1.8-[1]? |
| Pression de vapeur saturante | à 20 °C : 0,027 kPa[1] |
| Précautions | |
| SIMDUT[4] | |
 D1A, |
|
| NFPA 704 | |
| Directive 67/548/EEC | |
| Transport | |
| Écotoxicologie | |
| LogP | 4,15[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le tétraéthylplomb, ou plomb tétraéthyle, est un liquide incolore, huileux, d'odeur caractéristique de formule brute Pb(C2H5)4 et très toxique.

Avec le tétraméthylplomb (également très toxique), il constituait l'un des principaux composants des produits antidétonants pour carburants, l'autre produit très utilisé en complément étant aussi un organométallique : le méthylcyclopentadiényle tricarbonyle de manganèse, également très toxique, mais a priori beaucoup moins problématique pour l'environnement que le plomb tétraéthyle une fois qu'il s'est dégradé).
Ces dérivés du plomb avaient une fonction secondaire qui était de protéger les soupapes en évitant la récession de leurs sièges (on avait constaté durant la Première Guerre mondiale qu'une fine couche de plomb déposée dans le fut des canons avait un effet lubrifiant protecteur) mais leur première fonction était d’augmenter l’indice d'octane du carburant (anti-détonant).
Synthèse
Le plomb tétraéthyle est obtenu par la réaction du chlorure d'éthyle et du plomb (sous forme d'un alliage de sodium et de plomb)[5].
- 4 NaPb + 4 C2H5Cl → Pb(C2H5)4 + 3 Pb + 4 NaCl
Propriétés physicochimiques et biologiques
- A température élevée, il se décompose en formant du (CH3CH2)3Pb et des radicaux éthyle. Cette propriété a été mise à profit pour accroître l'indice d'octane des carburants utilisés dans les moteurs à explosion, entre les 2 guerres, dans un premier temps, pour améliorer les performances des moteurs d'avions. Ces radicaux éthyle réagissent avec les autres radicaux qui se forment spontanément pendant la phase de compression du mélange air-carburant et qui par réaction en chaîne initieraient la combustion avant qu'elle ne soit déclenchée par l'étincelle de la bougie. On évite ainsi les cliquetis du moteur, dysfonctionnements liés à un auto-allumage prématuré dans la chambre de combustion.
- En raison de sa structure non-ionique et de la présence des quatre groupes éthyles il est très lipophile. Le fait que la plomb tétraéthyle se solubilise spontanément et très bien dans les hydrocarbures vient de la faible polarité des liaisons carbone-plomb.
- Son caractère lipophile le rend très bioassimilable, via la chaine alimentaire, ou via la peau (passage transcutané). C'est pourquoi les carburants contenant du tétraéthylplomb (0,1 à 0,4 g·l-1 d'essence) tendent à disparaître depuis les années 1980 et sont interdits à la vente dans toute l’Union européenne depuis l'an 2000, mais encore très utilisés dans les pays pauvres, et avec des taux de plomb parfois supérieurs à ceux qui étaient en vigueur aux Etats-Unis où ce produit a été le plus utilisé. C'est un produit persistant (sa dégradation est très lente dans l'environnement, et en se dégradant il libère du plomb très toxique pour l'Homme, les animaux (saturnisme animal) et la plupart des plantes, et le plomb n'est ni biodégradable, ni dégradable. C'est une des sources de saturnisme pour l'Homme. Il fait partie des polluants métallo-organiques persistants.
Histoire
C'est en 1921 que Thomas Midgley collaborateur de Charles Kittering[6] au sein des laboratoires de recherches de la General Motors (É.-U.), découvre la propriété antidétonante du plomb tétraéthyle et du plomb tétraméthyle lors de leur adjonction à l'essence.
En dépit de nombreux accidents mortels liés à des intoxications au plomb pendant la phase d'industrialisation, Standard Oil (ESSO/EXXON) et General Motors créent la société Ethyl Gasoline Corporation qui va fabriquer et commercialiser le plomb tétraéthyle avec grâce à ses brevets une situation de monopole durant plus d'une décennie. En effet, ce produit avait été doublement breveté (pour sa fabrication et pour son utilisation) et la complexité de sa fabrication lui donnait une protection accrue contre la copie, permettant aux deux multinationales pétrolières et à General Motors de bénéficier de marges conséquentes. En pratique, il existait un produit alternatif et inoffensif, mais non brevetable et très facile à fabriquer par n'importe qui muni d'un distillateur : l'éthanol, qui aurait pu assurer le même rôle antidétonant que le plomb tétraéthyle… mais produire de l'éthanol n'aurait rapporté que des marges réduites aux sociétés concernée, sans en outre pouvoir leur assurer un monopole[7].
En raison de la toxicité et de l'impact sur l'environnement du plomb libéré par la combustion des millions de tonnes de carburant plombé, l'EPA a entrepris en 1972 une action visant à interdire l'utilisation des plombs tétraéthyle et tétraméthyle.
L'EPA, vainqueur du procès que lui a intenté l'Ethyl Gasoline Corporation, obtient l'abandon de l'essence plombée aux USA entre 1976 et 1986. La même opération d'interdiction progressive ne sera effective qu'en janvier 2001 au sein de l'Union Européenne, bien que certains états membres aient choisi de bannir plus tôt l'utilisation de l'essence plombée sur leur territoire.
En Afrique et Amérique du sud, de très nombreux pays continuent d'utiliser massivement l'essence plombée ou ne l'ont interdit (comme au Venezuela) que récemment.
Pollution atmosphérique globale
Clair Patterson qui cherchait à dater la Terre par une méthode de datation radiométrique (uranium-thorium-plomb) s'aperçut que son environnement à Caltech, non loin de Los Angeles, était fortement contaminé par le plomb. Il poursuivit ses recherches, dans un premier temps dans l'océan, puis dans les glaces polaires et jusque dans les aliments. Il put ainsi montrer que l'essentiel du plomb atmosphérique qui avait énormément augmenté depuis le début du XXe siècle était d'origine anthropogénique et pour une très grande partie issu du plomb tétraéthyle introduit dans l'essence. Le plomb étant depuis longtemps connu pour être un puissant neurotoxique, Patterson se lança dans une longue croisade pour son élimination.
Notes et références
- TETRAETHYLPLOMB, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 78-00-2 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- « Plomb tétraéthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Seyferth, D., "The Rise and Fall of Tetraethyllead. 2", Organometallics, 2003, volume 22, pages 5154-5178.
- Charles F. Kettering and the 1921 Discovery of Tetraethyl Lead In the Context of Technological Alternatives / Bill Kovarik, Ph.D.
- Kitman JL (2000). The secret history of lead. Article du journal Nation New-York, daté du 20 mars 2000, 270(11), 11-11.
Voir aussi
Articles connexes
Lien externe
Bibliographie
- Jamie Lincoln kitman, L'histoire secrète du plomb, éditions Allia, août 2005, (ISBN 2844851878)


