Iséthionate de sodium
| Iséthionate de sodium | |
| |
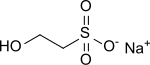
| Structure de l'iséthionate de sodium | |
| Identification | |
|---|---|
| Nom UICPA | 2-hydroxyéthanesulfonate de sodium |
| No CAS | |
| No ECHA | 100.014.858 |
| No CE | 216-343-6 |
| No RTECS | KI7700000 |
| PubChem | 517063 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche soluble dans l'eau, combustible mais peu inflammable[1] |
| Propriétés chimiques | |
| Formule | HOCH2CH2SO3Na |
| Masse molaire[2] | 148,113 ± 0,008 g/mol C 16,22 %, H 3,4 %, Na 15,52 %, O 43,21 %, S 21,65 %, |
| Propriétés physiques | |
| T° fusion | 191 à 194 °C[1] |
| T° ébullition | 230 °C[1] (décomposition) |
| Solubilité | 134 g/L[1] à 20 °C |
| Masse volumique | 1,76 g/cm3[1] à 20 °C |
| Précautions | |
| NFPA 704[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'iséthionate de sodium, ou 2-hydroxyéthylsulfonate de sodium, est un composé organosulfuré de formule chimique HOCH2CH2SO3Na. C'est le sel d'acide iséthionique HOCH2CH2SO3H et de sodium. Il se présente comme une poudre blanche sensible à l'humidité qui se dissout facilement en étant biodégradable. Il contient souvent des impuretés de sulfite de sodium Na2SO3 ou de bisulfite de sodium NaHSO3 provenant de son mode de production, de sorte que le pH de ses solutions aqueuses est faiblement basique, entre 7,0 et 11,0 pour une concentration de 20 g/L à 20 °C[1]. Il est utilisé comme tête hydrophile des tensioactifs désignés comme iséthionates en raison de sa polarité élevée et de sa bonne résistance aux ions multivalents.
L'iséthionate de sodium est produit industriellement par réaction du bisulfite de sodium avec l'oxyde d'éthylène C2H4O. Pour éviter la contamination par les réactifs et supprimer la formation de sous-produits difficiles à éliminer, la réaction doit être réalisée avec un contrôle minutieux des rapports de masse et des conditions opératoires[4]. Un excès de sulfite SO32− ou de bisulfite HSO3− entraîne, après traitement en aval (en), la formation d'un produit ayant une odeur désagréable, avec des niveaux plus élevés d'éthylène glycol HOCH2CH2OH ou d'éthers de glycol formés par l'hydrolyse et l'éthoxylation de l'oxyde d'éthylène, ce qui donne des tensioactifs hygroscopiques et gras. Les solutions concentrées d'iséthionate de sodium contenant de l'éthylène glycol peuvent ensuite être en grande partie débarrassées de cette impureté (jusqu'à 0,5 % en masse) par extraction continue avec par exemple de l'isopropanol (CH3)2CHOH[5]. Par conséquent, dans le procédé industriel continu, une solution aqueuse de bisulfite de sodium NaHSO3 est préparée dans un premier réacteur en mélangeant une solution d'hydroxyde de sodium NaOH avec du dioxyde de soufre SO2. Dans un second réacteur, la solution de bisulfite de sodium est mélangée avec un léger excès d'oxyde d'éthylène pour obtenir de l'iséthionate de sodium avec des rendements presque quantitatifs à température et pression élevées avec un contrôle précis du pH. La réaction doit se dérouler à l'abri de l'oxygène et sous contrôle précis de la stœchiométrie des réactifs, de la température, du pH et du débit.
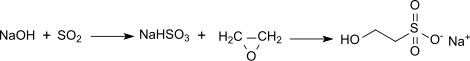
La principale utilisation de l'iséthionate de sodium est la fabrication des tensioactifs de la classe des iséthionates. Ceux-ci moussent beaucoup et sont particulièrement doux, ce qui les rend adaptés au nettoyage des peaux sensibles, d'où leur utilisation préférentielle dans les savons et shampooings pour bébés[6]. L'iséthionate de sodium permet également de produire facilement des tampons à usage biologique tels que HEPES, MES, PIPES, etc.[7]
-
MES.
L'ajout d'iséthionate HOCH2CH2SO3− aux bains de galvanoplastie permet d'atteindre des densités de courant plus élevées pour des concentrations plus faibles qu'avec l'acide méthylsulfonique CH3SO3H bien plus cher, le tout en améliorant l'apparence du produit final[8].
Notes et références[modifier | modifier le code]
- Entrée « 2-Hydroxyethanesulfonic acid sodium salt » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Isethionic acid sodium salt, 98% », sur Alfa Aesar (consulté le ).
- (en) Arthur R. Sexton et Edgar C. Britton pour Dow Chemical Co, Brevet U.S. 2810747A : Continuous production of salts of hydroxy aliphatic sulfonic acids, déposé le 22 août 1955, publié le 22 octobre 1957, sur Google Patents.
- (en) Vincent Lamberti et Beth Ann Di Lorenzo pour Lever Brothers Co, Brevet U.S. 4003925A : Purification of sodium isethionate, déposé le 12 juin 1975, publié le 18 janvier 1977, sur Google Patents.
- (de) Wilfried Umbach, Kosmetik und Hygiene: von Kopf bis Fuß, 3e éd., Wiley, 2004. (ISBN 978-3-527-30996-2)
- (en) Glenn T. Carroll, Gary S. Smith et Gary E. Stringer pour Arkema Inc, Brevet U.S. 7208599B2 : Preparation of substituted alkanesulfonates from 2-hydroxyalkanesulfonates, déposé le 26 octobre 2004, publié le 27 avril 2006, sur Google Patents.
- (en) Hyman D. Gillman, Brenda Fernandes et Kazimierz Wikiel pour Specialty Chemical Systems Inc, Technic Inc, Brevet U.S. 6183619B1 : Metal alloy sulfonic acid electroplating baths, déposé le 19 mars 1999, publié le 6 février 2001, sur Google Patents.