Défense des plantes par champignons endophytes
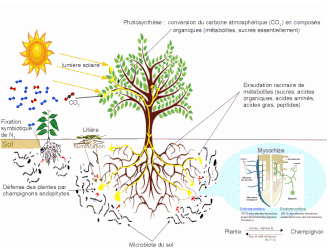
La défense des plantes par des champignons endophytes se produit lorsque des champignons endophytes, qui vivent en symbiose avec la majorité des plantes en pénétrant dans leurs cellules, sont utilisés comme moyen de défense indirecte contre les herbivores[1],[2]. En échange de ressources énergétiques glucidiques, le champignon fournit à la plante des avantages qui peuvent comprendre une amélioration de l'absorption de l'eau ou des nutriments, la tolérance à différents stress tels (excès de sel, vie à l'ombre, attaques de champignons pathogènes, ultraviolets, une protection contre les insectes, oiseaux et mammifères phytophages[3]. Une fois associés, les champignons modifient la teneur en nutriments de la plante et améliorent ou déclenchent la production de métabolites secondaires[4]. Le changement de la composition chimique agit pour dissuader l'herbivorie des insectes, le pâturage par les ongulés ou l'oviposition par les insectes adultes[5]. La défense par les endophytes peut aussi être efficace contre les agents pathogènes et les dommages non liés aux herbivores[6].
Elle se distingue des autres formes de défense indirecte en ce que les champignons vivent à l'intérieur des cellules de la plante et altèrent directement sa physiologie. En revanche, les autres défenses biotiques, tels que les prédateurs ou les parasites des herbivores attaquant la plante, sont généralement attirées par des composés organiques volatils (ou composés sémiochimiques) émis en réaction aux dommages ou par des « récompenses » (nourriture, abri) fournies par la plante [7]. Ces défenseurs diffèrent par le temps qu'ils passent avec la plante : depuis un certain temps pour assurer la ponte par oviposition jusqu'à une durée de nombreuses générations, comme dans la relation de mutualisme fourmi-acacia [8]. Les champignons endophytes tendent à vivre avec la plante pendant toute leur existence.
Diversité des associations endophytiques
[modifier | modifier le code]Les champignons endophytes sont un groupe diversifié d'organismes formant des associations de manière presque omniprésente dans tout le règne végétal. Les endophytes qui procurent une défense indirecte contre les herbivores peuvent avoir diverses origines, y compris les associations racinaires endophytes mutualistes et l'évolution de champignons entomopathogènes en endophytes associés à des plantes[9]. Les endomycorhizes, qui vivent dans les racines des plantes, sont constituées de cinq groupes : arbusculaires, arbutoïdes, éricoïdes, monotropoïdes et mycorhizes d'orchidées. La majorité des espèces appartiennent au phylum des Glomeromycota, les espèces éricoïdes venant des Ascomycota, tandis que les arbutoïdes, monotropoïdes et mycorhizes d'orchidées sont classées parmi les Basidiomycota[10]. La vision entomopathogénique a reçu le soutien d'observations de la stimulation de la croissance fongique en réponse à des défenses induites chez les plantes[11] et la colonisation de tissus végétaux[12].
Les exemples de spécialités d'hôte sont nombreux – en particulier dans des environnements tempérés – avec de multiples champignons spécialistes infectant fréquemment une seule plante simultanément[13],[14]. Ces spécialistes montrent des niveaux élevés de spécificité pour leur espèces-hôtes et peuvent former des races d'hôte physiologiquement adaptées à des congénères étroitement apparentés[15]. Piriformospora indica est un champignon endophyte intéressant de l'ordre des Sebacinales. Ce champignon est capable de coloniser les racines et de former des relations symbiotiques avec toutes les plantes existant sur terre. Piriformospora indica a aussi un effet positif tant sur le rendement que sur la défense de diverses plantes cultivées (orge, tomate, maïs, etc.) contre les pathogènes des racines[16],[17]. Cependant, il existe de nombreux exemples de champignons généralistes qui peuvent se présenter sur différents hôtes à différentes fréquences (par exemple Acremonium endophytes de cinq sous-genres de Festuca[18]) et dans le cadre d'une série d'assemblages fongiques[19],[20]. Ils peuvent même s'étendre à de nouvelles espèces de plantes introduites[21]. Les endophytes mutualistes s'associent avec des espèces représentatives de chaque type de croissance chez les graminées et de nombreux autres groupes de plantes[22]. Les effets de l'association avec de multiples souches ou espèces de champignons peuvent varier, mais en général, un seul type de champignon produit la majorité des bénéfices pour la plante[23],[24].
La fréquence d'une espèce de plante endophytée varie de 0 à 100 % entre les différentes populations, probablement parce que l'endophyte n'est pas systématiquement bénéfique pour la plante, le mutualisme n'ayant de sens qu'à un moment et dans un environnement donnés[25].
Mécanismes de défense
[modifier | modifier le code]Production de métabolites secondaires
[modifier | modifier le code]On a démontré que certaines défenses chimiques que l'on pensait produites par les plantes sont en fait synthétisées par des champignons endophytes. La base chimique de la résistance aux insectes mutualisée entre plantes et endophytes a été étudiée en détail chez le ray-grass vivace et trois grandes catégories de métabolites secondaires ont été découvertes : indoles diterpènes, alcaloïdes de l'ergot et péramines[26],[27],[28]. Les composés apparentés se retrouvent dans toute la gamme des associations entre plantes et champignons endophytes. Les terpènes et les alcaloïdes sont des défenses inductibles qui agissent de manière similaire aux composés défensifs produits par les plantes et qui sont hautement toxiques pour un grand nombre d'espèces d'insectes phytophages et de mammifères herbivores[29],[30]<,[31],[32],[33]. La péramine se trouve fréquemment chez les graminées associées à des endophytes et peut agir comme un signal adressé aux invertébrés phytophages sur la présence de substances chimiques défensives plus dangereuses[34]. Les terpénoïdes et les cétones ont été liés à la protection contre les herbivores et phytophages spécialistes et généralistes (insectes et vertébrés) chez les végétaux supérieurs[35],[36].
Les herbivores généralistes sont plus susceptibles que les spécialistes d'être affectés négativement par les défenses chimiques que produisent les endophytes parce qu'ils ont en moyenne moins de résistance à ces défenses spécifiques[37]. Chez les insectes broyeurs, l'infection par les mycorhizes peut effectivement être bénéfiques aux espèces spécialistes, même si cela affecte négativement les généralistes[38]. Cela semble confirmé par le profil général des effets sur les insectes phytophages, les espèces généralistes se nourrissant du mésophylle étant affectés négativement par l'infection de la plante-hôte, tandis que les insectes piqueurs-suceurs, qui se nourrissent du phloème, semblent être peu touchés par les défenses fongiques[39].
Les métabolites secondaires peuvent également affecter le comportement des ennemis naturels des espèces herbivores dans une association de défense / prédation multi-trophique[7] Par exemple, la production de terpénoïdes attire les ennemis naturels des phytophages vers les plantes attaquées[40]. Ces ennemis peuvent réduire considérablement le nombre d'invertébrés phytophages et ne sont pas forcément attirés en l'absence de symbiontes endophytes[41]. Les interactions multitrophiques peuvent avoir des conséquences en cascade pour l'ensemble de la communauté végétale, et peuvent varier grandement en fonction de la combinaison d'espèces de champignons infectant une plante donnée et les conditions abiotiques[42],[43],[44].
Altération du contenu nutritif
[modifier | modifier le code]En raison de l'économie intrinsèque basée sur l'échange de nutriments de l'association plante-endophyte, il n'est pas surprenant que l'infection par les champignons modifie directement la composition chimique des plantes, avec des impacts correspondants sur les phytophages. Les endophytes augmentent fréquemment la concentration des hydrates de carbone apoplasmiques , modifiant le rapport C: N des feuilles et en faisant une source de protéines moins efficace[45]. Cet effet peut être combiné lorsque le champignon utilise également l'azote de la plante pour former des métabolites secondaires à base de N tels que des alcaloïdes. Par exemple, la mouche du chardon (Urophora cardui) voit ses performances réduites sur les plantes infectées par des champignons endophytes en raison tant de la diminution de leur teneur en azote que de sa capacité à produire de grandes quantités de tissus de galles de bonne qualité[46]. En outre, la plus grande disponibilité de nutriments limitants chez les plantes améliore leur performances globales et leur santé, ce qui peut augmenter la capacité des plantes infectées à se défendre par elles-mêmes[47].
Notes et références
[modifier | modifier le code]- (en) Strauss, S.Y. & Zangerl, A.R. (2003). Plant-insect interactions in terrestrial ecosystems. In: Plant-animal interactions: an evolutionary approach (Herrera, C.M. & Pellmyr, O., Eds.). Malden: Blackwell Publishing. pp. 77-106. (ISBN 978-0-632-05267-7).
- (en) B. Wang et Y.L. Qiu, « Phylogenetic distribution and evolution of mycorrhizae in land plants », Mycorrhiza, vol. 16, no 5, , p. 299–363 (PMID 16845554, DOI 10.1007/s00572-005-0033-6).
- (en) Y. Lekberg et R. T. Koide, « Is plant performance limited by abundance of arbuscular mycorrhizal fungi? A metaanalysis of studies published between 1988 and 2003 », New Phytol, vol. 168, no 1, , p. 189–204 (PMID 16159333, DOI 10.1111/j.1469-8137.2005.01490.x).
- (en) Dighton, J. (2003). Fungi in Ecosystem Processes. New York: Marcel Dekker. (ISBN 978-0-8247-4244-7).
- (en) K. Clay, « Fungal endophytes of grasses », Ann. Rev. Ecol. Systematics, vol. 21, , p. 275–297 (DOI 10.1146/annurev.es.21.110190.001423).
- (en) A.E. Arnold, L.C. Mejia, D. Kyllo, E.I. Rojas, Z. Maynard, N. Robbins et E.A. Herre, « Fungal endophytes limit pathogen damage in a tropical tree », Proc. Nat. Acad. Sci. U.S.A., vol. 100, no 26, , p. 15649–15654 (PMID 14671327, PMCID 307622, DOI 10.1073/pnas.2533483100).
- (en) J.S. Thaler, « Jasmonate-inducible plant defences cause increased parasitism of herbivores », Nature, vol. 399, no 6737, , p. 686–688 (DOI 10.1038/21420).
- (en) D. H. Janzen, « Coevolution of mutualism between ants and acacias in Central America », Evolution, vol. 20, no 3, , p. 249–275 (DOI 10.2307/2406628).
- (en) F.E. Vega, F. Posada, M.C. Aime, M. Pava-Ripoll, F. Infante et S.A. Rehner, « Entomopathogenic fungal endophytes », Biological Control, vol. 46, , p. 72–82 (DOI 10.1016/j.biocontrol.2008.01.008).
- (en) Peterson, R.L.; Massicotte, H.B. & Melville, L.H. (2004). Mycorrhizas: anatomy and cell biology. National Research Council Research Press. (ISBN 978-0-660-19087-7).
- (en) J Baverstock, S.L. Elliot, P.G. Alderson et J.K. Pell, « Response of the entomopathogenic fungus Pandora neoaphidis to aphid-induced plant volatiles », Journal of Invertebrate Pathology, vol. 89, no 2, , p. 157–164 (PMID 16005016, DOI 10.1016/j.jip.2005.05.006).
- (en) S. Gómez-Vidal, J. Salinas, M. Tena et L.V. Lopez-Llorca, « Proteomic analysis of date palm (Phoenix dactylifera L.) responses to endophytic colonization by entomopathogenic fungi », Electrophoresis, vol. 30, no 17, , p. 2996–3005 (PMID 19676091, DOI 10.1002/elps.200900192).
- (en) A.E. Arnold et F. Lutzoni, « Diversity and host range of foliar fungal endophytes: are tropical leaves biodiversity hotspots? », Ecology, vol. 88, no 3, , p. 541–549 (PMID 17503580, DOI 10.1890/05-1459).
- (en) A. Leuchtmann, « Systematics, distribution and host specificity of grass endophytes », Nat. Toxins, vol. 1, no 3, , p. 150–162 (PMID 1344916).
- (en) A. Leuchtmann et K. Clay, « Isozyme variation in the Acremonium/Epichloe fungal endophyte complex », Phytopathology, vol. 80, no 10, , p. 1133–1139 (DOI 10.1094/Phyto-80-1133).
- (en) Ajit Varma, « Piriformospora indica, a Cultivable Plant-Growth-Promoting Root Endophyte », Applied and Environmental Microbiology, vol. 65, no 6, , p. 2741–2744 (PMID 10347070, PMCID 91405, lire en ligne).
- (en) Karl-Heinz Kogel, « The endophytic fungus Piriformospora indica reprograms barley to salt-stress tolerance, disease resistance, and higher yield », Proc Natl Acad Sci(PNAS), vol. 102, no 38, , p. 13386–13391 (PMID 16174735, PMCID 1224632, DOI 10.1073/pnas.0504423102).
- (en) A. Leuchtmann, « Isozyme relationships of Acremonium endophytes from twelve Festuca species », Mycol. Res, vol. 98, , p. 25–33.
- (en) C.G. Kluger, J.W. Dalling, R.E. Gallery, E. Sanchez, C. Weeks-Galindo et A.E. Arnold, « Prevalent host-generalism among fungi associated with the seeds of four neotropical pioneer species », Journal of Tropical Ecology, vol. 24, , p. 332–351
- (en) A. Leuchtmann et K. Clay, « Isozyme variation in the fungus Atkinsonella hypoxylon within and among populations of its host grasses », Can. J. Bot., vol. 67, no 9, , p. 2600–2607 (DOI 10.1139/b89-336).
- (en) D.M. Rykard, C.W. Bacon et E.S. Luttrell, « Host relations of Myriogenospora atramentosa and Balansia epichloe (Clavicipitaceae) », Phytopathology, vol. 75, no 8, , p. 950–956 (DOI 10.1094/Phyto-75-950).
- Clay, K. (1988). Claviciptaceous fungal endophytes of grasses: coevolution and the change from parasitism to mutualism. In: Coevolution of Fungi with Plants and Animals (Hawksworth, D. & Pirozynski, K., eds.). London: Academic Press.
- (en) M. Vicari, P.E. Hatcher et P.G. Ayres, « Combined effect of foliar and mycorrhizal endophytes on an insect herbivore », Ecology, vol. 83, no 9, , p. 2452–2464 (ISSN 0012-9658, DOI 10.1890/0012-9658(2002)083[2452:CEOFAM]2.0.CO;2).
- (en) J. Klironomos, « Variation in plant response to native and exotic arbuscular mycorrhizal fungi », Ecology, vol. 84, no 9, , p. 2292–2301.
- Marc-André Selosse, Anaïs Gibert, « Des champignons qui dopent les plantes », La Recherche, no 457, , p. 75.
- (en) Betina, V., « Indole derived tremorgenic toxins », dans Mycotoxins Production, Isolation, Separation and Purification (Betina, V., ed.). Developments in Food Science, t. 8, New York, Elsevier, .
- (en) Rutschmann, J. & Stadler, P.A., « Chemical background », dans Ergot Alkaloids and Related Compounds (Berde, B. & Schild, H.O., eds.), Berlin, Springer-Verlag, .
- (en) D.D. Rowan, M.B. Hunt et D.L. Gaynor, « Peramine, a novel insect feeding deterrent from ryegrass infected with the endophyte Acremonium loliae », J. Chem. Soc. Chem. Commun, vol. 1986, , p. 935–936 (DOI 10.1039/c39860000935).
- (en) D.X. Zhang, P. Nagabhyru et C.L. Schardl, « Regulation of a Chemical Defense against Herbivory Produced by Symbiotic Fungi in Grass Plants », Plant Physiology, vol. 150, no 2, , p. 1072–1082 (DOI 10.1104/pp.109.138222).
- (en) Popay, A.J.; Prestidge, R.A.; Rowan, D.D. & Dymock, J.J., « The role of Acremonia lolli mycotoxins in insect resistance of perennial ryegrass (Lolium perenne) », dans Proc. 1st Int. Symp. Acremonium/Grass interactions (Quisenberry, S.S. & Joost, R.E., eds.), Baton Rouge, Louisiana Agriculture Experiment Station, .
- (en) K. Clay et G.P. Cheplick, « Effect of ergot alkaloids from fungal endophyt-infected grasses on fall armyworm (Spodoptera frugiperda) », J. Chem. Ecol., vol. 15, , p. 169–182 (DOI 10.1007/BF02027781).
- (en) C.G. Patterson, D.A. Potter et F.F. Fannin, « Feeding deterrency of alkaloids from endophyte-infected grasses to Japanese beetle grubs », Entomol. Exp. Appl., vol. 61, no 3, , p. 285–289 (DOI 10.1111/j.1570-7458.1991.tb01561.x).
- (en) Prestidge, R.A. & Ball, O.J.-P., « A catch 22: the utilization of endophytic fungi for pest management », dans Multitrophic Interactions in Terrestrial Systems (Gange, A.C. & Brown, V.K., eds.), Oxford, Blackwell Scientific., (ISBN 978-0-521-83995-2), p. 171-192.
- (en) D.D. Rowan, J.J. Dymock et M.A. Brimble, « Effect of fungal metabolite peramine and analogs on feeding and development of Argentine stem weevil (Listronotus bonariensis) », J. Chem. Ecol., vol. 16, no 5, , p. 1683–1695 (DOI 10.1007/BF01014100).
- (en) K. Akiyama et H. Hayashi, « Arbuscular mycorrhizal fungus-promoted accumulation of two new triterpenoids in cucumber roots », Biosci. Biotechnol. Biochem., vol. 66, , p. 762–769 (DOI 10.1271/bbb.66.762).
- (en) F. Rapparini, J. Llusia et J. Penuelas, « Effect of arbuscular mycorrhizal (AM) colonization on terpene emission and content of Artemisia annua L », Plant Biol., vol. 10, no 1, , p. 108–122 (DOI 10.1055/s-2007-964963).
- (en) Smith, S.E. & Read, D.J., Mycorrhizal symbiosis. (3e éd.), Londres, Academic Press, (ISBN 978-0-12-370526-6).
- (en) J. Koricheva, A.C. Gange et T. Jones, « Effects of mycorrhizal fungi on insect herbivores: a meta-analysis », Ecology, vol. 90, no 8, , p. 2088–2097 (DOI 10.1890/08-1555.1).
- (en) C. Gehring et A. Bennett, « Mycorrhizal fungal-plant-insect interactions: the importance of a community approach », Environ. Entomol, vol. 38, no 1, , p. 93–102 (DOI 10.1603/022.038.0111).
- (en) J.H. Langenheim, « Higher-plant terpenoids – a phytocentric view of their ecological roles », J. Chem. Ecol., vol. 20, no 6, , p. 1223–1280 (DOI 10.1007/BF02059809).
- (en) H. Kagata et T. Ohgushi, « Bottom-up trophic cascades and material transfer in terrestrial food webs », Ecol. Res., vol. 21, , p. 26–34 (DOI 10.1007/s11284-005-0124-z).
- (en) A. Pineda, S.J. Zheng, J.J.A. van Loon, C.M.J. Pieterse et M. Dicke, « Helping plants to deal with insects: the role of beneficial soil-borne microbes », Trends in Plant Science, vol. 15, no 9, , p. 507–514 (DOI 10.1016/j.tplants.2010.05.007).
- (en) A.C. Gange, V.K. Brown et D.M. Aplin, « Multitrophic links between arbuscular mycorrhizal fungi and insect parasitoids », Ecol. Lett., vol. 6, no 12, , p. 1051–1055 (DOI 10.1046/j.1461-0248.2003.00540.x).
- (en) J.H. Valenzuela-Soto, M.G. Estrada-Hernandez, E. Ibarra-Laclette et J.P. Delano-Frier, « Inoculation of tomato plants (Solanum lycopersicum) with growth-promoting Bacillus subtilis retards whitefly Bemisia tabaci development », Planta, vol. 231, no 2, , p. 397–410 (DOI 10.1007/s00425-009-1061-9).
- (en) Richardson, M.D., « Alkaloids of endophyte-infected grasses: defense chemicals or biological anomalies? », dans Microbial Endophytes (Bacon, C.W.; White, J.F., eds.), New York, Marcel Dekker, (ISBN 0-8247-8831-1), p. 323-340.
- (en) A.C. Gange et H.E. Nice, « Performance of the thistle gall fly, Urophora cardui, in relation to host plant nitrogen and mycorrhizal colonization », New Phytologist, vol. 137, no 2, , p. 335–343 (DOI 10.1046/j.1469-8137.1997.00813.x).
- (en) P. Gosling, A. Hodge, G. Goodlass et G.D. Bending, « Arbuscular mycorrhizal fungi and organic farming », Agric. Ecosyst. Environ, vol. 113, , p. 17–35 (DOI 10.1016/j.agee.2005.09.009).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) J. Dighton, Fungi in Ecosystem Processes, New York, M. Dekker, (ISBN 978-0-8247-4244-7, lire en ligne)
- (en) S.C. Redlin et L.M. Carris, Endophytic fungi in grasses and woody plants: Systematics, ecology, and evolution, Saint-Paul (Minnesota), APS Press, (ISBN 978-0-89054-213-2)
- (en) G.P. Cheplick et S.H. Faeth, Ecology and evolution of the grass-endophyte symbiosis, Oxford, Oxford University Press, (ISBN 978-0-19-530808-2, lire en ligne)
- Catherine Grand Ravel, Les champignons endophytes des graminées : distribution et coévolution avec leurs espèces hôtes, Clermont-Ferrand, Université Clermont-Ferrand II (thèse),
- (en) Anna Maria Pirttilä et A. Carolin Frank, Endophytes of forest trees : biology and applications, Dordrecht/New York, Springer, , 322 p. (ISBN 978-94-007-1599-8, lire en ligne)
