Isocombrétastatine A-4
| Isocombrétastatine A-4 | |
| |
| Représentation en 2D de l'Isocombrétastatine A-4 | |
| Identification | |
|---|---|
| DCI | Isocombrétastatine A4 |
| Nom UICPA | 2-méthoxy-5-[1-(3,4,5-triméthoxyphényl)éthényl]phénol |
| Synonymes |
IsoCA-4 |
| No CAS | |
| PubChem | 24996163 |
| SMILES | |
| InChI | |
| Apparence | Poudre solide |
| Propriétés chimiques | |
| Formule | C18H20O5 |
| Masse molaire[1] | 316,348 4 ± 0,017 3 g/mol C 68,34 %, H 6,37 %, O 25,29 %, 316,35 g mol−1 |
| Propriétés physiques | |
| T° ébullition | Décomposition > 480,8 °C (1 atm) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
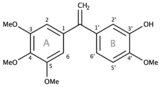
L’isocombrétastatine A-4 est une molécule naturelle appartenant à la classe des stilbène qui présente des propriétés anti-cancéreuses démontrées à l’aide d’une méthode utilisant des nanoparticules multifonctionnelles. Découverte en 2007, elle est isolée de la combrétastatine A-4 (en), elle est composée de deux noyaux aromatiques A et B reliés par un carbone sp2[2].
Histoire[modifier | modifier le code]
Isolée en 1989 du petit saule africain Combretum Caffrum (en)[3], la combrétastatine A-4 présente un potentiel cytotoxique pour une grande variété de cellules cancéreuses chez l’être humain. Elle est aussi utilisée pour son activité d’inhibition de la polymérisation de la tubuline[4] ainsi que pour interrompre les réseaux vasculaires qui se créent, dans le cadre de formation de tumeurs cancéreuses. Cependant, ce composé sous sa forme naturelle (isomère Z) se montre assez instable, dans le cadre de stockage, d’administration et de métabolisme. Elle peut alors s’isomériser sous la forme E, qui est moins active[5]. À partir de 2005, les recherches dans le domaine de la Chimie Médicinale, se sont donc portées sur la synthèse d’isocombrétastatines afin de pouvoir contrôler cette instabilité en remplaçant cette double liaison (Z)-éthylène instable[3]. En 2007, l’isocombrétastatine A-4, stilbène naturel, est découverte[6]. Elle se montre plus stable et plus simple à synthétiser, tout en présentant des propriétés antitumorales similaires à la combrétastatine A-4[7]. Un autre avantage est qu’elle présente un angle dièdre, entre le plan du noyau aromatique et celui de la liaison cis-méthylène, de 68°[8]. Il est semblable à celui de la combrétastatine A-4, permettant une fixation spécifique sur le même site d’activité pour ces deux molécules[3].
Fonctions biologiques[modifier | modifier le code]
Inhibition de la polymérisation de la tubuline[modifier | modifier le code]
Les microtubules ont un rôle majeur dans différents phénomènes biologiques notamment dans la mitose. Ils sont caractérisés par une structure filamenteuse ainsi que par la présence d’une polarité aux extrémités, qui est très importante dans leurs fonctions. Durant la mitose au sein des cellules eucaryotes, nous pouvons observer l’organisation du fuseau mitotique. Celui-ci va être composé de trois types différents de microtubules (polaires, astraux et kinétochoriens) qui vont jouer des rôles différents durant la phase appelée “interphase”, où l’on peut observer une séparation des chromosomes. À la fin du cycle cellulaire, nous pourrons donc observer la formation de deux cellules filles[3].

L’isocombrétastatine A-4 va jouer le rôle d’inhibiteur en bloquant l’assemblage de la tubuline lors de la phase de nucléation au niveau des dimères de tubulines. Pour cela, elle se fixe principalement au niveau du site de liaison de la colchicine[9] (alcaloïde très toxique qui inhibe la polymérisation des microtubules) provoquant une instabilité du réseau microtubulaire. Cette inhibition va provoquer l’arrêt du cycle cellulaire à la phase G2/M de la mitose qui mènera ensuite à un phénomène d’apoptose de la cellule cancéreuse[10].
Destruction de la vascularisation tumorale[modifier | modifier le code]
Des études ont montré l’action de l’isocombrétastatine A-4 dans la destruction de la vascularisation tumorale. Le développement d’une tumeur fait appel à de nombreux phénomènes comme notamment l’angiogenèse. L’angiogenèse correspond à la formation de nouveaux vaisseaux sanguins à partir de la vascularisation préexistante. Ces nouveaux vaisseaux jouent un rôle important dans la migration et le développement des cellules tumorales. Le ciblage spécifique de la vascularisation des cellules cancéreuses offre un angle d’approche intéressant dans le traitement anticancéreux.
L’isocombrétastatine A-4 par son action rapide et directe, permet de détruire ces nouveaux vaisseaux sanguins par des phénomènes de nécroses. Ce phénomène va aboutir à la mort du système vasculaire à l’origine de la migration et du développement des cellules cancéreuses. L’isocombrétastatine A-4 est ainsi utilisé dans différents traitements comme dans le traitement des cancers de l'ovaire, des tumeurs neuroendocrines, de certains cancers de la thyroïde et plus récemment, des gliomes multiformes[3].
L’isocombrétastatine A-4 est à l'origine d’un travail de l’ELLCC (Équipe Labellisée Ligue Contre le Cancer)[8] qui a su démontrer l’activité anti vasculaire de cette molécule sur un modèle de xénogreffe de tumeurs humaines sur souris nude (souris utilisée en laboratoire présentant une mutation génétique). Au cours de cette étude il a été démontré que pour la souris traité par l’isocombrétastatine A-4, on avait une absence de diffusion de l’agent de contraste au sein de la tumeur ce qui caractérise l’effet anti vasculaire de l’isocombrétastatine A-4 qui permet de détruire les nouveaux vaisseaux sanguins. L’autopsie de la souris 48 h après l’injection de l’isocombrétastatine A-4 a permis de montrer une nécrose de la tumeur à 90 %.
Cette étude a également montré l’efficacité anticancéreuse de l’isocombrétastatine A-4, lorsque celui-ci est combiné à un antimétabolique. Le principe de cette étude a été de préparer des nano précipités contenant à la fois un antimétabolique et l’isocombrétastatine A-4. Ce couplage de deux espèces a permis d’obtenir un nanomédicament aux propriétés remarquables : forte stabilité, demi-vie plasmatique importante, biodisponibilité et distribution cellulaire importante. L’efficacité tumorale de ces nanomédicaments a été testée sur un modèle xénogreffe de tumeurs humaines sur des souris nudes. Ce nanomédicament a conduit à une régression tumorale de 93% chez la souris, résultat supérieur aux autres traitements disponibles[2].
Voie de synthèse[modifier | modifier le code]
Initialement, l’isocombrétastatine A-4 était synthétisée à partir d’une réaction de Wittig (réaction 4). Cette réaction se caractérise par l’addition d’un ylure de phosphore sur la fonction cétone, cette addition permet la formation d’un éthylène. L’isocombrétastatine A-4 pouvait également être synthétisée à partir d’une condensation d’un organolithien (réaction 2) sur une acétophénone. Cette condensation est ensuite suivie d’une déshydratation permettant d’obtenir l’isocombrétastatine A-4. Ces deux synthèses fonctionnaient bien chimiquement mais n’étaient pas les plus simples à réaliser.
D’autres voies de synthèse ont ensuite été découvertes. Ces synthèses (réactions 1 et 5) faisaient intervenir un couplage organométallique en présence de différents types de catalyseurs métalliques : palladium-cuivre ou fer-cuivre. Ces deux synthèses fonctionnaient bien chimiquement mais nécessitaient l'utilisation de réactifs organométalliques en quantité stoechiométriques, ce qui compliquait la réalisation de ces synthèses.
Très récemment, une nouvelle synthèse a été mise en place. Cette nouvelle synthèse (réaction 3) utilise la réaction des N-tosylhydrazones avec un halogénure aromatique. Cette réaction est catalysée par un complexe de palladium, qui permet d’obtenir un meilleur rendement[2].

Dérivés[modifier | modifier le code]
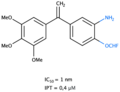
Les analogues de l’isocombrétastatine A-4 sont assez variés. Les isocombrétastatines possèdent un pharmacophore 1,1-diarylethylène qui fonctionne de la même manière que la molécule naturelle[8]. Les expériences ont montré que le cycle B pouvait être remplacé par une large gamme d’hétérocycle[11]. Le groupement OH porté par le C3’ n'est pas essentiel à son activité antitumorale et peut être remplacé par une multitude de substituants. Au contraire le groupement O-Me du C4’ est nécessaire à sa fonction et sa modification est possible mais peut conduire à une altération de sa fonction cytotoxique et antiproliferative[6].
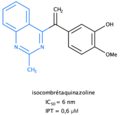
La caractéristique structurale commune à ces composés est la présence du cycle A triméthoxyphényle, un élément structural indispensable à l’activité antitumorale et dont le remplacement ou la modification de ses substituants induit une perte d’activité biologique. Seul un substituant tel qu’un noyau hétérocyclique de type quinazoline ou quinoléine permet d’assurer sa fonction antitumorale[2].
Pour faciliter les comparaisons et l'établissement des effets, les valeurs de IC50 (concentration inhibitrice médiane) et d’IPT (inhibition de la polymérisation de la tubuline) des analogues de l'isocombrétastatine A-4 ont été reportées préférentiellement sur les lignées cellulaires humaines de cancer du côlon (HCT116), (HT29), (HT15) et (HCT8)[6].
| Substitué au niveau du cycle B |
|
|
| Modulation du cycle B |
|
|
| Modulation du cycle A |
|
|

Enjeux[modifier | modifier le code]
Le cancer est la deuxième cause de mortalité dans le monde, précédée par les maladies cardiovasculaires. Sur plus de 58 millions de décès en 2005[12], environ 13% avaient pour cause un cancer et pour y remédier, des efforts majeurs ont été déployés. De nos jours, la Recherche médicale travaille sur la découverte de nouvelles molécules plus efficaces afin d’éviter le phénomène de résistance qui, avec les traitements actuels, est de plus en plus rencontré. Les chercheurs ont pu pallier ce problème en créant des traitements d’association cytotoxique (mort cellulaires des cellules tumorales) qui ont permis de réduire les effets secondaires et d’améliorer le confort des malades.
De plus, les traitements actuels utilisés pour les cancers du sein, du poumon, de la prostate, côlon et rectum ne sont utiles que pour diminuer la gravité des tumeurs sans guérir intégralement le patient. C’est pour cela que les chercheurs sont à la recherche d’isomères de la combrétastatine A-4, adoptant un mécanisme de nécrose cellulaire au lieu d’un mécanisme d’apoptose. En effet, in vivo, l’activité antitumorale de la combretastatine-A4 décroît jusqu’à disparaître entièrement. Cette disparition d’activité est expliquée par le caractère lipophile de la combrétastatine A-4 qui est peu soluble dans l’eau et par l’isomérisation de la double liaison Z, isomère naturel, en E. Dans le cadre expérimental, cet isomère se montre 60 fois moins actif dans les cellules leucémiques de souris, donnant lieu à une pharmacocinétique très faible[12].
Les isomères trouvés sont appelés iso-combrétastatine A-4. Ces isomères présentent une forme de cytotoxicité grâce à leur concentration inhibitrice médiane (IC50, efficacité d’une molécule pour inhiber une fonction biochimique ou biologique spécifique) de l’ordre du nanomolaire sur un grand nombre de cellules cancéreuses humaines et grâce à leur pouvoir d’inhibition sur la polymérisation de la tubuline avec une IC50 de l’ordre du micromolaire. L'isocombrétastatine A-4 ne présente pas de stéréochimie au niveau de l’éthylène, ce qui va conduire à une stabilité de l’isomère Z qui ne s'isomérise pas, in vivo, en isomère E.
L’activité anti-proliférative et cytotoxique de l’isocombrétastatine A-4 a été testé sur de nombreuses lignées cellulaires humaines et s’est montrée extrêmement efficace avec une IC50 variant de 1 à 8 nanomolaires. Une de ses propriétés importantes est son niveau d’activité sur des lignées résistantes à savoir le cancer du seins résistant (MCF7R), le carcinome colorectal résistant (HCT15R) et la leucémie promyélocytaire résistante (HL60R)[2].
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- La vincristine est un inhibiteur de la polymérisation de la tubuline utilisé dans les traitements contre les cancers.
- La vindésine est un alcaloïde utilisé dans le traitement de certains types de cancers.
- La vinblastine est un inhibiteur de la polymérisation de la tubuline utilisé dans les traitements du cancer du poumon, le cancer du sein et les lymphomes.
- La vinorelbine est un agent anticancéreux utilisé dans les traitements contre le cancer du poumon et le cancer du sein.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Mouad Alami, Chimie et biologie de synthèse. Les applications., (lire en ligne), « De nouvelles perspectives en thérapie antivasculaire Pourquoi faire compliquer quand on peut faire simple ? »
- Abdelfattah FAOUZI, Synthèses et évaluations biologiques d’analogues de la combrétastatine A-4 et d’inhibiteurs de kinases DYRK, Université de Lyon, (lire en ligne)
- Koji Ohsumi, Ryusuke Nakagawa, Yumiko Fukuda, Toshihiro Hatanaka, Yoshihiro Morinaga, Yukio Nihei, Kazuo Ohishi, Yasuyo Suga, Yukio Akiyama et Takashi Tsuji, « Novel Combretastatin Analogues Effective against Murine Solid Tumors: Design and Structure−Activity Relationships », Journal of Medicinal Chemistry, vol. 41, no 16, , p. 3022–3032 (ISSN 0022-2623 et 1520-4804, DOI 10.1021/jm980101w, lire en ligne, consulté le )
- Evelia Rasolofonjatovo, Olivier Provot, Abdallah Hamze, Jordi Rodrigo, Jérome Bignon, Joanna Wdzieczak-Bakala, Déborah Desravines, Joëlle Dubois, Jean-Daniel Brion et Mouad Alami, « Conformationnally restricted naphthalene derivatives type isocombretastatin A-4 and isoerianin analogues: Synthesis, cytotoxicity and antitubulin activity », European Journal of Medicinal Chemistry, vol. 52, , p. 22–32 (ISSN 0223-5234, DOI 10.1016/j.ejmech.2012.03.001, lire en ligne, consulté le )
- Abdallah Hamze, Mouad Alami et Olivier Provot, « Developments of isoCombretastatin A-4 derivatives as highly cytotoxic agents », European Journal of Medicinal Chemistry, vol. 190, , p. 112110 (ISSN 0223-5234, DOI 10.1016/j.ejmech.2020.112110, lire en ligne, consulté le )
- Ming-Yu Song, Qiu-Rui He, Yi-Lin Wang, Hao-Ran Wang, Tian-Cheng Jiang, Jiang-Jiang Tang et Jin-Ming Gao, « Exploring Diverse-Ring Analogues on Combretastatin A4 (CA-4) Olefin as Microtubule-Targeting Agents », International Journal of Molecular Sciences, vol. 21, no 5, , p. 1817 (ISSN 1422-0067, PMID 32155790, PMCID PMC7084768, DOI 10.3390/ijms21051817)
- Mouad Alami, « Des isocombrétastatines aux bioconjugués thérapeutiques - p21 - N°480 - L'Actualité Chimique, le journal de la SCF », sur Société Chimique de France (SCF) (consulté le )
- Samir Messaoudi, Bret Tréguier, Abdallah Hamze, Olivier Provot, Jean-François Peyrat, Jordi Rodrigo De Losada, Jian-Miao Liu, Jérôme Bignon, Joanna Wdzieczak-Bakala, Sylviane Thoret, Joëlle Dubois, Jean-Daniel Brion et Mouâd Alami, « Iso combretastatins A versus Combretastatins A: The Forgotten iso CA-4 Isomer as a Highly Promising Cytotoxic and Antitubulin Agent », Journal of Medicinal Chemistry, vol. 52, no 14, , p. 4538–4542 (ISSN 0022-2623 et 1520-4804, DOI 10.1021/jm900321u, lire en ligne, consulté le )
- Ilhem Khelifi, Timothée Naret, Dolor Renko, Abdallah Hamze, Guillaume Bernadat, Jérome Bignon, Christine Lenoir, Joëlle Dubois, Jean-Daniel Brion, Olivier Provot et Mouad Alami, « Design, synthesis and anticancer properties of IsoCombretaQuinolines as potent tubulin assembly inhibitors », European Journal of Medicinal Chemistry, vol. 127, , p. 1025–1034 (ISSN 0223-5234, DOI 10.1016/j.ejmech.2016.11.012, lire en ligne, consulté le )
- Shannon Pecnard, Abdallah Hamze, Jérome Bignon, Bastien Prost, Alain Deroussent, Laura Gallego-Yerga, Rafael Peláez, Ji Yeon Paik, Marc Diederich, Mouad Alami et Olivier Provot, « Anticancer properties of indole derivatives as IsoCombretastatin A-4 analogues », European Journal of Medicinal Chemistry, vol. 223, , p. 113656 (ISSN 0223-5234, DOI 10.1016/j.ejmech.2021.113656, lire en ligne, consulté le )
- Mouad ALAMI, Jean-Daniel Brion, Olivier PROVOT, Jean-François PREYVAT, Samir MESSAOUDI, Abdallah HAMZE, Anne GIRAUD, Jérôme BIGNON, Joanna BAKALA et Jian-Miao Liu, Iso ca-4 et analogues : puissants cytotoxiques, inhibiteurs de la polymerisation de la tubuline, Université Paris-Sud Paris 11,