Géohelminthiases
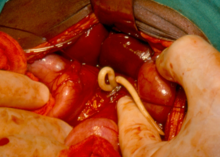
Les géohelminthiases sont des maladies provoquées par l'infestation par des nématodes. Il s'agit d'helminthiases causée par des géohelminthes, des espèces de vers qui se transmettent par les sols contaminés par les selles d'individus atteints.
Trois types de géohelminthiases peuvent être distingués : l'ascaridiase, l'ankylostomose et la trichocéphalose. Les géohelminthes responsables de ces maladies sont, respectivement, Ascaris lumbricoides, Necator americanus et Ancylostoma duodenale, et Trichuris trichiura.
C’est la parasitose la plus répandue chez l’humain dans le monde[1]. En 2022, l'Organisation mondiale de la santé estime que 1,5 milliard d'humains sont atteints de géohelminthiases, soit environ un quart de la population mondiale[2]. La plupart des cas surviennent dans les zones rurales pauvres d'Afrique subsaharienne, d'Amérique latine, d'Asie du Sud-Est et de Chine[3]. Elle est favorisée par le manque d'assainissement, comme la pratique de la défécation en plein air, le manque d'hygiène comme le lavage insuffisant des mains et la marche pieds nus sur les sols contaminés[4],[5],[6]. En 2006, c'est la cause la plus courante de retard intellectuel et physique dans le monde[7].
Ces helminthiases sont ainsi nommées car les vers se transmettent par l'ingestion d'œufs de nématodes présents dans les sols, qui sont contaminés par des excréments. Ces maladies sont plus répandues dans les zones chaudes et humides où l'assainissement et l’hygiène sont médiocres et les eaux dangereuses, y compris dans les zones tempérées pendant les mois les plus chauds. Les géohelminthiases sont classées parmi les 20 maladies tropicales négligées car elles provoquent des handicaps et des souffrances importants, qui peuvent être traitées cliniquement et facilement évitées (principalement grâce à un assainissement amélioré), mais une attention négligeable leur a été accordée pendant de nombreuses années[8]. L'Organisation mondiale de la santé (OMS) prévoit son élimination d'ici 2030[2].
Les stratégies simples de prévention et de contrôle des géohelminthiases sont l’amélioration de l'accès à l'assainissement, la sensibilisation des populations à risque à l’hygiène personnelle et l’éducation sanitaire.
Cycle des parasites[modifier | modifier le code]
Les personnes atteintes de géohelminthiases ont des géohelminthes dans leurs intestins. Les géohelminthes y pondent des milliers d'œufs par jours, qui sont libérés en même temps que les selles. Lorsque les selles contaminent les sols, ces œufs se trouvent dans l'environnement. Après une période de maturation de 3 semaines, les œufs deviennent infectieux[2].
Lorsque des fruits et légumes contaminés par des œufs sont ingérés sans être lavés ou cuits suffisamment, les œufs se développent dans le système digestif de la personne les ayant ingérés. Ils peuvent aussi infester les personnes qui boivent de l'eau contaminée, ou les enfants qui touchent le sol puis mettent leur main à la bouche. Ils éclosent, et les larves se fixent dans le système digestif[2].
Les œufs d'ankylostomes peuvent aussi éclore directement dans les sols. Les larves peuvent ainsi traverser activement la peau humaine, et infester des personnes qui marchent pied nus sur un sol contaminé[2],[7].
Espèces responsables[modifier | modifier le code]
Ascaridiase[modifier | modifier le code]
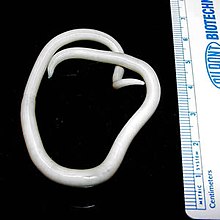
L'ascaridiase est la géohelminthiase causée par Ascaris lumbricoides. Il s’agit de l’helminthiase la plus répandue, touchant environ 800 millions de personnes en 2012[9]. Les victimes constituent environ la moitié des populations des zones tropicales et subtropicales. La plupart des affections sont bénignes et ne présentent que peu ou pas de symptômes. Les infections graves sont cependant débilitantes, provoquant de graves blocages intestinaux et nuisant à la croissance des enfants. Les enfants sont les plus infestés, le groupe d'âge le plus touché étant celui des 3 à 8 ans. Les enfants sont plus sensibles en raison de leur exposition fréquente à un environnement contaminé, par exemple en jouant, en mangeant des légumes et des fruits crus et en buvant des eaux usées[7]. En 2012, l'OMS estime à entre 3 000 et 60 000 le nombre de décès annuels causés par l'ascaridiase[9].
Ankylostomose[modifier | modifier le code]
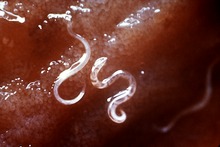
L'ankylostomose est la géohelminthiase causée par Necator americanus et Ancylostoma duodenale. Des infections bénignes provoquent la diarrhée et des douleurs abdominales. Des infections plus graves peuvent créer de graves problèmes de santé chez les nouveau-nés, les enfants, les femmes enceintes et les adultes souffrant de malnutrition. C'est la principale cause d'anémie et de carence en protéines dans les pays en développement, touchant environ 600 millions de personnes en 2012[9]. Necator americanus est l'ankylostome le plus commun, tandis que Ancylostoma duodenale est plus restreint géographiquement. Contrairement aux autres géohelminthiases, qui touchent le plus les enfants, les ankylostomes de haute intensité sont plus fréquentes chez les adultes, en particulier chez les femmes. Environ 44 millions de femmes enceintes sont infestées en 2006. La maladie entraîne de graves effets chez la mère et le nourrisson, tels qu'un faible poids à la naissance, une production de lait altérée et un risque accru de mortalité[7]. En 2012, l'OMS estime à entre 3 000 et 65 000 le nombre de décès annuels causés par les ankylostomoses.
Trichocéphalose[modifier | modifier le code]

La trichocéphalose est la géohelminthiase provoquée par Trichuris trichiura. Près de 600 millions de personnes sont infestées en 2012[9], dont une majorité d'enfants. Des infections graves peuvent entraîner des symptômes aigus tels que la diarrhée et l'anémie, ainsi que des symptômes chroniques tels qu'un retard de croissance et un développement cognitif altéré. Les problèmes médicaux sont plus souvent graves car la co-infection avec des parasites protozoaires tels que Giardia et Entamoeba histolytica et avec d'autres nématodes est courante[7]. Maladie principalement tropicale des pays en développement, la trichocéphalose est aussi courante aux États-Unis[10]. En 2012, l'OMS estime à entre 3 000 et 10 000 le nombre de décès annuels causés par la trichocéphalose.
Anguillulose[modifier | modifier le code]
L'anguillulose est la géohelminthiase provoquée par Strongyloides stercoralis. Plus de 600 millions de personnes sont infestées par Strongyloides stercoralis[2].
Signes et symptômes[modifier | modifier le code]
Les symptômes des géohelminthiases ne deviennent évidents que lorsque l’intensité de l’infection est relativement élevée. Ainsi, une quantité plus élevée de vers signifie une maladie plus grave[11],[12],[13].
Général[modifier | modifier le code]
La plupart des personnes atteintes de géohelminthiases sont légèrement parasitées et ne présentent aucun symptôme perceptible. Les infections graves entraînent cependant beaucoup de problèmes de santé, comme des douleurs abdominales, des diarrhées, une perte de sang et de protéines, un prolapsus rectal et un retard physique et mental. L'ascaridiase sévère provoque généralement une pneumonie, car les larves envahissent les poumons, produisant de la fièvre, de la toux et une dyspnée au début de l'infection[14],[15]. Les infections par l'ankylostomiase insinuent une réaction cutanée (dermatite), une augmentation des globules blancs (éosinophiles), une réaction pulmonaire (pneumopathie) et une éruption cutanée (urticarienne)[15],[16].
L'anémie ferriprive due à une perte de sang est un symptôme courant[9].
Malnutrition[modifier | modifier le code]
Les géohelminthiases sont souvent associées à la malnutrition chez les enfants, car elles aggravent leur état nutritionnel de plusieurs manières[17]. Les vers peuvent provoquer des saignements intestinaux, rentrer en compétition avec leur hôte pour les nutriments (malabsorption des nutriments), une anémie et des diarrhées fréquentes[18]. Les géohelminthiases peuvent également provoquer une perte d’appétit[17]. Ces effets nutritionnels des géohelminthiases peuvent avoir un impact significatif sur le développement mental et physique des enfants. Dans les pays d'endémie, les communautés restent marginalisées en raison de la malnutrition, de troubles cognitifs et de faiblesses physiques dues à de fortes infections[11],[12].
Diagnostic[modifier | modifier le code]
Pour le diagnostic de base, des helminthes spécifiques peuvent généralement être identifiés à partir de l'observation au microscope et le dénombrement des œufs présents dans les selles. Cependant, cette méthode possède certaines limites telles que l'incapacité d'identifier les infections mixtes et, en pratique clinique, la technique est imprécise et peu fiable[19],[20]. Une nouvelle méthode efficace pour l'analyse des œufs est la technique Kato–Katz. Il s'agit d'une méthode très précise et rapide pour Ascaris lumbricoides et Trichuris trichiura ; mais pas tellement pour l'ankylostome[21].
Prévention[modifier | modifier le code]
Il existe des mesures de prévention et de contrôle efficace permettant de prévenir les géohelminthiases : l'amélioration de l'accès à l'eau potable, l'amélioration de l'accès à l'assainissement qui comprend l'utilisation de toilettes propres et fonctionnelles par tous les membres des communautés à risque, l'éducation à l'hygiène personnelle telle que le lavage des mains, le lavage et la préparation appropriée des aliments[17].
Eliminer l'utilisation d'excréments humains non traités comme engrais est également une mesure de prévention[17].
Traitement[modifier | modifier le code]
L'Organisation mondiale de la santé recommande l'albendazole ou le mébendazole pour le traitement des ascaridiases, des ankylostomoses, et des trichocéphalose. Pour les anguillulose, elle recommande plutôt l'ivermectine[2].
Chimiothérapies préventives de masse[modifier | modifier le code]
Une stratégie pour contrôler la maladie dans les zones où elle est courante consiste à traiter des groupes entiers de personnes avec des médicaments antihelminthiques, quels que soient leurs symptômes. Cette stratégie s'appelle l'administration massive de médicaments. L'Organisation mondiale de la santé (OMS) recommande des traitements de masse à tous les groupes à risque dans les communautés endémiques, en particulier les femmes en âge de procréer et les enfants. Des traitements de masse peuvent également être proposés aux femmes enceintes au cours de leurs deuxième et troisième trimestres, ainsi qu’aux femmes qui allaitent[22]. C'est ce qu'on appelle le déparasitage de masse[23]. Bien que le traitement des enfants infectés soit efficace, il existe des preuves significatives qui concluent que le déparasitage de routine, en l'absence de test positif, n'améliore pas la nutrition, l'hémoglobine, la fréquentation scolaire ou les résultats scolaires[24].
À cette fin, les benzimidazoles à large spectre tels que le mébendazole et l'albendazole sont les médicaments de choix recommandés par l'OMS. Ces anthelminthiques sont sûrs, peu coûteux et efficaces pendant plusieurs mois. Le mébendazole est administré deux fois par jour pendant trois jours consécutifs, tandis que l'albendazole est administré en dose unique. L'OMS recommande un traitement annuel dans les zones où entre 20 et 50 % des personnes sont infectées, et un traitement biannuel si ce taux dépasse 50 % ; et dans les situations à faible risque (c'est-à-dire moins de 20 % de prévalence), un traitement au cas par cas[9],[25]. Le pyrantel est tout aussi efficace sur les ascaris. Cependant, il a été rapporté que l'albendazole, le mébendazole et le pyrantel ne sont pas entièrement efficaces contre Trichuris trichiura avec des doses orales uniques[26].
Médicaments pour les personnes atteintes d'autres maladies[modifier | modifier le code]
En cas de co-infection, une thérapie combinée à l'ivermectine et à la diéthylcarbamazine est préconisée. Cependant, la co-infection par le paludisme et le VIH, en particulier chez les femmes africaines, ne répond pas bien aux thérapies combinées actuelles[27]. Pour la trichocéphalose, les médicaments recommandés ne donnent pas de résultats positifs[28]. Un nouveau médicament, la tribendimidine, qui a été approuvé en Chine par le CCDC pour usage humain en 2004, a été soumis à des essais cliniques montrant qu'il est très efficace contre les principales douves humaines, l'ascaris (taux de guérison > 90 %) et l'ankylostomiase (taux de guérison > 82 %). Cependant, son taux de guérison pour la trichocéphalose est faible (< 37 %)[29].
Intervention chirurgicale[modifier | modifier le code]
Dans certains cas graves d'ascaridiase, le nombre de vers ascaris peut provoquer une occlusion intestinale nécessitant une intervention chirurgicale d'urgence. L'obstruction peut être due à une masse accumulée de vers ou à une torsion de l'intestin. Pendant l'intervention chirurgicale, les vers peuvent être retirés[30].
Épidémiologie[modifier | modifier le code]
Régions[modifier | modifier le code]
Les géohelminthiases sont réparties dans les zones aux climats tropical et subtropical, chez les populations pauvres avec un faible accès à l'eau potable, à l'assainissement et à l'hygiène. On la retrouve surtout en Afrique subsaharienne, en Amérique du Sud, en Chine et en Asie[2].
Estimations du nombre de cas[modifier | modifier le code]
En 2022, l'Organisation mondiale de la santé estime que plus de 1,5 milliard de personnes dans le monde (24 % de la population totale) sont atteintes de géohelminthiases. Plus de 270 millions d’enfants d’âge préscolaire, plus de 600 millions d’enfants d’âge scolaire, 108 millions d’adolescentes et 138,8 millions de femmes enceintes ou allaitantes vivent dans des zones à risque et ont besoin d’un traitement et d’interventions préventifs[2].
Par type de ver parasite, la répartition est en 2009[31] :
- environ 807 à 1 121 millions d'ascaridiases ;
- environ 576 à 740 millions d'ankylostomose ;
- environ 604 à 795 millions de trichocéphalose.
Décès[modifier | modifier le code]
Entre 2001 et 2010, l'OMS estime que les géohelminthiases ont directement provoquées 135 000 décès chaque année[3].
Le nombre de décès dus au lien avec la malnutrition est probablement beaucoup plus élevé[32],[33].
Références[modifier | modifier le code]
- (en) Lo, Heft-Neal, Coulibaly et Leonard, « State of deworming coverage and equity in low-income and middle-income countries using household health surveys: a spatiotemporal cross-sectional study », The Lancet Global Health, vol. 7, no 11, , e1511–e1520 (ISSN 2214-109X, PMID 31558383, PMCID 7024997, DOI 10.1016/S2214-109X(19)30413-9)
- « Géohelminthiases », sur www.who.int (consulté le )
- WHO, Eliminating Soil-transmitted Helminthiasis as a Public Health Problem in Children: Progress Report 2001–2010 and Strategic Plan 2011–2020, WHO Press, World Health Organization, Geneva, Switzerland, , 1–78 p. (ISBN 978-92-4-150312-9, lire en ligne)
- « CDC - Hookworm »,
- « Effect of sanitation on soil-transmitted helminth infection: systematic review and meta-analysis », PLOS Medicine, vol. 9, no 1, , e1001162 (PMID 22291577, PMCID 3265535, DOI 10.1371/journal.pmed.1001162)
- « Water, sanitation, hygiene, and soil-transmitted helminth infection: a systematic review and meta-analysis », PLOS Medicine, vol. 11, no 3, , e1001620 (PMID 24667810, PMCID 3965411, DOI 10.1371/journal.pmed.1001620)
- « Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm », Lancet, vol. 367, no 9521, , p. 1521–32 (PMID 16679166, DOI 10.1016/S0140-6736(06)68653-4, S2CID 8425278)
- « Neglected Tropical Diseases », cdc.gov, (consulté le )
- OMS, Lutte contre les helminthiases chez les enfants d’âge scolaire : Guide à l’intention des responsables des programmes de lutte - Deuxième édition, Organisation mondiale de la santé, , 75 p. (ISBN 978 92 4 254826 6, lire en ligne)
- « Soil-transmitted Helminthiasis in the United States: a systematic review—1940–2010 », The American Journal of Tropical Medicine and Hygiene, vol. 85, no 4, , p. 680–4 (PMID 21976572, PMCID 3183777, DOI 10.4269/ajtmh.2011.11-0214, lire en ligne)
- Hotez, Brindley, Bethony et King, « Helminth infections: the great neglected tropical diseases », The Journal of Clinical Investigation, vol. 118, no 4, , p. 1311–1321 (PMID 18382743, PMCID 2276811, DOI 10.1172/JCI34261)
- Mascarini-Serra, « Prevention of Soil-transmitted Helminth Infection », Journal of Global Infectious Diseases, vol. 3, no 2, , p. 175–182 (PMID 21731306, PMCID 3125032, DOI 10.4103/0974-777X.81696)
- Parija, Chidambaram et Mandal, « Epidemiology and clinical features of soil-transmitted helminths », Tropical Parasitology, vol. 7, no 2, , p. 81–85 (PMID 29114484, PMCID 5652059, DOI 10.4103/tp.TP_27_17)
- Ramamoorthy, « Anaesthesia and Ascaris pneumonia (Loeffler's syndrome) », Indian Journal of Anaesthesia, vol. 59, no 2, , p. 125–126 (PMID 25788748, PMCID 4357880, DOI 10.4103/0019-5049.151379)
- Sarinas et Chitkara, « Ascariasis and hookworm », Seminars in Respiratory Infections, vol. 12, no 2, , p. 130–137 (PMID 9195678, lire en ligne)
- Loukas, Hotez, Diemert et Yazdanbakhsh, « Hookworm infection », Nature Reviews, vol. 2, , p. 16088 (PMID 27929101, DOI 10.1038/nrdp.2016.88)
- « Soil-transmitted helminth infections Fact sheet N°366 », who.int, (consulté le )
- « Determining soil-transmitted helminth infection status and physical fitness of school-aged children », Journal of Visualized Experiments, vol. 66, no 66, , e3966 (PMID 22951972, PMCID 3486755, DOI 10.3791/3966)
- « The promise and pitfalls of mass drug administration to control intestinal helminth infections », Current Opinion in Infectious Diseases, vol. 25, no 5, , p. 584–9 (PMID 22903231, DOI 10.1097/QCO.0b013e328357e4cf, S2CID 34575855, lire en ligne)
- « An in-depth analysis of a piece of shit: distribution of Schistosoma mansoni and hookworm eggs in human stool », PLOS Neglected Tropical Diseases, vol. 6, no 12, , e1969 (PMID 23285307, PMCID 3527364, DOI 10.1371/journal.pntd.0001969)
- « Estimating the sensitivity and specificity of Kato-Katz stool examination technique for detection of hookworms, Ascaris lumbricoides and Trichuris trichiura infections in humans in the absence of a 'gold standard' », International Journal for Parasitology, vol. 40, no 4, , p. 399–404 (PMID 19772859, PMCID 2829363, DOI 10.1016/j.ijpara.2009.09.003)
- « WHO | Strategy » [archive du ], WHO (consulté le )
- « Prevention of Soil-transmitted Helminth Infection », Journal of Global Infectious Diseases, vol. 3, no 2, , p. 175–82 (PMID 21731306, PMCID 3125032, DOI 10.4103/0974-777X.81696)
- Taylor-Robinson, Maayan, Donegan et Chaplin, « Public health deworming programmes for soil-transmitted helminths in children living in endemic areas », The Cochrane Database of Systematic Reviews, vol. 9, no 11, , p. CD000371 (ISSN 1469-493X, PMID 31508807, PMCID 6737502, DOI 10.1002/14651858.CD000371.pub7)
- WHO, Preventive Chemotherapy in Human Helminthiasis : Coordinated Use of Anthelminthic Drugs in Control Interventions : a Manual for Health Professionals and Programme Managers, WHO Press, World Health Organization, Geneva, Switzerland, , 1–61 p. (ISBN 978-9241547109, lire en ligne)
- « Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis », JAMA, vol. 299, no 16, , p. 1937–48 (PMID 18430913, DOI 10.1001/jama.299.16.1937)
- « Malaria and helminthic co-infection among HIV-positive pregnant women: prevalence and effects of antiretroviral therapy », Acta Tropica, vol. 124, no 3, , p. 179–84 (PMID 22940013, DOI 10.1016/j.actatropica.2012.08.004)
- « Efficacy and safety of nitazoxanide, albendazole, and nitazoxanide-albendazole against Trichuris trichiura infection: a randomized controlled trial », PLOS Neglected Tropical Diseases, vol. 6, no 6, , e1685 (PMID 22679525, PMCID 3367984, DOI 10.1371/journal.pntd.0001685)
- « Advances with the Chinese anthelminthic drug tribendimidine in clinical trials and laboratory investigations », Acta Tropica, vol. 126, no 2, , p. 115–26 (PMID 23352956, DOI 10.1016/j.actatropica.2013.01.009)
- (en) Ashraf F. Hefny, Yousif A. Saadeldin et Fikri M. Abu-Zidan, « Management algorithm for intestinal obstruction due to ascariasis: a case report and review of the literature », Ulusal Travma ve Acil Cerrahi Dergisi = Turkish Journal of Trauma & Emergency Surgery, vol. 15, no 3, , p. 301–5 (PMID 19562557)
- « Rescuing the bottom billion through control of neglected tropical diseases », Lancet, vol. 373, no 9674, , p. 1570–5 (PMID 19410718, DOI 10.1016/S0140-6736(09)60233-6, S2CID 18371227)
- Sangalang, Medina, Ottong et Lemence, « Protocol for a Trial Assessing the Impacts of School-Based WaSH Interventions on Children's Health Literacy, Handwashing, and Nutrition Status in Low- and Middle-Income Countries », International Journal of Environmental Research and Public Health, vol. 18, no 1, , p. 226 (PMID 33561075, PMCID 7795080, DOI 10.3390/ijerph18010226)
- Muslim, Lim, Mohd Sofian et Shaari, « Nutritional status, hemoglobin level and their associations with soil-transmitted helminth infections between Negritos (indigenous) from the inland jungle village and resettlement at town peripheries », PLOS ONE, vol. 16, no 1, , e0245377 (PMID 33439889, PMCID 7806132, DOI 10.1371/journal.pone.0245377, Bibcode 2021PLoSO..1645377M)
