Autoprotolyse
L'autoprotolyse est une réaction de transfert de proton entre deux molécules identiques, l'une jouant le rôle d'acide au sens de Brønsted et l'autre celui de base[1].
Écriture générale[modifier | modifier le code]
L'autoprotolyse est une réaction de type acido-basique au cours de laquelle une espèce au caractère amphotère (on dit également un ampholyte) réagit sur elle-même (d'où le préfixe auto-). Si on note cette espèce amphotère HA :
- HA se comporte comme un acide et libère un proton H+ :
- HA se comporte comme une base et accepte un proton H+ :
L'équation chimique d'une autoprotolyse est donc de la forme générale :
Autoprotolyse de l'eau[modifier | modifier le code]
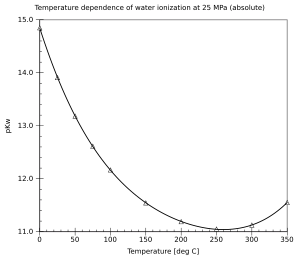
L'eau se comporte comme un acide et libère un proton H+:
L'eau se comporte comme une base et accepte un proton H+:
Les ions OH− et H3O+ ainsi formés sont immédiatement solvatés (hydratés). On écrit donc :
Constante d'équilibre : produit ionique de l'eau[modifier | modifier le code]
La constante d'équilibre de cette réaction est également appelée « produit ionique de l'eau » et notée Ke :
- Ke = [H3O+(aq)] · [OH−(aq)]
À 25 °C, Ke vaut 10−14.
Pour de l'eau pure, on en déduit que :
- [H3O+(aq)] = [OH−(aq)] = 10−7 mol/L,
d'où son pH :
- pH = –log [H3O+(aq)] = 7.
C'est pourquoi le pH de la neutralité de l'eau à la température de 25 °C est fixé à 7.
En fait, il est plus exact de travailler avec des activités et non des concentrations, mais on peut faire l'hypothèse que les concentrations sont suffisamment diluées pour justifier l'approximation suivie.
Autres espèces amphotères[modifier | modifier le code]
Autoprotolyse de l'ammoniac :
Autoprotolyse de l'ion hydrogénocarbonate :
Notes et références[modifier | modifier le code]
- (en) « Autoprotolysis », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)








