Perméabilité de la barrière hémato-encéphalique
Pendant la mise au point de nouveaux médicaments, une grandeur pharmacologique est très importante : c'est dans quelle mesure une substance est capable de traverser la barrière hémato-encéphalique (en anglais brain uptake). Ceci est important tant pour les médicaments psychotropes, qui doivent exercer leur action dans le système nerveux central, que pour les médicaments destinés aux organes périphériques, et qui ne doivent surtout pas y pénétrer[1]. Pour la recherche du débit et du mécanisme de pénétration dans la barrière hémato-encéphalique d'une substance donnée, une série de méthodes différentes ont été mises au point dans le passé. Les procédés classiques travaillent sur des organismes modèles in vivo. Comme la barrière hémato-encéphalique est construite pratiquement de la même manière chez tous les mammifères, les résultats obtenus in vivo se transposent avec une bonne précision à l'homme. Des méthodes plus modernes utilisent des cultures de cellules (in vitro), et tout dernièrement, on a commencé à travailler avec des simulations sur ordinateur (in silico)[2].
Bases physiques
[modifier | modifier le code]Un modèle simplifié, basé sur un seul capillaire a été mis au point par Renkin (1959) et Crone (1965) pour mesurer la perméabilité de la barrière hémato-encéphalique. Malgré les simplifications, ce modèle est la meilleure approximation des conditions réelles[3]. Le produit perméabilité-surface (anglais : permeability surface area product) PS est une mesure de la perméabilité globale de l'échantillon de capillaire. Ce produit, aussi désigné comme « constante de Crone-Renkin »[4], est le produit du coefficient de perméabilité d'une substance donnée et de la surface disponible pour le transfert. L'unité de mesure est ml•min-1•g-1 (g pour la masse de tissu mouillé), et correspond au débit sanguin Q. La fraction unidirectionnelle extraite E est la fraction d'une substance qui passe dans le cerveau en un seul passage. Elle est donnée par :
Quand le débit Q est plus petit que le produit perméabilité-surface PS, le transfert de matière est limité par l'apport sanguin. Inversement, pour Q plus grand que PS, le transfert de matière est limité par la perméabilité[5],[6].
Par principe, la valeur de E est toujours inférieure à 1 pour toutes les substances, car l'influx ne peut pas être supérieur à l'apport sanguin. Pour des valeurs inférieures à 0,2, on dit d'habitude que c'est la perméabilité qui est le facteur limitant pour le transport au cerveau. Dans le domaine 0,2 à 0,8, on dit que la perméabilité est modérée[3].
Procédés in silico
[modifier | modifier le code]Les procédés de simulation sont utilisés avant tout dans la phase de tout début de la mise au point d'une substance, le drug design. Les modèles de calcul se limitent actuellement à la diffusion passive et à quelques descripteurs moléculaires, tels que la lipophilie, la charge, la masse molaire et le nombre de liaisons hydrogène[2].
Procédés in vitro
[modifier | modifier le code]
Dans les cellules endothéliales en culture on peut faire une quantité de recherches quantitatives sur le comportement des substances à la barrière hémato-encéphalique.
Le procédé in vitro le plus simple est l’utilisation de vaisseaux isolés, encore vivants. On peut y faire des recherches sur les mécanismes de transport au niveau cellulaire[7]. Et l'on peut parfois utiliser pour cela des capillaires humains issus d'autopsies. Les capillaires sont encore actifs sur le plan métabolique après le prélèvement, même si la provision d'ATP dans les cellules est largement entamée[8]. Dans ce processus, cependant, les deux faces, luminale et abluminale, des cellules endothéliales sont exposées à la substance étudiée. Il n'est donc pas possible de faire une différence entre les deux faces en ce qui concerne leur interaction avec la substance. Au moyen de la microscopie à fluorescence confocale, on peut analyser la distribution spatiale sur les capillaires incubés. Par exemple, on peut étudier l'absorption d'anticorps monoclonaux sur le récepteur de la transferrine[9]. La méthode peut être raffinée au point de permettre des dosages semi-quantitatifs sur l'efflux de substances du côté luminal des endothéliums[10],[2].
Avec des lignées de cellules endothéliales immortalisées, on peut obtenir des résultats quantitatifs sur la perméabilité à une substance. Il y a maintenant une grande variété de lignées. Celles-ci sont utilisées aussi bien pour la recherche fondamentale que pour la mise au point de médicaments[11],[12]. Les cellules endothéliales sont, comme dans le capillaire, entretenues en couches simples (monolayer). La qualité de ces couches se juge par exemple par la résistance électrique de la couche épithéliale (trans endothelial electrical resistance = TEER), qui doit se montrer aussi haute que possible. Dans l'organisme vivant, cette valeur est supérieure à 2 000 Ω cm2, et dépend de façon primordiale de la qualité des jonctions serrées. In vitro, on n'atteint que des valeurs inférieures d'un ordre de grandeur au mieux à cette valeur[11]. Ces valeurs s'améliorent substantiellement si l'on utilise des cultures mixtes d'astrocytes et de cellules endothéliales. Les astrocytes influencent positivement l'expression des gènes responsables de la formation des jonctions serrées. De cette manière, on peut atteindre des valeurs jusqu’à 800 Ω cm2[13]. Des valeurs également grandes peuvent aussi être atteintes sans astrocytes, mais en ajoutant du cortisol à la culture[14],[2].
Procédés in vivo
[modifier | modifier le code]
Le premier procédé, utilisé par Paul Ehrlich pour représenter l'(im)perméabilité de la barrière hémato-encéphalique a été l'injection de colorants suivie de l'examen anatomique de l'animal. Les colorants susceptibles de franchir la barrière hémato-encéphalique colorent le milieu encéphalique de façon tenace. Le procédé est limité par le choix des colorants, et ne permet que des conclusions qualitatives. On utilise encore les colorants pour les recherches sur des lésions volontaires de la barrière hémato-encéphalique[15]. Pour la même raison, la méthode de marquage par fluorescence – très couramment employées en microbiologie – sont totalement inadaptées pour les recherches sur les mécanismes de transport de petites molécules à la barrière hémato-encéphalique. Ce n'est que pour les très grosses molécules, comme les polypeptides, où les molécules de colorant fluorescent sont relativement petites par rapport à celle du peptide, que l'on peut utiliser le marquage par fluorescence.
Dans le passé, on a mis au point toute une série de procédés in vivo différents, que l'on trouve encore aujourd'hui en usage. En général, les méthodes in vivo sont les procédés de référence. Actuellement, on ne peut pas remplacer l'application intra-artérielle ou intra-veineuse d'un produit actif dans des conditions physiologiques réelles, puis l'analyse du tissu cérébral, par quelque procédé in vitro que ce soit, et encore moins par un calcul de simulation. Ce sont les procédés de plus haute sensibilité, avec lesquels on peut déterminer l'absorption d'une substance dans le cerveau, pendant de longues périodes, et avec de nombreuses occasions de passage à travers la barrière hémato-encéphalique[2].
Indice d'absorption cérébrale
[modifier | modifier le code]Les premières tentatives pour quantifier l'absorption de substances nutritives et actives à travers la barrière hémato-encéphalique ont été mises au point en 1970 par William H. Oldendorf[16]. Une substance marquée radioactivement est injectée avec une substance de référence également marquée, directement dans l’artère carotide de l’animal (le plus souvent un rat). Environ 5 s après l'injection, l'animal est décapité, le cerveau isolé et la concentration des substances radioactives contenues est mesurée. On calcule l'indice d'absorption cérébrale (Brain Uptake Index ou BUI) par le double rapport entre les doses radioactives de la substance T injectée et de la substance de référence R entre l'injection et la dissection :
Ce procédé, en raison de l'intervalle très court dans lequel les substances doivent être injectées et peuvent pénétrer la barrière, n'est approprié que pour des substances qui pénètrent la barrière assez rapidement. Les composés hydrophiles, comme beaucoup de peptides, ne passent que lentement. Pour ce genre de substances, la méthode est inappropriée[17],[18].
Les composés à rechercher sont la plupart du temps marqués au tritium ou au carbone 14. Les substances de référence sont l'eau tritiée ou le butanol au carbone 14[19]. Ceci permet de maintenir au minimum le volume injecté : il est nécessaire de maintenir le volume inférieur à 10 µl pour éviter les artefacts de circulation et de répartition des produits, car ceux-ci pourraient altérer la mesure du BUI[20]. Le BUI par contre dépend peu de la concentration de la substance injectée[21].
| Composé | BUI [%] | log P | M (g/mol) |
| Cytosine | 1,2 | -1,72 | 243,2 |
| Urée | 1,4 | -1,52 | 60,1 |
| Mannitol | 2 | -2,11 | 182,2 |
| Thio-urée | 5 | -0,96 | 76,12 |
| Éthylène glycol | 18 | -1,3 | 62,1 |
| Acétamide | 23 | -1,1 | 59,1 |
| Méthanol | 103 | -0,52 | 32 |
| Propylène glycol | 27 | -0,92 | 76,1 |
| Éthanol | 107 | -0,18 | 46,1 |
| Butanol | 117 | 0,93 | 74,1 |
| Alcool benzylique | 94 | 1,1 | 108,1 |
| Phénobarbital | 56 | 1,42 | 232,2 |
| Phénazone | 83 | 0,38 | 188,2 |
| Caféine | 103 | 0,02 | 194,2 |
| Phénytoïne | 71 | 2,4 | 252,3 |
| Estradiol | 94 | 2,61 | 272,4 |
| Testostérone | 85 | 3,28 | 288,4 |
| Héroïne | 87 | 1,14 | 369,4 |
| Morphine | 2,6[2] | -0,2[23] | 285,3 |
| Nicotine | 120[24] | 0,7[25] | 162,2 |
Les données, sauf indication contraire, proviennent de la référence[26].
Indice d'efflux cérébral
[modifier | modifier le code]Ce procédé, mis au point en 1995, permet de déterminer l'efflux d'une substance à partir du cerveau vers la circulation sanguine à travers la barrière hémato-encéphalique[27],[28].
Comme pour l'indice d'absorption cérébrale, la substance à tester marquée radioactivement est injectée avec une substance de référence, radioactive aussi, directement dans le cerveau, par une microinjection. Cependant la substance de référence est choisie parmi celles les moins aptes à traverser la barrière hémato-encéphalique – souvent de l'inuline. Ici aussi, l'animal est décapité au bout d'un certain temps, et son cerveau est disséqué. La radioactivité est alors mesurée sur le même côté du cerveau (ipsilatéralement). De la fraction de la substance à tester T qui reste dans le cerveau, et similairement pour la substance de référence R, on définit l'indice d'efflux cérébral (Brain Efflux Index) BEI :
- [18].
Perfusion cérébrale
[modifier | modifier le code]Dans la technique de perfusion, la substance à tester, toujours marquée radioactivement, est perfusée dans la carotide. Puis, après le sacrifice de l’animal, le cerveau est isolé et homogénéisé, et sa radioactivité est mesurée. L'avantage de la méthode est qu'une dégradation éventuelle du substrat dans le sang, par exemple par les enzymes qui s'y trouvent, se trouve largement empêché[28]. Les animaux utilisés dans cette technique sont de préférence des cochons d'Inde, car leur carotide ne présente pas de bifurcation entre le cou et le cerveau, contrairement au cas du rat. Ceci permet d'élever le temps de perfusion jusqu'à 30 min, tandis que pour le rat, on ne peut pas dépasser 20 s[29]. Cette méthode exige d'importants moyens. C'est pourquoi est n'est en réalité utilisée que pour des substances dont la stabilité dans le plasma est insuffisante, ou ne possèdent qu'une très faible possibilité de pénétrer dans le cerveau[18].
Une variante améliorée est la méthode d'appauvrissement de capillaires (Capillary Depletion Method). Elle consiste à séparer les capillaires du tissu nerveux par centrifugation[30]. Ceci permet de distinguer entre une véritable perméation dans le cerveau et une simple endocytose dans l'endothélium capillaire[18].
Technique de diffusion d'indicateur
[modifier | modifier le code]Dans la technique de diffusion d'indicateur (Indicator Diffusion Technique) la substance à tester est appliquée avec une substance qui n'a aucune possibilité de traverser la barrière hémato-encéphalique, dans la carotide. Les deux substances ne doivent pas être radioactivement marquées. Sur le retour du sang, par exemple sur la veine jugulaire interne, on détermine la concentration des deux substances par prise de sang et analyse du plasma. On calcule la perméation de la substance test dans le cerveau à partir de la fraction qui manque dans le sang de retour[31].
Cette technique ne convient pour le cerveau que pour les substances qui ont une grande capacité à franchir la barrière hémato-encéphalique[32].
Autoradiographie quantitative
[modifier | modifier le code]Voir dans le Wikilivre sur la photographie, les articles spécialisés sur l'autoradiographie et la fluorographie.

La figure ci-contre montre un exemple d'autoradiographie sur un cerveau d'embryon de rat. Les domaines les plus radioactifs sont les plus sombres. C'est le cas en particulier dans la zone subventriculaire (SVZ). Ailleurs, la barrière hémato-encéphalique empêche le passage du marqueur dans le cerveau. Le trait noir donne une longueur de 2 mm. Le marquage a été réalisé avec des séquences d'oligonucléotides conjuguées avec du 35S-dATP déoxyadénosine triphosphate, liées à du GAD67 (Glutamate décarboxylase 67).
L'autoradiographie a été mise au point dans les années 1970[33]. Dans ce procédé, on injecte en intraveineuse une substance marquée radioactivement, la plupart du temps avec du 14C. À un certain moment, les organes sont disséqués et les coupes faites au microtome à froid, et séchées, sont déposées sur un film à rayons X ou sur un détecteur à scintillation à haute résolution. Par le degré de noircissement, ou respectivement la dose de radiation détectée, on peut mesurer l'absorption de la substance test dans le cerveau, après une calibration par exemple avec de l'albumine marquée à l’iode-125. Ceci s'applique aussi bien au cerveau qu'à d'autres organes. Si l'on mesure par d'autres moyens la quantité de sang irriguant la région examinée, on accède par le calcul au produit perméabilité-surface[34].
Microdialyse intracérébrale
[modifier | modifier le code]Pour la microdialyse intracérébrale, on implante dans le tissu nerveux une membrane hémiperméable. Par un microcathéter se terminant dans cette membrane, on peut perfuser des substances. Dans la foulée, on recueille par le même cathéter des échantillons du liquide interstitiel et on les analyse.
On peut ainsi pratiquer sur des animaux de nombreuses recherches et expériences sur la barrière hémato-encéphalique. Par exemple, l'ouverture décrite ci-après de la barrière par une solution hypertonique[35].
Cette méthode est bien adaptée aux prises de liquide continues. On peut établir ainsi le profil de la concentration dans le temps de substances injectées par voie intra-veineuse ou intra-artérielle[36],[37].
Les expériences les plus variées pour étudier les mécanismes de transport à la barrière hémato-encéphalique peuvent être conduites au moyen de la microdialyse intracérébrale[35],[38],[39],[18].
En médecine humaine, la microdialyse intracérébrale est utilisée pour le monitoring neurochimique en cas d'accident vasculaire cérébral[40],[41].
Procédés d'imagerie
[modifier | modifier le code]Au moyen des procédés d'imagerie, on peut avoir de façon non invasive une représentation et une mesure de la perméabilité de la barrière hémato-encéphalique pour diverses substances. Ces procédés sont en partie utilisés en pratique clinique pour la médecine humaine. Nous ne serons pas intéressés ici par la radiographie ni même par la tomodensitométrie, son perfectionnement, car ils ne sont essentiellement sensibles qu'aux os du crâne. Les principaux en ce qui nous concerne ici sont la tomographie par émission de positons (TEP), l'imagerie par résonance magnétique (IRM) et la spectroscopie par résonance magnétique (SRM).
La tomographie par émission de positons
[modifier | modifier le code]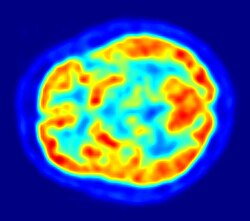
Avec la tomographie par émission de positons, on représente dans l'essentiel pour l'étude de la barrière hémato-encéphalique les processus d'efflux de substances potentiellement actives par la P-glycoprotéine[42]. La compréhension de la fonction de la P-glycoprotéine et des influences exercées sur elle à la barrière hémato-encéphalique est de grande importance pour la mise au point de médicaments psychotropes[43]. Ces recherches fondamentales sont menées avec des substances marquées avec un émetteur de positons (désintégration bêta+ – β+). La plupart du temps, il s'agit du carbone 11 (11C). Pour des composés fluorés, on préfère utiliser le fluor-18 (18F) à courte période. En raison des courtes demi-vies de ces isotopes (20,39 min pour le 11C et 110 min pour le 18F), ces expériences ne peuvent être faites que dans des instituts de recherche proches d'un cyclotron. Par exemple, on a pu ainsi marquer et étudier le vérapamil[44], le carazolol[42], le lopéramide[45]. Le vérapamil est d'un intérêt pharmacologique particulier, car il semble capable d'inhiber la P-glycoprotéine.
La TEP est l'une des rares méthodes, qui permette une comparaison directe in vivo entre des organismes utilisés en phase préclinique et le patient, en ce qui concerne l'interaction entre la substance active et la P-glycoprotéine[46].
Imagerie par résonance magnétique (IRM)
[modifier | modifier le code]L'imagerie par résonance magnétique (IRM), en tant que procédé d'imagerie, est trop insensible pour représenter le passage des substances actives à travers une barrière hémato-encéphalique saine. Il en va tout autrement en cas de lésion. Dans ce cas, l'IRM avec produit de contraste joue un grand rôle pour diverses maladies neurodégératives ou cancéreuses dans le domaine du cerveau. Ceci est abordé dans l’article sur les maladies directement associées avec la barrière hémato-encéphalique.
Spectroscopie par résonance magnétique (SRM)
[modifier | modifier le code]
La SRM est basé sur la résonance magnétique nucléaire, qui permet au travers d'un tomographe à résonance magnétique la spectroscopie en résonance magnétique. Ceci permet de prouver la présence de certaines substances dans le cerveau, ainsi que de leurs produits de réaction, de façon quantitative. Par rapport à l’IRM qui se base sur les spins des protons de l’eau, on s'y intéresse à d'autres noyaux atomiques, notamment 19F, 13C, 31P, ainsi que des protons dans des matières autres que l'eau. Par comparaison avec les protons de l'eau présents en bien plus grandes quantités, les noyaux étudiés, parfois présents uniquement en traces, donnent des signaux bien plus faibles. La résolution spatiale correspond à un voxel (élément de volume séparé) de l’ordre de 1 cm3. On combine facilement la SRM et l'IRM : l'IRM précise la structure anatomique, et la SRM la composition corrélative. On peut par exemple étudier avec la SRM qualitativement et quantitativement la pharmacocinétique des composés fluorés, comme les neuroleptiques trifluopérazine ou fluphénazine, dans le cerveau humain[48]. La spectroscopie par résonance magnétique permet de distinguer quantitativement entre le médicament et ses métabolites. De même, on peut faire la différence entre les états libres et liés de la substance[49],[50].
Les inconvénients de la SRM sont les longs temps de mesure et la faible résolution spatiale, dus à la faible sensibilité de la méthode. Le dernier point est particulièrement problématique quand il s'agit d'expérience sur de petits animaux[37].
Bibliographie
[modifier | modifier le code]- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Blut-Hirn-Schranke » (voir la liste des auteurs).
- Extraits du cours de PCEM1 du Pr Bertrand Bloch (PU-PH) sur le tissu nerveux, Université Victor Segalen, Bordeaux 2.
- (en) D. Kobiler, Blood-brain Barrier., Springer Verlag, (ISBN 0-306-46708-9)
- (en) W. M. Pardridge, Introduction to the Blood-brain Barrier., Cambridge University Press, (ISBN 0-521-58124-9)
- (en) E. de Vries et A. Prat, The Blood-brain Barrier and Its Microenvironment., Taylor & Francis, (ISBN 0-8493-9892-4)
Voir aussi
[modifier | modifier le code]Références
[modifier | modifier le code]- (en) N. Bodor et P. Buchwald, « Recent advances in the brain targeting of neuropharmaceuticals by chemical delivery systems. », Adv. Drug Deliv. Rev., vol. 36, , p. 229–254 (PMID 10837718) (article de revue).
- (en) Ulrich Bickel, « How to measure drug transport across the blood-brain barrier. », NeuroRx, vol. 2, , p. 15–26 (PMID 15717054, lire en ligne) (article de revue).
- J. Fenstermacher et L. Wei, « Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography. », dans W. M. Pardridge, Introduction to the Blood-brain Barrier, Cambridge University Press, (ISBN 0-521-58124-9), p. 122–132
- C. Crone et D. G. Levitt, « Capillary permeability to small solutes. », dans Handbook of Physiology, American Physiological Society, , p. 375–409
- (de) Harald Pötzsch, « Perfusionscomputertomographische Meßparameter im Kontext klinikopathologischer Eigenschaften von Plattenepithelkarzinomen der Mundhöhle und des Oropharynx. », Thèse de doctorat, Freie Universität Berlin, (lire en ligne)
- (en) A. M. Peters, « Fundamentals of tracer kinetics for radiologists. », Br. J. Radiol., vol. 71, , p. 1116–1129 (PMID 10434905, lire en ligne) (article de revue).
- (en) Y. Takakura, K.L. Audus et R.T. Borchardt, « Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells. », Adv. Pharmacol., vol. 22, , p. 137–165 (PMID 1958501) (article de revue)
- (en) F. Lasbennes et J. Gayet, « Capacity for energy metabolism in microvessels isolated from rat brain. », Neurochem. Res., vol. 9, , p. 1–10 (PMID 6325972)
- (en) J. Huwyler et W. M. Pardridge, « Examination of blood-brain barrier transferrin receptor by confocal fluorescent microscopy of unfixed isolated rat brain capillaries. », J. Neurochem., vol. 70, , p. 883–886 (PMID 9453586)
- (en) David S. Miller, Stephanie N. Nobmann, Heike Gutmann, Michael Toeroek, Juergen Drewe et Gert Fricker, « Xenobiotic transport across isolated brain microvessels studied by confocal microscopy. », Mol. Pharmacol., vol. 58, , p. 1357–1367 (PMID 11093774, lire en ligne)
- (en) M. Gumbleton et K. L. Audus, « Progress and limitations in the use of in vitro cell cultures to serve as a permeability screen for the blood-brain barrier. », J. Pharm. Sci., vol. 90, , p. 1681–1698 (PMID 11745727) (article de revue).
- (en) A. Reichel, D. J. Begley et N. J. Abbott, « An overview of in vitro techniques for blood-brain barrier studies. », Methods Mol. Med., vol. 89, , p. 307–324 (PMID 12958429)
- (en) R. Cecchelli, B. Dehouck, L. Descamps, L. Fenart, V. V. Buée-Scherrer, C Duhem, S. Lundquist, M. Rentfel, G. Torpier et M. P. Dehouck, « In vitro model for evaluating drug transport across the blood-brain barrier. », Adv. Drug Deliv. Rev., vol. 36, , p. 165–178 (PMID 10837714)
- (en) D. Hoheisel, T. Nitz, H. Franke, J. Wegener, A. Hakvoort, T. Tilling et H. J. Galla, « Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. », Biochem. Biophys. Res. Commun., vol. 247, , p. 312–315 (PMID 9679029)
- (en) Scott B. Raymond, Lisa H. Treat, Jonathan D. Dewey, Nathan J. McDannold, Kullervo Hynynen et Brian J. Bacskai, « Ultrasound Enhanced Delivery of Molecular Imaging and Therapeutic Agents in Alzheimer's Disease Mouse Models. », PLoS ONE, vol. 3, , e2175 (PMID 18478109, lire en ligne)
- (en) William H. Oldendorf, « Measurement of brain uptake of radiolabeled substances using a tritiated water internal standard. », Brain Res., Elsevier, vol. 24, , p. 372–376 (PMID 5490302)
- (en) J. D. Fenstermacher, R. G. Blasberg et C. S. Patlak, « Methods for quantifying the transport of drugs across the blood-brain system. », Pharmacol. Ther., vol. 14, , p. 217–248 (PMID 7031708)
- (de) Stephanie Nobmann, « Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke », Ruprecht-Karls-Universität Heidelberg, (consulté le )
- (en) G. Molema et D. K. F. Meijer, Drug Targeting : Organ-specific Strategies, Wiley-VCH, (ISBN 3-527-29989-0)
- (en) J. E. Hardebo et B. Nilsson, « Estimation of cerebral extraction of circulating compounds by the brain uptake index method: influence of circulation time, volume injection, and cerebral blood flow. », Acta Physiol. Scand., vol. 107, , p. 153–159 (PMID 525379)
- (en) Yoshiaki Moriki, Toyofumi Suzuki, Toshiro Fukami, Manabu Hanano, Kazuo Tomono et Jun Watanabe, « Involvement of P-glycoprotein in blood-brain barrier transport of pentazocine in rats using brain uptake index method. », Biol. Pharm. Bull., vol. 27, , p. 932–935 (PMID 15187451)
- (en) EM Cornford, LD Braun, WH Oldendorf et MA Hill, « Comparison of lipid-mediated blood-brain-barrier penetrability in neonates and adults. », Am. J. Physiol., vol. 243, , p. 161C–168C (PMID 7114247)
- (en) L. J. Murphey et G. D. Olsen, « Diffusion of morphine-6-beta-D-glucuronide into the neonatal guinea pig brain during drug-induced respiratory depression. », J. Pharmacol. Exp. Ther., vol. 271, , p. 118–124 (PMID 7965704).
- (en) W H Oldendorf, B E Stoller et F L Harris, « Blood-brain barrier penetration abolished by N-methyl quaternization of nicotine. », PNAS, National Academy of Sciences (États-Unis), vol. 90, , p. 307–311 (PMID 8419935, lire en ligne)
- (en) Dino Magnani, « Untersuchungen der Fremdstoffbindung in permanenten Keratinozyten- und Melanozyten-Zellinien sowie die Eignung von Primärkulturen aus humanen Haarfollikeln zur In-vitro-Messung der Fremdstoffaufnahme im Haar. », Thèse de doctorat, Carl von Ossietzky Universität Oldenburg, (lire en ligne)
- (en) Roman Kaliszan et Micha Markuszewski, « Brain/blood distribution described by a combination of partition coefficient and molecular mass. », International Journal of Pharmaceutics, Elsevier, vol. 145, , p. 9–16 (DOI 10.1016/S0378-5173(96)04712-6)
- (en) A. Kakee, « Organic anion transport system acting as an efflux pump at the blood-brain barrier: demonstration by a newly developed brain efflux index (BEI) method. », Proc. Int. Symp. Control Release Bioact. Mater., vol. 22, , p. 16–18
- (en) Ikumi Tamai et Akira Tsuji, « Drug delivery through the blood-brain barrier. », Adv. Drug Deliv. Rev., vol. 19, , p. 401–424 (DOI 10.1016/0169-409X(96)00011-7) (article de revue).
- (en) B. V. Zloković, D. J. Begley, B. M. Djuricić et D. M. Mitrovic, « Measurement of solute transport in the perfused guinea pig brain. Method application to N-methyl-alpha-aminoisobutyric acid. », J. Neurochem., vol. 46, , p. 1444–1451 (PMID 3083044)
- (en) D Triguero, J Buciak et WM Pardridge, « Capillary depletion method for quantification of blood-brain barrier transport of circulating peptides and plasma proteins. », J. Neurochem., vol. 54, , p. 1882–1888 (PMID 2338547)
- (en) C. Crone, « The permeability of capillaries in various organs as determined by use of the 'Indicator Diffusion' method. », Acta Physiol. Scand., vol. 58, , p. 292–305 (PMID 14078649)
- (en) J. B. Van Bree, A. G. De Boer, M. Danhof et D. D. Breimer, « Drug transport across the blood-brain barrier, II. Experimental techniques to study drug transport. », Pharma. Weekbl. Sci., vol. 14, , p. 338–348 (PMID 1475172) (article de revue)
- (en) L Sokoloff, M Reivich, C Kennedy, MH Des Rosiers, CS Patlak, KD Pettigrew, O Sakurada et M. Shinohara, « The [14C]deoxyglucose method for the measurement of local cerebral glucose utilization: theory, procedure, and normal values in the conscious and anesthetized albino rat. », J. Neurochem., vol. 28, , p. 897–916 (PMID 864466)
- « Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography. », dans Introduction to the blood-brain barrier: methodology, biology and pathology, Cambridge University Press, (ISBN 0-521-58124-9), p. 122–132
- (en) E. C de Lange, M. B. Hesselink, M. Danhof, A. G. de Boer et D. D. Breimer, « The use of intacerebral microdialysis to determine the changes in blood-brain barrier transport characteristics. », Pharm. Res., vol. 12, , p. 129–133 (PMID 7724474)
- (en) E. C. de Lange, M. Danhof, A. G. de Boer et D. D. Breimer, « Critical factors of intracerebral microdialysis as a technique to determine the pharmacokinetics of drugs in rat brain. », Brain Res., vol. 666, , p. 1–8 (PMID 7889356)
- (en) E. C. de Lange, M. Danhof, A. G. de Boer et D. D. Breimer, « Methodological considerations of intracerebral microdialysis in pharmacokinetic studies on drug transport across the blood-brain barrier. », Brain Res. Brain Res. Rev., vol. 25, , p. 27–49 (PMID 9370049) (article de revue)
- (en) Elizabeth C. M. de Lange, Gertjan de Bock, Alfred H. Schinkel, Albertus G. de Boer et Douwe D. Breimer, « BBB transport and P-glycoprotein functionality using MDR1A (-/-) and wild-type mice. Total brain versus microdialysis concentration profiles of rhodamine-123. », Pharm. Res., Springer, vol. 15, , p. 1657-1665 (PMID 9833984)
- (en) Tetsuya Terasaki, Yoshiharu Deguchi, Hitoshi Sato, Ken-ichi Hirai et Akira Tsuji, « In vivo transport of a dynorphin-like analgesic peptide, E 2078, through the blood-brain barrier: an application of microdialysis. », J. Pharmacol. Exp. Ther., Sringer, vol. 251, , p. 815–820 (PMID 1681528)
- (de) C. Berger, C. Dohmen, M. H. Maurer, R. Graf et S. Schwab, « Zerebrale Mikrodialyse beim Schlaganfall. », Der Nervenarzt, vol. 75, , p. 113-123 (PMID 14770280)
- (de) Giusi Paterno, « Die zerebrale Mikrodialyse », Rapport de stage, (lire en ligne)
- (en) Stina Syvänen, Örjan Lindhe, Mikael Palner, Birgitte R. Kornum, Obaidur Rahman, Bengt Långström, Gitte M. Knudsen et Margareta Hammarlund-Udenaes, « Species differences in blood-brain barrier transport of three PET radioligands with emphasis on P-glycoprotein transport. », Drug Metab. Dispos., vol. 37, , p. 635–643 (PMID 19047468, lire en ligne)
- (en) Joost Bart, Eli C. F. Dijkers, Theodora D. Wegman, Elisabeth G. E. de Vries, Winette T. A. van der Graaf, Harry J. M. Groen, Willem Vaalburg, Antoon T. M. Willemsen et N. Harry Hendrikse, « New positron emission tomography tracer (11)C-carvedilol reveals P-glycoprotein modulation kinetics. », Br. J. Pharmacol., vol. 145, , p. 1045–1051 (PMID 15951832, lire en ligne)
- (en) N. Harry Hendrikse, Elisabeth G. E. de Vries, Lizette Eriks-Fluks, Winette T. A. van der Graaf, Geke A. P. Hospers, Antoon T. M. Willemsen, Willem Vaalburg et Eric J. F. Franssen, « A new in vivo method to study P-Glycoprotein transport in tumors and the blood-brain barrier. », Cancer Res., vol. 59, , p. 2411–2416 (PMID 10344751, lire en ligne)
- (en) Sami S. Zoghbi, Jeih-San Liow, Fumihiko Yasuno, Jinsoo Hong, Edward Tuan, Neva Lazarova, Robert L. Gladding, Victor W. Pike et Robert B. Innis, « 11C-loperamide and its N-desmethyl radiometabolite are avid substrates for brain permeability-glycoprotein efflux. », J. Nucl. Med., vol. 49, , p. 649–656 (PMID 18344435, lire en ligne)
- (en) Véronique Josserand, « Evaluation of Drug Penetration into the Brain: A Double Study by in Vivo Imaging with Positron Emission Tomography and Using an in Vitro Model of the Human Blood-Brain Barrier. », J. Pharmacol. Exp. Ther., vol. 316, , p. 79–86 (PMID 16210395, lire en ligne)
- (en) Daisuke Matsuzawa, « Negative Correlation between Brain Glutathione Level and Negative Symptoms in Schizophrenia: A 3T 1H-MRS Study. », PLoS ONE, vol. 3, , e1944 (PMID 18398470, lire en ligne)
- (en) K Albert, H Rembold, G Kruppa, E Bayer, M Bartels et G Schmalzing, « 19F Nuclear Magnetic Resonance Spectroscopy of neuroleptics: The first in vivo pharmacokinetics of trifluoperazine in the rat brain and the first in vivo spectrum of fluphenazine in the human brain. », Biol. Psychiatry, vol. 30, , p. 656–662 (PMID 2386658)
- (en) J. J. Ackerman, T. H. Grove, G. G. Wong, D. G. Gadian et G. K. Radda, « Mapping of metabolites in whole animals by 31P NMR using surface coils.’ », Nature, vol. 283, , p. 167–170 (PMID 7350541)
- (en) J. W. Prichard, J. R. Alger, K. L. Behar, O. A. Petroff et R. G. Shulman, « Cerebral metabolic studies in vivo by 31P NMR. », PNAS, National Academy of Sciences (États-Unis), vol. 80, , p. 2748–2751 (PMID 6573678, lire en ligne)



