Chlorure de tris(bipyridine)ruthénium(II)
| Chlorure de tris(bipyridine)Ruthénium(II) | ||

| ||
 | ||
| Formule chimique et aspect macroscopique | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Chlorure de tris(bipyridine)ruthénium(II) | |
| Synonymes |
Ru(bpy)3Cl2 |
|
| No CAS | (anhydre) (hexahydraté) |
|
| No ECHA | 100.034.772 | |
| No CE | 238-266-7 | |
| No RTECS | VM2730000 | |
| PubChem | 24878800 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre rouge | |
| Propriétés chimiques | ||
| Formule | C30H24N6Cl2Ru·6H2O | |
| Masse molaire | 640,53 g/mol (anhydre) 748,62 g/mol (hexahydraté) |
|
| Moment dipolaire | 0 D | |
| Propriétés physiques | ||
| T° fusion | >300 °C[1] | |
| Solubilité | assez soluble dans l'eau soluble dans l'acétone |
|
| Précautions | ||
| NFPA 704[1] | ||
| Directive 67/548/EEC | ||
Phrases R : aucun |
||
| Transport[1] | ||
aucune restriction |
||
| Écotoxicologie | ||
| DL50 | 1,999 mg kg−1 (souris, i.v.)[1] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le chlorure de tris(bipyridine)ruthénium(II) est le complexe de formule [Ru(bpy)3]Cl2. Sous sa forme hexahydraté, la plus courante, c'est un sel cristallin rouge, mais c'est sous sa forme cationique ([Ru(bpy)3]2+) qu'il fait le plus l'objet de recherche, du fait des propriétés optiques particulières. Dans ce cadre, son contre-anion chlorure peut alors être remplacé par d'autres anions tels que PF6- pour les moduler.
Synthèse et structure

Ce sel est préparé en traitant une solution aqueuse de chlorure de ruthénium par de la 2,2'-bipyridine. Dans ce processus, Ru(III) est réduit en Ru(II) et on utilise alors en général l'acide hypophosphoreux en tant qu'agent réducteur[2]. [Ru(bpy)3]2+ est un complexe octaédrique entouré par trois ligands bidentés. Ce complexe est chiral dû à l'arrangement des trois ligands et possède une symétrie D3 (notation Schoenflies). Les deux énantiomères sont séparables et cinétiquement stables dans les conditions standards de pression et température. Dans son premier état excité (état triplet), la molécule perd de la symétrie et passe dans une symétrie C2. Cela vient du fait que l'électron excité n'est pas distribué symétriquement entre les trois ligands[3].
Photochimie de [Ru(bpy)3]2+
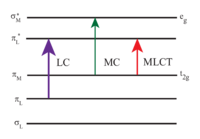
MLCT : Metal to Ligand transfer
LC : Ligand transfer
MC : Metal transfer
[Ru(bpy)3]2+ absorbe à la fois dans la lumière visible et dans l'ultraviolet. En milieu aqueux, la molécule absorbe très fortement à 452 ± 3 nm correspondant à une transition de transfert de charge du ligand vers le métal (ελ = 14,600 mol-1·L-1·cm-1) et à 285 nm correspondant à une transition π*← π des ligands. Il y a également une transition d← d lié au métal autour de 350 nm mais l'absorption est beaucoup moins intense[4]. En solution, l'état excité (état triplet) a un temps d'existence assez long : 890 nanosecondes dans l'acétonitrile[5] et 650 nanosecondes dans l'eau[5]. L'état excité retourne à l'état fondamental par émission d'un photon de longueur d'onde λ = 620 nm. La longue durée de vie de l'état excité est due à la fois à la structure de la molécule qui permet une bonne séparation des charges et au fait que cet état est un état triplet alors que l'état fondamental est un état singulet. En effet les transitions singulet-triplet sont interdites et par conséquent souvent très longues lorsqu'elles s'opèrent.
L'état triplet possède des propriétés oxydantes et réductrices. Cette situation inhabituelle vient du fait que l'état excité peut être décrit comme un complexe de Ru3+ contenant un ligand bpy- chargé négativement. L'électron excité est totalement délocalisé vers un des ligands. Ainsi, on peut dire que les propriétés photochimiques de [Ru(bpy)3]2+ rappellent celles de la photosynthèse qui impliquent également la dissociation d'un électron et d'un trou[6].
Le complexe [Ru(bpy)3]2+ a été étudié comme « photosensibilisateur » pour réaliser à la fois l'oxydation et la réduction de l'eau. En absorbant un photon, [Ru(bpy)3]2+ passe à l'état triplet (mentionné plus haut), noté [Ru(bpy)3]2+*. Cette espèce peut transférer un électron, localisé en grande partie sur un ligand bpy, vers une espèce oxydante sacrificielle telle que le peroxodisulfate (S2O82−). L'espèce résultante est [Ru(bpy)3]3+, un oxydant puissant capable d'oxyder l'eau en O2 en présence d'un catalyseur métallique[7]. D'une autre manière, le pouvoir réducteur de [Ru(bpy)3]2+* peut être activé en réduisant le viologène, espèce intermédiaire régénérée par la suite, qui transfert ses électrons à H+ pour réaliser sa réduction en H2 en présence d'un catalyseur de platine. Un réducteur sacrificiel, tel que l'EDTA ou la triéthylamine doit être engagé pour réduire le Ru(III) formé en Ru(II) et en faire un processus catalytique.
Les espèces dérivées de [Ru(bpy)3]2+ sont nombreuses[8],[9]. Aujourd'hui, ces complexes sont très étudiés pour leur utilisations possibles en biodiagnostics, pour les Cellule Grätzel et pour les OLED mais rien n'a encore été commercialisé. Des applications sont aussi envisageables pour la fabrication de capteurs optiques chimiques[10].
[Ru(bpy)3]2+ et catalyse photorédox
Les catalyseurs photorédox tels que [Ru(bpy)3]2+ utilisant la lumière visible ont été considérés comme un outil pour la synthèse organique depuis les années 1970[11]. Cependant, seuls quelques groupes axent leurs travaux sur ce sujet depuis le début du XXIe siècle. Les recherches sur ce type de chimie se sont activées en 2008 grâce aux travaux des groupes MacMillan[12], Yoon[13] et Stephenson[14]. Selon le choix de désactivateur (quencher en anglais) on peut utiliser [Ru(bpy)3]2+ pour opérer une photoréduction ou une photo-oxydation. Certaines revues récentes traitent de ce qu'il est possible de faire avec ce complexe[11],[15],[16],[17]. D'autres complexes basés sur des métaux tels que l'iridium ou le rhénium présentent des propriétés analogues au complexe [Ru(bpy)3]2+ et sont également en cours d'étude. De plus, en couplant ce catalyseur photochimique avec un catalyseur chiral type acide de Lewis, le groupe Yoon a montré qu'il est possible de réaliser des réactions photochimiques asymétriques dans diverses situations[18]. Cela prouve la possibilité d'exercer un contrôle stéréochimique même par voie photochimique et ouvre de nombreuses perspectives de synthèse.
Sécurité
Les métaux à base de bipyridine tout comme les complexes à base de phénantroline sont généralement bioactifs et peuvent agir comme agent intercalant sur l'ADN.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tris(bipyridine)ruthenium(II) chloride » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Tris(2,2′-bipyridyl)dichlororuthenium(II) hexahydrate powder.
- (en) Broomhead J. A. et Young C. G., « Tris(2,2'-bipyridine)Ruthenium(II) Dichloride Hexahydrate », Inorganic Syntheses, vol. 28, , p. 338–340 (DOI 10.1002/9780470132593.ch86)
- (en) Alvin T. Yeh, Charles V. Shank et James K. McCusker, « Ultrafast Electron Localization Dynamics Following Photo-Induced Charge Transfer », Science, vol. 289, no 5481, , p. 935–938 (PMID 10937993, DOI 10.1126/science.289.5481.935, lire en ligne, consulté le )
- (en) K. Kalyanasundaram, « Photophysics, photochemistry and solar energy conversion with tris(bipyridyl)ruthenium(II) and its analogues », Coordination Chemistry Reviews, vol. 46, , p. 159–244 (DOI 10.1016/0010-8545(82)85003-0, lire en ligne, consulté le )
- (en) Marco Montalti, Alberto Cedi, Luca Prodi et M. Teresa Gandolfi, Handbook of Photochemistry 3rd edition, 6000 Broken Sound Prkway NW, Suite 200 Boca Raton, FL, CRC press Taylor & Francis Group, , 379–404 p. (ISBN 0-8247-2377-5)
- (en) A. J. Bard et M. A. Fox, « Artificial Photosynthesis: Solar Splitting of Water to Hydrogen and Oxygen », Acc. Chem. Res., vol. 28, no 3, , p. 141–145 (DOI 10.1021/ar00051a007)
- (en) M. Hara, C. C. Waraksa, J. T. Lean, B. A. Lewis and T. E. Mallouk, « Photocatalytic Water Oxidation in a Buffered Tris(2,2'-bipyridyl)ruthenium Complex-Colloidal IrO2 System », J. Phys. Chem. A, vol. 104, no 22, , p. 5275–5280 (DOI 10.1021/jp000321x)
- (en) A. Juris, V. Balzani, F. Barigelletti, S. Campagna, P. Belser and A von Zelewsky, « Ru(II) polypyridine complexes - photophysics, photochemistry, electrochemistry, and chemiluminescence », Coord. Chem. Rev., vol. 84, , p. 85–277 (DOI 10.1016/0010-8545(88)80032-8)
- (en) S. Campagna, F. Puntoriero, F. Nastasi, G. Bergamini and V. Balzani, « Photochemistry and photophysics of coordination compounds: ruthenium », Top. Curr. Chem., vol. 280, , p. 117–214 (ISBN 978-3-540-73346-1, DOI 10.1007/128_2007_133)
- (en) G. Orellana* and D. Garcia-Fresnadillo, « Environmental and Industrial Optosensing with Tailored Luminescent Ru(II) Polypyridyl Complexes », Springer Ser. Chem. Sens. Biosens., vol. 1, , p. 309–357 (DOI 10.1007/978-3-662-09111-1_13)
- (en) F. Teply, « Photoredox catalysis by [Ru(bpy)3]2+ to trigger transformations of organic molecules. Organic synthesis using visible-light photocatalysis and its 20th century roots », Free access article, vol. 76, no 7, , p. 859–917 (DOI 10.1135/cccc2011078)
- (en) D. A. Nicewicz et D. W. C. MacMillan, « Merging photoredox catalysis with organocatalysis: The direct asymmetric alkylation of aldehydes », Science, vol. 322, no 5898, , p. 77–80 (PMID 18772399, PMCID 2723798, DOI 10.1126/science.1161976)
- (en) M. A. Ischay, M. E. Anzovino, J. Du et T. P. Yoon, « Efficient visible light photocatalysis of [2+2] enone cycloadditions », J. Am. Chem. Soc., vol. 130, no 39, , p. 12886–12887 (PMID 18767798, DOI 10.1021/ja805387f)
- (en) J. M. R. Narayanam, J. W. Tucker et C. R. J. Stephenson, « Electron-transfer photoredox catalysis: Development of a tin-free reductive dehalogenation reaction », J. Am. Chem. Soc., vol. 131, no 25, , p. 8756–8757 (DOI 10.1021/ja9033582)
- (en) J. M. R. Narayanam et C. R. J. Stephenson, « Visible light photoredox catalysis: applications in organic synthesis », Chem. Soc. Rev., vol. 40, , p. 102–113 (DOI 10.1039/b913880n)
- (en) T. P. Yoon, M. A. Ischay et J. Du, « Visible light photocatalysis as a greener approach to photochemical synthesis », Nat. Chem., vol. 2, no 7, , p. 527–532 (PMID 20571569, DOI 10.1038/nchem.687)
- (en) K. Zeitler, « Photoredox catalysis with visible light », Angew. Chem. Int. Ed., vol. 48, no 52, , p. 9785–9789 (DOI 10.1002/anie.200904056)
- (en) T. P. Yoon, « Photochemical Stereocontrol Using Tandem Photoredox-Chiral Lewis Acid Catalysis », Acc. Chem. Res., vol. 49, , p. 2307-2315 (DOI 10.1021/acs.accounts.6b00280)

